- Медицинская генетика
- Популяционная генетика
- Закон и право
- Генетика поведения
- Геномика
- Спортивная генетика
Обновление библиотеки
- Тест-драйв генетического теста [2018-05-22]
- В чём источник долголетия и зачем проходить генетические тесты [2018-05-08]
- Правила долгожителей [2018-04-25]
- Время генома [2018-04-02]
- Гид по генетическим тестам в России: какой выбрать и где заказать [2018-03-12]
Последние новости
- У некоторых людей нежелание заниматься спортом вписано в ДНК, заявляют ученые из Оксфорда [2019-01-29]
- Особые мутации в геноме могут толкать человека на риск [2019-01-29]
- Китайские власти подтвердили существование CRISPR-детей и еще одну беременность [2019-01-29]
- Роспотребнадзор доработал законопроект о приравнивании генома россиян к персональным данным [2018-10-02]
- Американцы объяснили повышенную популярность 10 процентов генов среди исследователей [2018-09-20]
Геном человека: Энциклопедия, написанная четырьмя буквами
Вячеслав Залманович Тарантул
НЕСКОЛЬКО ВСТУПИТЕЛЬНЫХ СЛОВ
Посвящаю жене, дочери и внучке
Любому человеку — от младшего школьника до пожилого пенсионера — интересно знать, как устроен он сам, почему он болеет, как всегда быть здоровым и что для этого нужно делать. Человеку всегда были близки науки о жизни, биология — одна из самых древних наук. Однако уже в древности стало понятно, что любое живое существо устроено несомненно сложнее, чем любой неодушевленный предмет, любое вещество, самое сложное, проще любого существа, самого примитивного. Сложность познания жизни во всех её многообразных проявлениях связана с несколькими существенными обстоятельствами. Во-первых, жизнь невероятно многообразна. Что общего можно усмотреть между бактерией, не видимой простым глазом, и, на другом конце цепочки, — китом, или слоном, или, наконец, человеком? Во-вторых, живые существа непрерывно меняются, одни виды появляются, другие исчезают. Когда жили динозавры, не было людей, а когда размножились люди, исчезли мамонты и сотни других видов животных и растений. В-третьих, жизнь необычайно чувствительна к окружающей среде, нежна, очень легко ранима. Поместите любое животное на 5–10 минут в бескислородную среду, и живой организм станет мертвым. Наконец, живые организмы необычайно сложно устроены — в их состав входит практически вся таблица Менделеева, тогда как, для сравнения, любое вещество, даже сложное органическое, не использует для построения своих молекул более 2-х десятков элементов менделеевской таблицы.
Одной из самых больших загадок биологии всегда была проблема наследования: почему мышь рождает мышь, а не крокодила? Почему дети похожи на родителей? Почему некоторые болезни передаются у людей и животных по наследству?
Старая, классическая, дарвиновская биология дала качественные, приблизительные, описательные ответы на часть этих вопросов. Биология XX века совершила гигантский скачок в понимании природы жизни, её молекулярных, химических основ. Венцом, вершиной этих титанических усилий всего мирового научного сообщества стала расшифровка строения наследственного аппарата человека, который представляет собой совокупность генов и внегенных участков ДНК — главной молекулы жизни. Коротко всю ДНК, в которой записана наследственная информация о данном организме, называют «геномом».
Раскрытие вчерне строения генома (февраль 2001 года) — событие столь же ключевое для истории человечества, как открытие электричества, атомной энергии, изобретение радио и телефонной связи и компьютеров. Человек, наконец, получил химическую, молекулярную основу для того, чтобы познать самого себя.
XXI век, несомненно, будет веком биологии. Это признают не только биологи, но и ученые других, далеких от биологии специальностей. В этом веке мы узнаем, что такое память, творческие способности, мы научимся защищать себя от многих болезней и лечить заболевания, которые мы сейчас называем неизлечимыми (рак, например).
Эта книга рассказывает о геноме. Каждый, кому интересно узнать о себе что-то новое, прочтет её с интересом и пользой для себя. Она написана достаточно просто, чтобы одолеть её до конца, хотя, конечно, неподготовленному читателю, который давно забыл школьный курс биологии, придется приложить некоторые усилия. Но они будут вознаграждены тем, что читатель узнает для себя массу нового, чего нет пока еще ни в одном учебнике, узнает многое из того, что некоторые биологи далеко еще сами не освоили.
Эта книга — слепок новой биологии, она объясняет (и достаточно понятно), почему наша жизнь все больше и больше будет зависеть от того, как мы сумеем распорядиться тем информационным богатством, которое нам подарил прошлый век. Сейчас главная проблема состоит в том, как превратить гигантский объем новых знаний о геноме в новое качество нашей жизни — здоровье, долголетие, победу над болезнями, использование всех научных способностей, заложенных в нас природой и родителями.
Не поленитесь дочитать книгу до конца. Дочитав последнюю страницу, вы почувствуете себя гордым за человечество, которое, наконец, начинает познавать самое себя. Мы на полпути к себе. Вы сможете сами участвовать в освоении второй половины пути — для многих читателей это может стать делом жизни.
Прочтя эту книгу, вы очень многое узнаете о себе и окружающих вас существах. Разве это не интересно?
Академик Л. Киселев
ОБЩЕЕ ВВЕДЕНИЕ
Мир не просто удивительнее, чем
мы себе представляем, —
он удивительнее,
чем мы можем себе представить.
Джон Бердон Холдейн
Человек — вершина эволюции живой природы на Земле. Такое утверждение общепризнанно, и оно обычно ни у кого не вызывает сомнения. Знаменитый молекулярный биолог, лауреат Нобелевской премии Дж. Уотсон писал: «Легко видеть в человеке существо совершенно особое, отличное от всех прочих живых существ. Лишь он изобрел сложные языки, дающие ему средство для обмена идеями и эмоциями. Он создал великие цивилизации, изменившие окружающий мир так, как не могло бы его изменить никакое другое животное. Поэтому человек всегда был склонен считать, что он занимает в природе не совсем обычное место». Но эта мысль принадлежат самому человеку, и поэтому в ней есть элемент субъективности. Безусловно, в том, что касается мыслительных функций, данное утверждение во многом правильно. Человек действительно царствует на Земле. Он уже давно в значительной мере встал над природой, перестал быть прямым объектом ее естественного отбора. Достижения человеческой цивилизации в целом огромны, они изменили облик всей нашей планеты, дошла даже очередь до других планет.
Однако царствование человека на Земле и в космосе не безгранично. До полного совершенства ему — царю природы — еще очень далеко. Существует множество неподвластных человеку проблем даже на планете Земля. Катаклизмы и стихии порой ставят человечество в тупик. Да и мы сами по ряду параметров сильно уступаем другим представителям животного мира, обитающим вокруг нас. Во многих отношениях мы чересчур слабы, ранимы. Это проявляется в нашей сильной уязвимости к воздействиям различных физических и химических факторов окружающей среды, в слабой устойчивости к действию различных патогенов, низкой плодовитости, относительно короткой продолжительности полноценной жизни. В отличие от других животных нашему зрению доступен лишь ничтожно малый участок электромагнитного спектра, а обоняние не способно воспринять и сотой доли окружающих нас запахов. Некоторые животные (рыбы, птицы) способны различать сигналы, которые человек вообще не воспринимает без специальных приборов. Гомер даже говорил: «Меж всевозможных существ, которые дышат и ходят, здесь, на нашей земле, человек наиболее жалок». Пожалуй, самую уничижительную оценку человеку дал один американец, который подсчитал, что в организме человека, весящего 70 кг, содержится 45,5 кг кислорода, 12,6 кг углерода, 7 кг водорода, 2,1 кг азота, 1,4 кг кальция, 700 г фосфора, а всех остальных элементов, вместе взятых (в основном калия, серы, натрия, хлора, магния, железа и цинка), — около 700 г. И всё это «богатство» стоит всего 1 доллар 98 центов. Но это уже крайность.
Куда серьезнее то, что человечество страдает от многочисленных наследственных патологий, болезней сердечно-сосудистой системы, злокачественных заболеваний, иммунодефицита и травматизма. Мы по-прежнему подвержены разнообразным вирусным инфекциям, идет широкое распространение СПИДа, гепатита и других грозных инфекционных заболеваний. Кроме того, человечество обременено и многочисленными пороками, которые сопровождают всю его историю. Наркомания, алкоголизм, эпилепсия и шизофрения — все это сопутствует пребыванию человека на Земле. В ходе всей истории человечество вело многочисленные войны, в которых были уничтожены сотни миллионов его представителей, и даже в XXI веке существует терроризм, растет преступность. Исчезают одни «сверх-человеки», появляются другие, даже в наше время, казалось бы, далекое от времени дикарей, отдельные страны объявляют себя «сверхдержавами» и начинают диктовать миру свои законы жизни и поведения. Нарушаются все возможные моральные и библейские принципы. Так что «царь природы» далеко не во всех отношениях выглядит совершенным, ему требуются значительная помощь и защита.
Но, несмотря на все «минусы», человеческая популяция продолжает неуклонно расти и процветать, в ней сохраняется и превалирует жизнеутверждающее и творческое начало. Достижения человека на планете Земля огромны. В чем же причина всего этого? В значительной мере это результат реализации той информации, которая заложена природой в нашем генетическом аппарате.
Известно, что мы все в той или иной мере эгоисты. Человека больше всего на свете интересует он сам. Все, что имеет к нему отношение, — предмет наивысшего внимания. Со временем пришло понимание того, что все упирается в биологию человека, а вся биология человека упирается в геном. Козьма Прутков говорил: зри в корень. В организме человека главный «корень» — это и есть геном. Стало ясно, что основной путь к исправлению многочисленных «слабостей» человека лежит через детальное изучение строения и работы его наследственной информации, содержащейся в геноме. Но долгое время это не удавалось сделать, поскольку ученые не располагали соответствующими подходами и методами. И как только к концу XX века появились реальные научные, методические и технические возможности определять структуры больших по размерам молекул, кодирующих наследственную информацию (геномов), сразу после расшифровки ДНК простых организмов (вирусы, бактерии, дрожжи, червь) одним из первых сложных организмов, чья ДНК была расшифрована, стал человек. Знаменательно, что даже структура генома такого классического генетического объекта, как дрозофила, который исследуется существенно дольше и который значительно проще устроен, была определена не раньше, а почти одновременно с геномом человека.
Успехи в изучении генома человека стали возможными в первую очередь благодаря усилиям международного проекта «Геном человека», который возник и реализовался в результате напряженной работы большого сообщества ученых. Инициатором этого движения с самого начала (конец 80-х годов) стал лауреат Нобелевской премии знаменитый ученый Дж. Уотсон. В России таким энтузиастом был академик А. А. Баев (1904–1994). В 1988 году он обратился к М. С. Горбачеву с письмом, в котором предложил организовать государственный научный проект по изучению генома человека. Как в нашей стране, так и за рубежом эта идея первоначально была встречена рядом ученых и общественных деятелей весьма критически. Им казалось, что задача просто невыполнима, а труд будет сизифов. Но время шло, и довольно скоро научное сообщество во всем мире стало обсуждать ее всерьез. Ученые смогли убедить свои правительства и бизнесменов, что определить полную структуру ДНК человека — важнейшая и насущнейшая задача для всего человечества. В результате этих усилий в 1989–1990 гг. в США и в СССР, а затем и в ряде других стран начали функционировать соответствующие научные программы. Чуть позднее возникла Международная организация по изучению генома человека (Human Genome Organization, сокращенно HUGO).
В самом начале задача казалась сверхсложной, а ее осуществление сверхдорогим. Но научная мысль, интеллект и энтузиазм множества исследователей из разных стран, помноженные на огромное финансирование, позволили в конечном итоге решить эту грандиозную задачу. На реализацию проекта были выделены огромные средства. Крупный вклад в решение этой проблемы (как финансовый, так и научный) был сделан в дальнейшем частной американской компанией «Celera Genomics». В сумме, по имеющимся оценкам, на определение полной структуры генома человека было затрачено свыше 6 млрд. долларов. Проект «Геном человека» стал одним из самых дорогостоящих из всех, когда-либо создаваемых на земле. Для сравнения: весь годовой бюджет Российской Федерации на 2000 год был равен 60 млрд. долларов. Грандиозная работа проводилась одновременно в двух десятках стран мира, включая США, Англию, Францию, Германию, Японию, Китай и Россию, и была осуществлена за срок чуть более 10 лет. Основных инициаторов и исполнителей проекта «Геном человека» (Джеймса Уотсона, Френсиса Коллинза, Крега Вентера) уже назвали «рыцарями двойной спирали».
Как сказал профессор Майкл Декстер (руководитель британской части проекта), определение полной структуры генома человека представляет собой одно из величайших достижений человечества, которое превосходит по своему значению высадку человека на Луне.
Правда, едва ли раскрытие тайн структуры генома человека станет панацеей для человечества. Ажиотаж вокруг проекта «Геном человека» создает несколько искаженную картину, будто бы знание молекулярной организации генома уже сейчас решает все проблемы человека. На этом фоне возникают даже рассуждения об узко прагматическом «геноцентризме», который формирует у общества лишь кратковременную иллюзию научного успеха. Но серьезные ученые понимают, что это всего лишь первый, начальный этап. Он уже получил и свое название — «структурный». Когда–то один из отцов молекулярной биологии, нобелевский лауреат Ф. Крик говорил: «Не знаешь функции — изучай структуру». Теперь неизбежно должен последовать второй, и, скорее всего, даже более важный этап — «функциональный» — изучение функции генов. Эрик Ландер, возглавлявший исследование генома человека в Массачусетском технологическом институте, сказал в 2000 году: «В июне люди, вероятно, полагали, что на этом исследование закончится. Но я не знаю, поняли ли люди, что мы обнаружили в геноме самую величайшую в мире книгу истории. Мы постоянно просыпаемся ночью для того, чтобы продолжить читать истории, которые заключены в геноме. Это так здорово!»
Однако и преуменьшать значение состоявшегося «структурного» этапа в изучении человеческого генома нельзя. В настоящее время биология в целом (как наука о жизни) встает на принципиально новые, геномные, рельсы. Реализация проекта «Геном человека», подобно любому другому крупному и хорошо организованному проекту, одновременно способствовала прогрессу молекулярной биологии и генетики в целом. Были в значительной мере усовершенствованы методическая и приборная база науки, мощный импульс получили такие, по сути дела, вновь созданные направления, как геномика (изучение целых геномов), протеомика (изучение совокупности белков) и ряд других. С самого начала работ по геномному проекту мир договорился об открытости, доступности всей получаемой информации для его участников, независимо от их вклада и государственной принадлежности. Сейчас существуют десятки мощных баз данных, доступных любому пользователю, в которых аккумулирована гигантская информация о структуре не только генома человека, но и геномов многих других организмов.
Только благодаря вновь полученной конкретной информации о генетическом аппарате человека становится возможным исправлять генетические дефекты, лечить различные заболевания, корректировать психику, бороться с вирусными инфекциями, разрабатывать совершенные лекарственные средства и выявлять мишени, на которые они направлены, создавать новые поколения диагностических и профилактических средств и в результате существенно продлить полноценную жизнь человека. По этой причине известный генетик Джереми Рифкин сказал: «Кому принадлежат гены, тому принадлежит 21-е столетие». А полный текст, записанный в геноме человека, иногда называют даже несколько возвышенно Энциклопедией жизни.
Итак, на рубеже третьего тысячелетия человечество наконец-то раскрыло одну из важнейших для него тайн — структуру генома Homo sapiens (человека разумного). Произошло то, что еще в 1957 году предсказывал российский академик Владимир Александрович Энгельгардт: «Не нужно быть беспочвенным оптимистом, чтобы верить, что через пятьдесят лет биологический код — химическая зашифровка наследственных свойств — будет расшифрован и прочитан. С этого момента человек станет полным властелином живой материи».
Знаменательно, что структура генома человека вчерне была определена к середине 2000 г., когда исполнилось 100 лет с официального начала генетики как науки (переоткрытие менделеевских фундаментальных законов наследственности произошло в 1900 г.). Полное завершение этой работы намечено к 2003 году, когда будет опубликован окончательный текст, записанный в геноме. Кстати, 2003 год юбилейный — 50 лет прошло с тех пор, как Дж. Уотсон и Ф. Крик открыли структуру ДНК, которая представляет собой двойную спираль.
Нельзя преувеличивать успехи российских ученых в завершившемся международном геномном проекте, но не стоит и преуменьшать их. В первую очередь следует вспомнить выдающегося ученого академика А. А. Баева, который стоял у истоков этого проекта в СССР. Заметный вклад в изучение генома человека был сделан российскими учеными в различных областях исследования, особенно в таких, как функциональная геномика, этногеномика и биоинформатика. В настоящее время около 70 ученых России являются членами всемирной организации HUGO, избрание в которую осуществляется тайным международным голосованием на основании оценки публикаций кандидатов. Все эти годы российская программа «Геном человека» в меру сил финансировалась Минпромнауки РФ и поддерживалась Президиумом РАН. Конечно, жаль, что этих средств было явно маловато на фоне общего финансирования геномной программы в мире, но, как это часто бывало в прошлом, мозги российских ученых в известной мере компенсировали недостаток материальных средств.
* * *
Успешное и широко разрекламированное определение полной структуры генома человека послужило основным поводом для написания этой книги. Набожный руководитель международной программы «Геном человека» Ф. Коллинз даже назвал текст, записанный в геноме человека, «языком Бога». Однако значение произошедшего события до сих пор не в полной мере понято широкой общественностью. Академик А. А. Баев еще в середине 90-х годов прошлого столетия отмечал с сожалением, что развитие современной биологии сделало ее малодоступной для неспециалистов. В этой связи, несмотря на гигантские научные успехи, мистика и суеверия не только продолжают существовать в современном обществе, но даже прогрессируют. Хотелось бы надеяться, что эта книга хотя бы в небольшой мере поможет закрыть имеющийся пробел в понимании сути и значения последних достижений ученых. Она предназначена не для узких специалистов, которые и так понимают всю суть проблемы, а для самой широкой аудитории. Но тема, которой посвящена книга, весьма специальная. Поэтому в самом начале нельзя было не остановиться хотя бы кратко на истории вопроса, необходимо также дать объяснение хотя бы части той специальной терминологии, которая используется на своей «кухне» генетиками. Жан-Жак Руссо писал: «Мудрецы, которые хотят говорить с простым народом своим, а не его языком, никогда не смогут стать ему понятными. Однако есть множество разного рода понятий, которые невозможно перевести на язык народа». Попробуем и мы для начала сделать такой перевод, отчетливо понимая при этом, что, согласно известному закону Мейера, «усложнять — просто, упрощать — сложно».
ЧАСТЬ I. СТРУКТУРА ГЕНОМА ЧЕЛОВЕКА
ЧТО ТАКОЕ ГЕНОМ?
Вопросы вечны, ответы обусловлены временем.
Е. Чаргафф
В диалоге с жизнью важен не ее вопрос, а наш ответ.
М. И. Цветаева
С самого начала определимся, что мы здесь будем подразумевать под словом геном. Сам этот термин впервые был предложен в 1920 году немецким генетиком Г. Винклером. Тогда уже существовал другой научный термин — генотип, введенный в арсенал генетиков В. Иогансеном еще в 1909 году, под которым подразумевалась совокупность всех наследственных задатков данной конкретной клетки или данного конкретного организма. Впоследствии Иогансен сам с удивлением говорил, что его «словечко» неожиданно материализовалось в возникшей позднее хромосомной теории Т. Моргана. Но вот появился новый термин — геном. В отличие от генотипа этот термин должен был стать характеристикой целого вида организмов, а не конкретной особи. И это стало новым этапом в развитии генетики.
В биологическом словаре понятие геном определяется как совокупность генов, характерных для гаплоидного (одинарного) набора хромосом данного вида организмов. Такая формулировка звучит не совсем понятно для неспециалиста, а главное, она неточна в современном понимании этого слова. Основу генома составляет молекула дезоксирибонуклеиновой кислоты, хорошо известная в сокращенном виде как ДНК. Ведь все геномы (ДНК) содержат по крайней мере два вида информации: кодированная информация о структуре молекул-посредников (так называемых РНК) и белка (эта информация содержится в генах), а также инструкции, которые определяют время и место проявления этой информации при развитии и дальнейшей жизнедеятельности организма (эта информация в основном расположена в межгенных участках, хотя частично и в самих генах). Сами гены занимают очень небольшую часть генома, но при этом составляют его основу. Информация, записанная в генах, — это своего рода «инструкция» для изготовления белков, главных строительных кирпичиков нашего тела. «На плечах» генов лежит огромная ответственность за то, как будет выглядеть и работать каждая клетка и организм в целом. Они управляют нашей жизнью от момента зачатия до самого последнего вздоха, без них не функционирует ни один орган, не течет кровь, не бьется сердце, не работают печень и мозг.
Однако для полной характеристики генома недостаточно заложенной в нем информации о структуре белков. Нужны еще данные об элементах генетического аппарата, которые принимают участие в работе (экспрессии) генов, регулируют их проявление на разных этапах развития и в разных жизненных ситуациях.
Но даже и этого мало для полного определения генома. Ведь в геноме присутствуют также элементы, способствующие его самовоспроизведению (репликации), компактной упаковке ДНК в ядре и еще какие-то непонятные пока еще участки, иногда называемые «эгоистичными» (то есть как бы служащими только для самих себя). По всем этим причинам сегодня, когда речь идет о геноме, обычно имеют в виду всю совокупность последовательностей ДНК, представленных в хромосомах ядер клеток определенного вида организмов, включая, конечно, и гены. В этой книге мы будем подразумевать именно такое определение. Вместе с тем следует помнить, что в некоторых других структурах (органеллах) клетки также присутствует генетическая информация, необходимая для функционирования организмов. В частности, у всех животных организмов, в том числе и у человека, имеется еще и митохондриальный геном, то есть молекулы ДНК, присутствующие в таких внутриклеточных структурах, как митохондрии, и содержащие ряд так называемых митохондриальных генов. Митохондриальный геном человека очень небольшой по сравнению с ядерным геномом, расположенным в хромосомах, но, тем не менее, его вклад в клеточный метаболизм весьма существенен.
Понятно, что знание одной лишь структуры ДНК вовсе не достаточно для полного описания наследственной системы клетки. Этому выводу в литературе дана следующая аналогия: сведения о числе и форме кирпичей не могут раскрыть замысла готического собора и хода его постройки. В более широком смысле наследственную систему клетки составляют не только структура ДНК, но и другие ее компоненты, совокупность которых и факторы окружающей среды определяют, как геном будет работать, как пойдет ход индивидуального развития и как возникший организм будет жить потом.
НЕМНОГО ИСТОРИИ, НЕМНОГО ТЕРМИНОЛОГИИ
По-видимому, на свете нет ничего,
что не могло бы случиться.
М. Твен
Некоторым читателям может показаться скучным и малоинтересным содержание этого раздела книги. Но хотелось бы таким читателям напомнить, что даже в захватывающем детективе бывают вроде бы малоинтересные страницы, которые, однако, при дальнейшем изложении часто оказываются важны для понимания происходящего.
Сначала несколько слов о генетике. Без сомнения, наивысшим достижением в биологии ушедшего двадцатого века было появление и развитие этой науки, а также раскрытие с ее помощью молекулярной природы наследственности. И теперь уже мало верится, что было время, когда в нашей стране генетику называли «продажной девкой империализма», а ученых-генетиков — презренным тогда словосочетанием «вейсманисты-морганисты» (производное от имен немца Августа Вейсмана (1834–1914) и нобелевского лауреата американца Томаса Ханта Моргана (1866–1945), которые сформулировали представления о дискретности генов, их локализации в хромосомах, обосновали хромосомную теорию наследственности). Сейчас во всем мире генетика не только получила «путевку в жизнь», но пребывает на законных основаниях в славе и почете.
В отличие от многих других биологических наук генетика с момента своего возникновения стремилась быть точной наукой. И вся история генетики — это история создания и использования в эксперименте все более и более точных методов и подходов, что сближает ее с такими точными науками, как физика, химия и математика.
А начало всему было положено чешским монахом Грегором Менделем, который в 1865 году опубликовал свой фундаментальный труд с математическими расчетами, указывающими на существование неких абстрактных дискретных частиц, передающих наследственные свойства («частицы наследственности»), названных позднее генами. Эта феноменальная работа Менделя, осуществленная на горохе, не произвела особого эффекта на его современников и была забыта вплоть до 1900 года (научная мысль в то время еще не созрела для ее восприятия). Сам Мендель после неудачных попыток получить аналогичные результаты при скрещивании других растений прекратил опыты и до конца жизни занимался садоводством, пчеловодством и метеорологическими наблюдениями.
Лишь спустя 35 лет произошло то, что и должно было случиться: законы Менделя были переоткрыты независимо и одновременно тремя разными исследователями (Г. де Фризом, Э. Чермаком и К. Корренсом), после чего и начала интенсивно развиваться наука, получившая позднее название генетика. С тех пор эта наука и рожденные на ее основе молекулярная генетика и геномика занимают лидирующее положение среди прочих наук о природе, став в итоге одними из основных, определяющих сегодняшний и завтрашний день развития человечества.
Вскоре после открытия основных законов генетики было установлено, что маленькие продолговатые тельца, наблюдаемые под микроскопом в ядрах клеток, которые были названы хромосомами, ведут себя именно так, как это ожидалось от «единиц наследственности» Менделя. Но уже тогда было ясно, что число генов должно быть больше, чем число хромосом. В 1910 году Томас Хант Морган начал изучать относительно простой и удобный для анализа генетический аппарат плодовой мушки дрозофилы, что привело в конечном итоге к созданию хромосомной теории наследственности. Согласно этой теории, существуют многочисленные гены, которые линейно расположены в хромосомах, и их последовательность в будущем может быть расшифрована.
Известно, что гены управляют развитием любого живого организма с момента его рождения и до смерти. Гены достаются нам от родителей, и от них в значительной мере зависят наши физические параметры, внешность, склонность к различным заболеваниям или, наоборот, своего рода иммунитет к ним. При этом следует обратить внимание на то, что такие черты, как характер, убеждения, привычки, поведение и даже способности также определяются в значительной мере генетически, хотя здесь существенную роль могут играть и социальные факторы, такие, как условия жизни, воспитание, образование, окружение.
Лишь в 40-е годы прошлого века была установлена материальная основа генов. Выяснилось, что ею служит одна из так называемых нуклеиновых кислот, а именно дезоксирибонуклеиновая кислота (сокращенно, ДНК). Само существование нуклеиновых кислот было обнаружено швейцарским биохимиком Ф. Мишером еще в 1868 году, то есть всего через три года после открытия Менделем своих законов (случайность или закономерность?). Тогда из спермы лосося Мишер выделил фосфорсодержащее вещество, происходящее из клеточных ядер, которое он назвал нуклеином (от слова нуклеус — ядро), а мы теперь его называем дезоксирибонуклеиновой кислотой. Примечательно, что два таких важных открытия, как обнаружение единицы наследственности и ее физического носителя, были сделаны почти одновременно. Однако, как и в случае с законами Г. Менделя, практически никто из исследователей в то время не смог оценить важность открытия Мишера.
В дальнейшем существенный вклад в изучение нуклеиновых кислот внесли немецкий химик Альбрехт Кёссель и американский биохимик русского происхождения А. Ф. Левин. Первый установил, что в состав нуклеина входят четыре азотсодержащих вещества (их назвали азотистыми основаниями): аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т) (за это в 1910 г. Кёссель получил Нобелевскую премию по физиологии и медицине). Затем А. Ф. Левин показал, что в состав нуклеина, кроме тетрады А, Г, Ц и Т, входит вдобавок к фосфорной кислоте еще и сахар дезоксирибоза, то есть «рибоза без кислорода». Так и возникло название дезоксирибонуклеиновая кислота (ДНК). Позднее в составе другой нуклеиновой кислоты — рибонуклеиновой кислоты (РНК) — была обнаружена рибоза вместо дезоксирибозы.
А. Ф. Левин предложил одну из первых гипотез о структуре нуклеиновых кислот. Согласно этой гипотезе, нуклеиновые кислоты построены как линейная комбинация связанных друг с друга химической связью нуклеотидов. По мнению Левина, четыре разных нуклеотида, входящие в состав нуклеиновых кислот, связаны последовательно в стандартный тетрануклеотид, который многократно повторяется в структуре нуклеиновой кислоты. И многие исследователи приняли эту гипотезу на веру. Однако столь однообразная и монотонная последовательность не годилась на роль материальной структуры генов. По этой причине долгое время бытовало мнение, что ДНК выполняет какую-то чисто структурную функцию в хромосомах.
Серия открытий, которые привели к современному пониманию генетической важности ДНК и ее основополагающей роли в организации хромосом, началась в середине 20-х годов прошлого века, когда Л. Зильберт на протеях и Ф. Гриффит на пневмококках описали опыты по серологической трансформации. В 1944 году американский биолог Освальд Теодор Эвери с соавторами в опытах с пневмококками показали, что с помощью чистого препарата ДНК могут быть специфически изменены их наследственные свойства. Однако даже эти безупречные результаты не убедили ученых полностью в том, что ДНК — это вещество наследственности. Они заставили ученых только усомниться в том, что ДНК играет чисто структурную роль в хромосомах. Продолжала господствовать теория белковой природы гена.
И такая ситуация сохранялась вплоть до апреля 1953 года.
ДНК — МОЛЕКУЛЯРНАЯ ОСНОВА ГЕНОМА
Сколько истин, признаваемых нами
в настоящее время бесспорными,
в момент провозглашения их казались
лишь парадоксами или даже ересями!
Екатерина II
Что мыслимо — то возможно,
что возможно — то мыслимо.
Г. Лейбниц
Тонкое устройство ДНК
Чтобы дальнейшее повествование было более ясным для читателя, рассмотрим сначала подробнее, как же устроена эта странная и загадочная молекула ДНК.
Итак, ДНК состоит из 4-х азотистых оснований, а также сахара (дезоксирибозы) и фосфорной кислоты. Два азотистых основания (сокращенно называемых Ц и Т) относятся к классу так называемых пиримидиновых основания, а два других (А и Г) — к пуриновым основаниям. Такое разделение связано с особенностями их структур, которые показаны на рис. 1.

Рис. 1. Структура азотистых оснований (элементарных «букв»), из которых построена молекула ДНК
Отдельные основания связаны в цепочке ДНК сахаро-фосфатными связями. Эти связи изображены на следующем рисунке (рис. 2).

Рис. 2. Химическая структура цепи ДНК
Все это известно уже довольно давно. Но детальное устройство молекулы ДНК стало понятно лишь спустя почти 90 лет после знаменитых работ Менделя и открытия Мишера. 25 апреля 1953 г. в английском журнале «Nature» было опубликовано небольшое письмо молодых и тогда еще мало известных ученых Джеймса Уотсона и Френсиса Крика редактору журнала. Оно начиналось словами: «Мы хотели бы предложить свои соображения по поводу структуры соли ДНК. Эта структура имеет новые свойства, которые представляют большой биологический интерес». Статья содержала всего около 900 слов, но — и это не преувеличение — каждое из них оказалось на вес золота.
А началось все так. В 1951 году на симпозиуме в Неаполе американец Джеймс Уотсон встретился с англичанином Морисом Уилкинсом. Конечно же, они тогда не могли себе даже представить, что в результате этой встречи они станут нобелевскими лауреатами. В то время Уилкинс со своей коллегой Розалиндой Франклин проводили в Кембриджском университете рентгеноструктурный анализ ДНК и определили, что молекула ДНК представляет собой, скорее всего, спираль. После разговора с Уилкинсом Уотсон «загорелся» и решил заняться исследованием структуры нуклеиновых кислот. Он перебрался в Кембридж, где познакомился с Френсисом Криком. Ученые решили совместными усилиями попытаться понять, как устроена ДНК. Работа началась не на пустом месте. Исследователи уже знали о существовании двух типов нуклеиновых кислот (ДНК и РНК), знали и то, из чего они состоят. В их распоряжении были фотографии рентгеноструктурного анализа, полученные Р. Франклин. Кроме того, Эрвин Чаргафф сформулировал к тому времени очень важное правило, согласно которому в ДНК число А всегда равно числу Т, а число Г равно числу Ц. А далее сработала «игра ума». Результатом этой «игры» и стала статья в журнале «Nature», в которой Дж. Уотсон и Ф. Крик описали созданную ими теоретически модель строения молекулы ДНК. (Уотсону к этому времени еще не исполнилось и 25 лет, а Крику было 37). Согласно их «научной фантазии», основанной тем не менее на определенных твердо установленных фактах, молекула ДНК должна состоять из двух гигантских полимерных цепочек. Звенья каждого полимера состоят из нуклеотидов: углевода дезоксирибозы, остатка фосфорной кислоты и одного из 4 азотистых оснований (А, Г, Т или Ц). Последовательность звеньев в цепочке может быть любой, но эта последовательность строго связана с последовательностью звеньев в другой (парной) полимерной цепочке: напротив А должно быть Т, напротив Т должно быть А, напротив Ц должно быть Г, а напротив Г должно быть Ц (правило комплементарности) (рис. 3).

Рис. 3. Схема взаимодействия двух комплементарных цепей в молекуле ДНК
Две полимерные цепи закручены в правильную двойную спираль. Они удерживаются вместе посредством водородных связей между парами оснований (А–Т и Г–Ц) подобно ступенькам лестницы. По этой причине говорят, что две цепи ДНК комплементарны. Для природы это не удивительно. Известно множество примеров комплементарности. Комплементарны, например, древнекитайские символы «инь» и «янь», гнезда розетки и штырьки вилки.
Двойная спираль ДНК схематически изображена на рис. 4. Внешне она напоминает веревочную лестницу, завитую в правую спираль. Ступенями в этой лестнице являются пары нуклеотидов, а связывающие их «боковинки» состоят из сахаро-фосфатного остова.

Рис. 4. Знаменитая двойная спираль ДНК а — Рентгенограмма ДНК, полученная Р. Франклин, которая помогла Уотсону и Крику найти ключ к двухспиральной структуре ДНК; б — Схематическое изображение двухспиральной молекулы ДНК
Так была открыта знаменитая «двойная спираль». Если последовательность звеньев (нуклеотидов) в ДНК рассматривать как ее первичную структуру, то двойная спираль — это уже вторичная структура ДНК. Предложенная Уотсоном и Криком модель «двойной спирали» изящно решала не только проблему кодирования информации, но и удвоения (репликации) гена.
В 1962 году Дж. Уотсон, Ф. Крик и Морис Уилкинс получили по достоинству за это достижение Нобелевскую премию. А ДНК была названа самой главной молекулой живой природы. Во всем этом, конечно же, сыграли свою роль точные сведения о строении ДНК, но не в меньшей мере и «провидческие» построения сложной пространственной структуры, что потребовало от исследователей не только логики, но и творческого воображения — качества, присущего художникам, писателям и поэтам. «Здесь, в Кембридже, произошло, быть может, самое выдающееся после книги Дарвина событие в биологии — Уотсон и Крик раскрыли структуру гена!» — писал в то время в Копенгаген Нильсу Бору его бывший ученик М. Дельбрюк. Известный испанский художник Сальвадор Дали после открытия двойной спирали сказал, что это для него явилось доказательством существования Бога, и изобразил ДНК на одной из своих картин.
Итак, интенсивный мозговой штурм, предпринятый учеными, завершился полным успехом! В историческом масштабе открытие структуры ДНК сопоставимо с открытием структуры атома. Если выяснение строения атома привело к появлению квантовой физики, то открытие структуры ДНК дало начало молекулярной биологии.
Каковыми же оказались главные физические параметры ДНК человека — этой главной его молекулы? Диаметр двойной спирали равен 2 нанометрам (1 нм = 10–9 м); расстояние между соседними парами оснований («ступеньками») составляет 0,34 нм; один поворот спирали состоит из 10 пар оснований. Последовательность пар нуклеотидов в ДНК нерегулярна, но сами пары уложены в молекуле как в кристалле. Это дало основание характеризовать молекулу ДНК как линейный апериодический кристалл. Число отдельных молекул ДНК в клетке равно числу хромосом. Длина такой молекулы в наибольшей по размеру хромосоме 1 человека составляет около 8 см. Подобных гигантских полимеров пока не выявлено ни в природе, ни среди искусственно синтезированных химических соединений. У человека длина всех молекул ДНК, содержащихся во всех хромосомах одной клетке, составляет примерно 2 метра. Следовательно, длина молекул ДНК в миллиард раз больше их толщины. Так как организм взрослого человека состоит примерно из 5х1013 – 1014 клеток, то общая длина всех молекул ДНК в организме равна 1011 км (это почти в тысячу раз больше расстояния от Земли до Солнца). Вот такая она, суммарная ДНК всего лишь одного человека!
Когда говорят о размере генома, то подразумевают общее содержание ДНК в единичном наборе хромосом ядра. Такой набор хромосом называют гаплоидным. Дело в том, что большинство клеток нашего организма содержит двойной (диплоидный) набор совершенно одинаковых хромосом (только у мужчин 2 половые хромосомы отличаются). Измерения размера генома приводятся в дальтонах, парах нуклеотидов (п. н.) или пикограммах (пг). Соотношение между этими единицами измерения следующие: 1 пг = 10–9 мг = 0,6х1012 дальтон = 0,9х109 п. н. (далее мы будем использовать в основном п. н.). В гаплоидном геноме человека содержится около 3,2 млрд. п. н., что равно 3,5 пг ДНК. Таким образом, в ядре одной клетки человека содержится около 7 пг ДНК. Если учесть, что средний вес клетки человека равен примерно 1000 пг, то легко рассчитать, что ДНК составляет менее 1% от веса клетки. И тем не менее, чтобы воспроизвести самым мелким шрифтом (как в телефонных справочниках) ту огромную информацию, которая содержится в молекулах ДНК одной нашей клетки, понадобилось бы тысяча книг по 1000 страниц в каждой! Вот таков полный размер генома человека — Энциклопедии, написанной четырьмя буквами.
Но не следует думать, что геном человека наибольший из всех существующих в природе. Например, у саламандры и лилии длина молекул ДНК, содержащихся в одной клетке, в тридцать раз больше, чем у человека.
Поскольку молекулы ДНК имеют гигантский размер, их можно выделить и увидеть даже в домашних условиях. Вот как описывается эта простая процедура в рекомендации для кружка «Юный генетик». Во-первых, надо взять любые ткани животных или растительных организмов (например, яблоко или кусок курицы). Затем надо нарезать ткань на кусочки и положить 100 г в обычный миксер. После добавления 1/8 чайной ложки соли и 200 мл холодной воды вся смесь взбивается на миксере в течение 15 секунд. Далее взбитая смесь процеживается через ситечко. В полученную мякоть надо добавить 1/6 от ее количества (это будет примерно 2 столовые ложки) моющего средства (для посуды, например) и хорошо размешать. Через 5–10 минут жидкость разливается по пробиркам или любым другим стеклянным емкостям, чтобы в каждой из них было заполнено не больше трети объема. Затем к ней добавляется по чуть-чуть либо сок, выжатый из ананаса, либо раствор, используемый для хранения контактных линз. Все содержимое встряхивается. Делать это надо весьма осторожно, так как если трясти слишком сильно, то гигантские молекулы ДНК поломаются и после этого ничего нельзя будет увидеть глазами. Далее в пробирку медленно вливается равный объем этилового спирта, чтобы он образовал слой поверх смеси. Если после этого покрутить в пробирке стеклянной палочкой, на нее «намотается» вязкая и почти бесцветная масса, которая и представляет собой препарат ДНК.
Генетическая грамматика
После установления химического строения и пространственной структуры ДНК оставалось еще множество вопросов, основной из которых заключался в том, как же ДНК кодирует белки, то есть, что представляет из себя генетический код этой молекулы, какую «грамматику» она использует? На это в первую очередь и были направлены дальнейшие усилия исследователей.
Итак, установлено, что «буквами» в ДНКовом тексте служат нуклеотиды — элементарные звенья полимерной молекулы ДНК. В ДНК всего 4 нуклеотида (А, Т, Г, Ц). Следовательно, если сравнить каждый из этих нуклеотидов с отдельной буквой, то алфавит ДНКового текста содержит всего 4 «буквы». Как же из этих «букв» формируются «слова» и «предложения»?
Белковые молекулы всех существующих на земле организмов построены всего из 20 аминокислот. Сразу после создания модели ДНК стало ясно, что существует некий код, переводящий четырехбуквенный ДНКовый текст в двадцатибуквенный аминокислотный текст. Элементарные расчеты говорили о том, что число возможных сочетаний, в которых четыре нуклеотида могут быть по-разному расположены в «тексте», достигает астрономических значений. Так, молекула ДНК, состоящая, к примеру, всего из 100 пар нуклеотидов, может теоретически кодировать 4100 различных белковых «текстов». Какова же ситуация на самом деле?
Одним из первых в этом пытался разобраться русский физик Г. Гамов, эмигрировавший в то время в Америку. Наслушавшись многочисленных разговоров о ДНК и узнав, что она содержит — как и карты — всего четыре «масти», Гамов решил «разложить пасьянс» с целью понять устройство генетического кода. Ему сразу стало ясно, что код не может быть «двоичным», то есть одну аминокислоту в белке должна кодировать не двойка нуклеотидов — «букв», а как минимум тройка. Дело в том, что сочетание из 4 по 2 дает всего 16 комбинаций, а этого недостаточно для кодирования всех 20 аминокислот. Следовательно, рассуждал Гамов, код должен быть по крайней мере трехбуквенным, то есть каждую аминокислоту должна кодировать тройка «букв» в любых сочетаниях. На этом он и остановился, поскольку далее возникало множество вопросов. В частности, такой: число сочетаний из 4 по 3 равно 64, а аминокислот всего 20. Зачем же такая избыточность в трехбуквенном коде?
В то время уже существовал хорошо известный путь, который, в частности, был проделан в свое время французом Жаном Шампольоном при дешифровке иероглифов древнего Египта. В качестве основного подспорья для решения стоящей перед ним задачи он использовал базальтовую плиту, которую обнаружили во время военной компании Наполеона в Египет и которая получила название Розеттский камень. На плите одновременно присутствовали две надписи: одна была иероглифическая, а другая — сделанная греческими буквами на греческом языке. К счастью, и язык, и письмо древних греков были в то время уже хорошо известны ученым. В результате сравнение двух текстов Розеттского камня привело к расшифровке египетской иероглифики. Этим путем и двинулись ученые при расшифровке генетического кода. Надо было сравнить два текста: текст, записанный в ДНК, с текстом, записанным в белке. Однако первоначально ученые не умели «читать» ДНК, а одного известного в то время белкового текста было недостаточно. Пришлось искусственно синтезировать разнообразные короткие фрагменты РНК и синтезировать на них в искусственных системах фрагменты белка. Весной 1961 года в Москве на Международном биохимическом конгрессе М. Ниренберг сообщил, что ему удалось «прочесть» первое «слово» в ДНКовом тексте. Это была тройка букв — ААА (в РНК, соответственно, УУУ), то есть три аденина, стоящие друг за другом, — которая кодирует аминокислоту фенилаланин в белке. Так было положено начало расшифровке генетического кода.
Такой путь в конечном итоге вскоре привел к полной расшифровке генетического кода. Подтвердилось предположение Гамова, что код триплетный: одной аминокислоте в белках соответствует последовательность из 3 нуклеотидов в ДНК и РНК. Такие кодирующие тройки нуклеотидов — «слова» — получили название кодонов.
Напомним, что еще Гамов столкнулся с парадоксом: из четырех нуклеотидов может быть построено 64 разных кодонов, а для построения белков используется только 20 различных аминокислот. Решение этого парадокса оказалось в следующем. Большинство аминокислот может кодироваться несколькими кодонами. После выяснения этого обстоятельства генетический код назвали вырожденным.
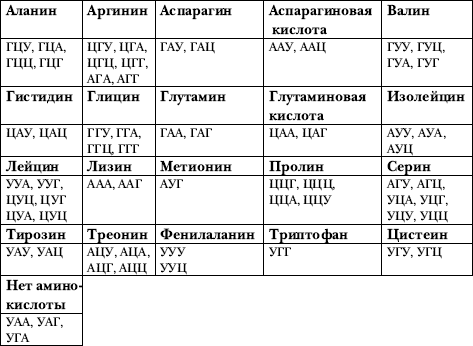
В таблице 1 приведены кодоны, но не в самой ДНК, а в РНК-посреднике (матричной РНК, или мРНК), образующейся на ДНК, и соответствующие им аминокислоты в белках.
Кроме того, как видно из таблицы, реально для кодирования используются не все возможные кодоны. Три из этих «лишних» кодонов выполняют функцию стоп-сигналов, обеспечивая прекращение синтеза белковой цепи.
Если внимательно посмотреть на таблицу 1, то видно, что вырожденность генетического кода носит не совсем случайный характер. Хотя код триплетный, основную нагрузку несут первые два нуклеотида в каждом кодоне. Чаще всего в разных кодонах, кодирующих одну и ту же аминокислоту, отличается лишь третий нуклеотид.
Таблица 1. Генетический словарь. Указаны аминокислоты, встречающиеся в белках, и соответствующие им кодоны в комплементарной ДНК матричной РНК
Генетический код первоначально был расшифрован у таких простых организмов, как фаги и бактерии. В дальнейшем оказалось, что он универсален (за очень редким исключением) для геномов всех существующих ныне живых организмах (от бактерий до человека). Небольшие отличия, о которых мы поговорим далее, были выявлены при сравнении ядерного и митохондриального геномов.
Итак, как в привычном нам тексте книги, вся информация записана в ДНК последовательностью расположения четырех составляющих ее «букв» — нуклеотидов. Таким образом, ДНКовый текст написан с помощью А, Т, Ц, Г-алфавита. При этом только текст одной из двух цепей ДНК обычно кодирующий, а другая цепь, как правило, некодирующая. Хотя известно, что в каждом правиле есть исключения. Если читатель попробует написать этими четырьмя буквами какие-нибудь русские слова, то у него ничего не получится. «Словом» в ДНКовом тексте, условно говоря, служит определенное сочетание трех нуклеотидов, которому соответствует конкретная аминокислота в белке, являющемся также полимером. Таким образом, в клетке четырьмя буквами записано два десятка «слов» (аминокислот — составных частей белков). И, наконец, как «предложение» в ДНКовом тексте можно рассматривать полный набор триплетов, кодирующих определенный белок, то есть ген. Таким образом, генетический алфавит состоит всего из 4 букв, а генетический словарь из 20 слов. В этой связи вспомним, что даже словарь Эллочки-людоедки из романа И. Ильфа и Е. Петрова «Двенадцать стульев» состоял из 30 слов, а «Словарь языка произведений А. С. Пушкина» насчитывает примерно 20 тыс. слов.
Существует строгая закономерность: чем длиннее код (чем больше в нем знаков), тем короче тексты. Огромный по размерам код представляют собой, например, китайские иероглифы. В результате этого иероглифические тексты существенно более кратки по сравнению с другими системами письма, в том числе и нашей. Однако для создания генетического кода природа выбрала всего 4 «буквы». Такой код предполагает наличие длинных текстов, что и реализовалось природой в виде создания гигантских молекул ДНК. При написании полного «текста» генома человека потребовалось около 3,2 млрд. «букв». Для сравнения: в священной книге Бытия, написанной на древнееврейском языке, содержится всего 78100 букв.
Размножение ДНК (репликация)
Важно то, что структура ДНК, открытая Уотсоном и Криком, многое прояснила относительно разных механизмов функционирования этой молекулы в клетке. ДНК не только кодирует генетическую информацию, но и самовоспроизводится (удваивается) при каждом клеточном делении. И вскоре уже было экспериментально установлено, что одновременно с делением клетки ДНК снимает с самой себя точные копии в процессе удвоения, или репликации. Во время клеточного деления слабые связи между двумя цепями двойной спирали ДНК разрушаются, в результате чего нити разделяются. Затем на каждой из них строится вторая «дочерняя» (комплементарная) цепь ДНК. В результате этого молекула ДНК удваивается, как и клетка, и в обеих клетках оказывается по одной полной копии ДНК. Копии должны быть полностью идентичными, чтобы сохранить всю генетическую информацию.
Процесс репликации играет ключевую роль в сохранении одной и той же генетической информации в разных клетках, образующихся при их делении. В общем виде художественно он изображен на рис. 5. Однако реальные механизмы репликации довольно сложны, и до настоящего времени еще не все тонкие детали этого процесса известны, особенно применительно к геномам высших животных организмов, включая человека.
Рис. 5. Схема репликации ДНК
В общем виде этот процесс выглядит следующим образом. В каждой хромосоме ДНК удваивается не с начала до конца, а отдельными кусками (репликонами). Средний размер репликона составляет около 30 мкм. Тем самым в составе генома человека должно встречаться более 50 000 репликонов, участков ДНК, которые синтезируются в ядре как независимые единицы. И это имеет свой глубокий смысл. Если бы каждая из молекул ДНК удваивалась как один репликон от начала до конца молекулы, то при скорости синтеза 0,5 мкм в минуту (а она именно такова у человека) удвоение первой хромосомы, имеющей длину ДНК около 7 см, занимало бы 140 000 минут, или около трех месяцев. На самом деле благодаря полирепликонному строению молекул ДНК весь процесс занимает всего 7–12 часов. Отдельные относительно короткие репликоны соединяются друг с другом, обеспечивая этим процесс воспроизведения целой молекулы ДНК.
Перезапись генетического текста и перевод в белковый текст (транскрипция и трансляция)
В клетке ДНК служит в качестве матрицы, на которой первоначально происходит синтез разных РНК. Процесс перезаписи генетической информации из ДНК в РНКовый текст получил название транскрипция. Этот процесс, как и репликация ДНК, осуществляется в ядрах клеток. Первоначально на генах, кодирующих белки, образуются РНК-предшественники, которые после ряда модификаций превращаются в так называемые матричные РНК (мРНК). Они-то непосредственно и служат матрицей для синтеза белков, то есть их кодируют. Установлено, что мРНК служат не только носителями ДНКовой информации, но и переносчиками этой информации из ядра в цитоплазму клетки. Только там мРНК может играть роль матрицы для синтеза белковых молекул (этот процесс назван трансляцией). В цитоплазме на специфических «машинах» — рибосомах — осуществляется при трансляции мРНК синтез молекулы белка, т. е. происходит перевод информации с четырехбуквенного языка мРНК на двадцатибуквенный язык белка. Схематически этот процесс изображен на рис. 6.
В середине 60-х годов был сформулирован основной постулат (центральная догма) новой науки — молекулярной биологии, который первоначально выглядел следующим образом:
ДНК > РНК > белок.
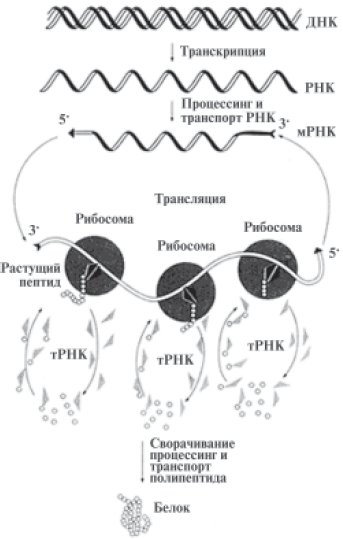
Рис. 6. Процесс трансляции мРНК на рибосомах с образованием белка
Рибосома играет роль «машины», читающей генетическую информацию, записанную в мРНК. Это молекулярная машина, построенная по единой схеме у всех организмов (включая человека) с небольшими вариациями. Она состоит из двух рибонуклеопротеидных (состоящих из РНК и белков) субчастиц: малой и большой. На рибосоме происходит взаимодействие мРНК с транспортными РНК (тРНК), несущими по одной аминокислоте каждая. Белок синтезируется путем образования связей между последовательно доставляемыми тРНК аминокислотами. Этим процессом «руководит» сама рибосома.
Позднее этот постулат был уточнен, и теперь он выглядит как
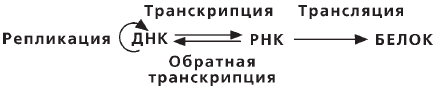
Сделанное дополнение вызвано обнаружением в 1970 году такого явления, как обратная транскрипция. Выяснилось, что у некоторых вирусов, генетический аппарат которых представлен РНК, а не ДНК, как у других живых организмов, имеется специальный фермент, который позволяет осуществлять такой обратный процесс, как синтез ДНК на РНК. Этот фермент получил название обратная транскриптаза, или ревертаза.
Казалось бы, теперь уже все стало ясно и однозначно и более ничего не может измениться. Но, как писал Марк Твен: «Из жизненного опыта следует извлекать только полезное и ничего больше, — иначе мы уподобимся кошке, присевшей на горячую печку. Она никогда больше не сядет на горячую печку — и хорошо сделает, но она никогда больше не сядет и на холодную». Ряд открытий последних лет продолжает вносить уточнения в казавшуюся незыблемой центральную догму молекулярной биологии.
Во-первых, выяснилось, что центральная догма молекулярной биологии постулирует лишь путь передачи генетической информации от нуклеиновых кислот к белкам и, следовательно, к конкретным свойствам и признакам живого организма. Однако исследование механизмов реализации этого пути на протяжении нескольких десятилетий, последовавших за формулировкой центральной догмы, вскрыло гораздо более разнообразные функции РНК, помимо известных ранее.
Во-вторых, согласно первоначальной догме, все носители инфекционных болезней должны иметь генетический материал — ДНК или РНК. Оказалось, что и здесь есть исключения. В 1997 году Нобелевская премия была вручена Стэнли Прузинеру за открытие белковых инфекционных частиц, вызывающих такое заболевание, как, например, болезни «коровьего бешенства», или почесухи. Эти частицы были названы прионами. Проникая в клетку-хозяина, прионы «навязывают» свою болезнетворную конформацию (измененную пространственную структуру) нормальным белкам-аналогам, содержащимся в клетках. При этом ни РНК, ни ДНК никак не участвуют в развитии заболевания. Иными словами, при прионовых заболеваниях информация передается не от одной нуклеиновой кислоты к другой нуклеиновой кислоте, а от белка к белку, что в исходном варианте центральной догмы не предусматривалось.
Однако все эти дополнения в «центральную догму» молекулярной биологии не повлияли принципиально на ее общую закономерность. В центре всего и вся стоял и стоит ген. Сегодня он перестал быть чем-то таинственным, стал реальным химическим веществом, появилась возможность судить о нем так же, как и о других химических соединениях живых организмов, изучать с помощью доступных генетикам и биохимикам методов. Стало понятным, что такое генетический код и как реализуется в клетке та информация, которая записана в ДНКовом тексте. В результате этого в 1953 году родилась молекулярная генетика — раздел науки, который занялся детальным изучением процессов работы ДНК в клетке на молекулярном уровне.
Расшифровка химической и пространственной структуры ДНК — носителя генетической информации — оценена во всем мире как одно из наиболее выдающихся открытий XX века. Геном стоит в центре всех биологических проблем, всех свойств и способностей человека, всего разнообразия человека. Теперь это уже аксиома. Как говорил Козьма Прутков: «Многие люди подобны колбасам: чем их начинят, то и носят в себе». Так вот, мы «начинены» ДНК, носим ее в себе, а она-то, главным образом, и определяет многое в нас.
ДЛИННАЯ ИСТОРИЯ СО СЧАСТЛИВЫМ КОНЦОМ
Сначала неизбежно идут: мысль, фантазия, сказка.
За ними шествует научный расчет.
И уже, в конце концов, исполнение венчает мысль.
К. Э. Циолковский
Начало — половина целого.
Пифагор
После открытия структуры ДНК и расшифровки содержащегося в ней генетического кода сразу же начался следующий важный этап — изучение организации целых геномов. Но до прямого определения всех нуклеотидных последовательностей гигантских молекул ДНК было еще очень далеко. Дело в том, что в 60-х и начале 70-х годов прошедшего столетия технические возможности и методические подходы к исследованиям столь больших биологических молекул были еще весьма несовершенны. Однако энтузиазм ученых после установления основных особенностей структуры ДНК был огромным, и на эту главную молекулу жизни навалились со всех возможных сторон многочисленные специалисты, используя все доступные на то время методы и средства.
Хромосомы дают первые сведения о структуре генома
Выше уже говорилось, что в ядре клетки молекулы ДНК расположены в особых структурах, получивших название хромосомы. Их исследование началось еще свыше 100 лет назад с помощью обычного светового микроскопа. Уже к концу XIX века выяснилось кое-что о поведении хромосом в процессе деления клеток и высказывалась мысль об их участии в передаче наследственности.
Хромосомы становятся видимыми в микроскопе при делении клетки на определенной стадии клеточного цикла, называемой митозом. Хромосомы в этом состоянии представляют собой компактные палочковидные структуры разной длины с довольно постоянной толщиной, у большей части хромосом имеется перетяжка, которая делит хромосому на два плеча. В области перетяжки расположена важная для удвоения хромосом структура, называемая центромерой. При делении клетки в ходе митоза происходит удвоение числа хромосом, в результате которого обе вновь образующиеся клетки в конечном итоге обеспечиваются одним и тем же стандартным набором хромосом.
Лишь в 1956 г. впервые Ю. Тио и A. Леван описали хромосомный набор человека, определили количественный состав хромосом и дали их общую морфологическую характеристику. По сути дела эти работы и положили начало изучению структуры генома человека. У человека в каждой клетке тела содержится 46 хромосом, физические длины которых находятся в пределах от 1,5 до 10 мкм (рис. 7).

Рис. 7. Вид под микроскопом полного набора хромосом, содержащихся в ядре каждой отдельной клетки человека
Напомним читателю, что набор хромосом во всех клетках человека (за исключением половых) называют диплоидным (двойным), поскольку каждая из хромосом представлена двумя копиями (всего 23 пары). Каждая соматическая клетка человека (кроме красных кровяных клеток крови) содержит по 2 полных набора хромосом. В каждом единичном (гаплоидном) наборе присутствует 23 хромосомы — 22 обычные хромосомы (аутосомы) и по одной половой хромосоме — X или Y. Таким образом, геном каждого конкретного человека состоит из 23 пар гигантских молекул ДНК, распределенных в разных хромосомах, а если говорить о геноме человека вообще (мужчин и женщин), то общее число таких молекул равно 24. Это первое базовое сведение, которое было получено о геноме человека при анализе хромосом.
Изучение строения (размера и формы) хромосом человека показало, что большинство из них по внешнему виду напоминают кегли, состоящие из двух толстых частей (хроматид) и тонкой перетяжки (центромеры) между ними. Сходство с кеглями, а не с гантелями заключается в том, что центромера чаще всего расположена не в центре хромосомы, а смещена к одному из ее концов. Размеры хромосом сильно варьируют, самая короткая хромосома примерно в десять раз меньше, чем самая длинная. Это второе принципиально важное сведение о структуре генома человека — составляющие его 24 молекулы ДНК имеют разный размер.
Если сравнивать число и размер хромосом у человека и у других видов организмов, то можно увидеть огромные отличия. Например, у коровы, размер генома которой примерно равен геному человека, имеется 60 пар хромосом. У шпорцевой лягушки содержится всего 18 хромосом, но даже самые маленькие из них больше, чем самые крупные хромосомы человека. У птиц, наоборот, число хромосом достигает 40 и более и все они очень небольшие по размерам. Таким образом, разнообразие хромосом в природе весьма велико.
С помощью световой микроскопии были определены размеры всех хромосом человека. Затем все неполовые хромосомы были пронумерованы по уменьшению размера — от 1 до 22. Половым хромосомам не присвоили номер, а назвали X и Y. Как показали более точные последующие исследования, хромосома 21 реально оказалась чуть меньше 22, однако нумерацию хромосом не изменили (чтобы не вносить путаницу). Различие в хромосомных наборах между мужчинами и женщинами состоит в том, что у женщин имеются две половые X-хромосомы (т. е. хромосомы во всех 23-х парах одинаковы), а у мужчин пару с X-хромосомой образует мужская половая хромосома — Y. Каждую хромосому можно рассматривать как отдельный том большого двадцатичетырехтомного собрания сочинений под названием Энциклопедия человека.
Половые клетки человека, в отличие от клеток тела взрослого организма (соматических клеток), содержат не 2 набора томов ДНКового текста, а всего лишь один. Перед зачатием каждая отдельная хромосома (отдельный том в Энциклопедии человека) сперматозоида отца и яйцеклетки матери состоят из смешанных в разном сочетании различных глав ДНКового текста их родителей. Любая из хромосом, полученная нами от отца, образовалась в его семенниках незадолго до того, как мы были зачаты. Ранее, за всю историю человечества, точно такая хромосома никогда не существовала. Она была сформирована в процессе случайного перемешивания, происходящего при делении, постепенно образуясь из объединяющихся друг с другом участков хромосом предков со стороны отца. Также обстоит дело и с хромосомами яйцеклеток, за исключением того, что они формируются в организме нашей матери задолго до нашего рождения (почти сразу после рождения самой матери).
В зиготе, образующейся в результате слияния сперматозоида и яйцеклетки, материнские и отцовские гены смешиваются и перетасовываются в разных сочетаниях. Это происходит в результате того, что хромосомы не остаются неизменными в поколениях — они вступают во взаимодействие со своей случайно встреченной парой, обмениваясь с ней материалом. Такой постоянно идущий процесс получил название рекомбинации. И следующему поколению часто достается уже гибридная хромосома — часть от дедушки и часть от бабушки. Далее в ряду поколений пути генов постоянно пересекаются и расходятся. В результате слияния уникальной яйцеклетки с уникальным сперматозоидом и возникает уникальный во всех отношениях геном. И в этом смысле все мы уникумы. Каждый человеческий индивид хранит уникальную генетическую информацию, состоящую из случайной комбинации разных вариантов генов.
Отдельный ген можно рассматривать как единицу, продолжающую существовать в ряду многочисленных поколений. И в этом смысле ген бессмертен! Существует даже такая оригинальная точка зрения, что не сами люди, а их гены правят миром, а каждый конкретный живой организм служит лишь временным прибежищем для них. Эта не бесспорная мысль принадлежит Ричарду Докинзу, автору книги «Эгоистичный ген». По его мнению, гены практически бессмертны в отличие от живых организмов, в которых они существуют. Некоторым генам десятки и даже сотни миллионов лет. Гены, пользуясь терминологией Докинза, делают все возможное, чтобы выжить. Приспосабливаются к жаре и холоду, выбирая себе местечко получше, мигрируют с помощью человека и вступают в новые комбинации. Человек оказался довольно непоседливым хозяином. За тысячи лет он сильно исколесил мир, распространяя свое присутствие, влияние и свою начинку — гены. (Подробнее с идеями и аргументацией Р. Докинза любознательный читатель может познакомиться в Приложении 1). Такая точка зрения далеко не бесспорна, и из дальнейшего изложения нам станет понятно, что гены — это в первую очередь не эгоисты, а трудоголики. Имеются гены — «сторожа» генома, гены — «дворники», гены — «повара» и гены — «домоуправители». Обеспечивая свое существование, они обеспечивают и существование нас.
Сразу после зачатия будущий человек представляет собой всего одну клетку (зиготу), наделенную одной исходной ДНКовой библиотекой, содержащей 46 томов. Среди 46 томов всегда 23 получены от отца, а другие 23 — от матери. Тексты 23 отцовских и 23 материнских томов хотя и очень сходны в целом, тем не менее отличаются в деталях. Например, в отцовском томе № 18 на странице 253 существует предложение-предписание (в виде гена), в котором сказано, что глаза у ребенка должны быть карими, а в этом же материнском томе на той же странице тоже написано о цвете глаз, но согласно этому тексту цвет должен быть голубыми. Первое указание более строгое (доминирующее), чем второе, и в результате у ребенка глаза будут иметь карий цвет. Ген, который диктует свои права, называют доминирующим, а тот, который уступает свои права, — рецессивным. Голубой цвет глаз имеют только те люди, у которых и в материнском, и в отцовском тексте содержатся рецессивные гены, в которых есть указание на голубоглазость. Затем зигота делится на две клетки, каждая из них вновь делится и так до появления миллиардов клеток. Схематически процесс деления клеток изображен на рис. 8.
При каждом делении клетки содержащиеся в библиотеках тома ДНКового текста точно копируются, причем практически без ошибок. Организм взрослого человека состоит в среднем из 1014 клеток. Например, в головном мозге и печени насчитывается примерно по 10 млрд. клеток, в иммунной системе — 300 млрд. клеток. В течение всей жизни человека в его организме происходит около 1016 клеточных делений. Клеточный состав многих органов за 70 лет жизни обновляется несколько раз. И каждая из этих клеток содержит одни и те же 46 томов ДНКового текста.
В конце 60-х годов XX века был осуществлен важный прорыв в исследовании хромосом. Обусловлен он был всего лишь тем, что для их окраски стали использовать специальное контрастное вещество — акрихин-иприт, а затем и другие сходные с ним соединения. Такая окраска позволила выявить внутри хромосом большое число разных субструктур, которые не обнаруживались под микроскопом без окрашивания. После окрашивания хромосом специфическим красителем Гимза-Романовского они выглядят как зебры: вдоль всей длины видны поперечные светлые и темные полосы, имеющие окраску разной интенсивности.
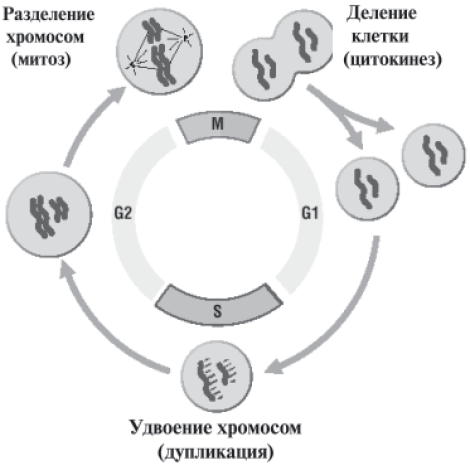
Рис. 8. Основные стадии клеточного цикла, приводящего к делению клетки
Эти полосы получили название хромосомных G-сегментов или полос (рис. 9). Картина сегментации сильно отличается у разных хромосом, но расположение хромосомных сегментов постоянно у каждой из хромосом во всех типах клеток человека.
Природа полос, выявляемых при окраске, до конца еще не ясна. Сейчас установлено только, что участки хромосом, соответствующие темным полосам (названные R-полосами), реплицируются раньше, чем светлые участки (названные G-полосами). Таким образом, полосатость хромосом скорее всего все же имеет некий до конца еще не понятый смысл.
Окрашивание хромосом очень облегчило их идентификацию, а в дальнейшем способствовало определению расположения на них генов (картированию генов).
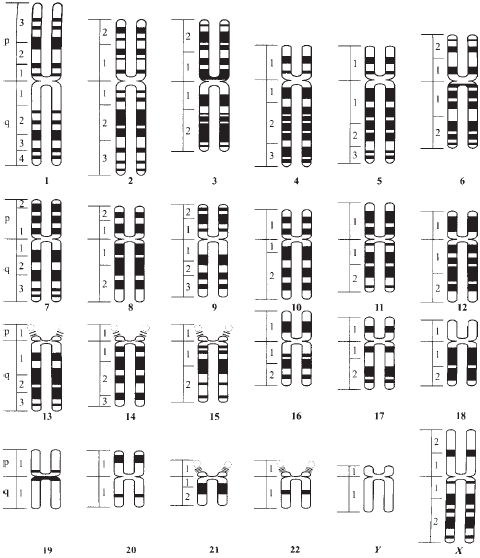
Рис. 9. Специфические хромосомные G-сегменты, выявляемые при окраске хромосом человека, и система их обозначения согласно решению международной конференции в Париже в 1971 году. Цифрами под хромосомами указаны их номера. X и Y — половые хромосомы, p — короткое плечо, q — длинное плечо хромосом
Хотя детальные процессы, происходящие при окрашивании, еще не до конца ясны, очевидно, что картина окраски зависит от такого параметра, как увеличенное или уменьшенное содержание в отдельных полосах хромосом АТ или ГЦ-пар. И это еще одно общее сведение о геноме — он не однороден, в нем есть районы, обогащенные определенными парами нуклеотидов.
Это, в частности, может быть связано с повторяемостью некоторых типов нуклеотидных последовательностей ДНК в определенных районах.
Дифференциальная окраска хромосом нашла широкое применение для выявления и идентификации небольших индивидуальных изменений генома конкретного человека (полиморфизма), в частности, приводящих к различным патологиям. Примером этому может служить обнаружение так называемой филадельфийской хромосомы, встречающейся у больных с хроническим миелоидным лейкозом. С помощью окраски хромосом установлено, что у пациентов с этим заболеванием определенный фрагмент исчезает на хромосоме 21 и появляется на конце длинного плеча хромосомы 9 (перенос фрагмента или транслокация, сокращенно t). Генетики обозначают такое событие как t (9; 21). Таким образом, хромосомный анализ свидетельствует о том, что разные молекулы ДНК могут обмениваться между собой отдельными участками, в результате чего в геноме образуются «гибриды», состоящие из молекул ДНК разных хромосом. Анализ уже изученных свойств хромосом позволил сформировать представление о полиморфизме генома человека.
Для выяснения локализации отдельных генов на хромосомах (то есть картирования генов) используют целый арсенал специальных зачастую весьма сложных по замыслу и исполнению методов. Один из основных — молекулярная гибридизация (образование гибрида) гена или его фрагмента с фиксированными на твердой подложке препаратами хромосом, выделенными из клеток в чистом виде (это называют гибридизацией in situ). Суть метода гибридизации in situ заключается во взаимодействии (гибридизации) между денатурированными (расплетенными) нитями ДНК в хромосомах и комплементарными нуклеотидными последовательностями добавленных к препарату хромосом, индивидуальных однонитевых ДНК или РНК (их называют зондами). При наличии комплементарности между одной из нитей хромосомной ДНК и зондом между ними образуются довольно стабильные молекулярные гибриды. Зонды маркируют предварительно с помощью разных меток (радиоактивных, флуоресцентных или др.). Места образования гибридов на хромосомах выявляют по положению этих меток на препаратах хромосом. Так, еще до появления методов генной инженерии и секвенирования ДНК выяснили, например, расположение в геноме человека генов, кодирующих большие и малые рибосомные РНК (рРНК). Гены первых оказались локализованными в пяти разных хромосомах человека (13, 14, 15, 21 и 22), тогда как основная масса генов малой рРНК (5S РНК) сконцентрирована в одном месте на длинном плече хромосомы 1.
Пример картины, получаемой при гибридизации меченых флюоресцентным красителем генов-зондов, приведен на рис. 10 на цветной вклейке.
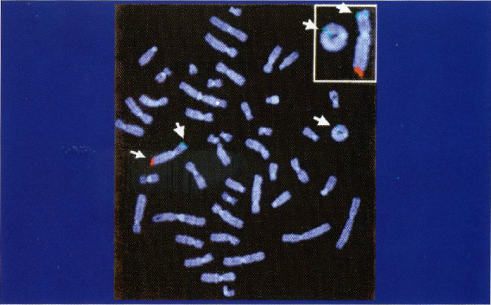
Рис. 10. Гибридизация хромосом человека с генами-зондами, мечеными красным и зеленым флюоресцентными красителями. Стрелками указано расположение соответствующих генов на концах двух разных хромосом (справа вверху дано увеличение картины гибридизующихся хромосом).
Гены, расположенные на одной хромосоме, определяют как сцепленные (связанные) гены. Если гены расположены на разных хромосомах, они наследуются независимо (независимая сегрегация). Когда же гены находятся на одной и той же хромосоме (т. е. сцеплены), они неспособны к независимой сегрегации. Изредка в половых клетках могут происходить различные изменения хромосом в результате рекомбинационных процессов между гомологичными хромосомами. Один из таких процессов получил название кроссинговера. Из-за кроссинговера сцепление между генами одной группы никогда не бывает полным. Чем ближе расположены друг к другу сцепленные гены, тем меньше вероятность изменения расположения таких генов у детей по сравнению с родителями. Измерение частоты рекомбинаций (кроссинговера) используется для установления линейного порядка генов на хромосоме внутри группы сцепления. Таким образом, при картировании хромосом первоначально устанавливают, находятся ли данные гены в одной и той же хромосоме, без уточнения, в какой именно. После того, как хотя бы один из генов данной группы сцепления локализуют в определенной хромосоме (например, с помощью гибридизации in situ), становится ясным, что все другие гены этой группы сцепления находятся в той же самой хромосоме.
Первым примером связи генов с определенными хромосомами может служить обнаружение сцепления определенных наследуемых признаков с половыми хромосомами. Чтобы доказать локализацию гена в мужской половой Y-хромосоме, достаточно показать, что данный признак всегда встречается только у мужчин и никогда не обнаруживается у женщин. Группа сцепления женской X-хромосомы однозначно характеризуется отсутствием наследуемых признаков, передающихся от отца к сыну, и наследованием признаков матери.
Особенно важным для изучения генома человека на первых этапах его исследования стал метод, называемый гибридизацией соматических клеток. При смешивании соматических (неполовых) клеток человека с клетками других видов животных (чаще всего для этой цели использовали клетки мышей или китайских хомячков) в присутствии определенных агентов может происходить слияние их ядер (гибридизация). При размножении таких гибридных клеток происходят потери некоторых хромосом. По счастливой для экспериментаторов случайности в гибридных клетках человек-мышь происходит потеря большей части хромосом человека. Далее отбираются гибриды, в которых остается только какая-нибудь одна человеческая хромосома. Исследования таких гибридов позволили связать некоторые биохимические признаки, свойственные клеткам человека, с определенными хромосомами человека. Постепенно благодаря использованию селективных сред научились добиваться сохранения или потери отдельных хромосом человека, несущих определенные гены. Схема отбора, хотя и не очень проста на первый взгляд, довольно хорошо показала себя в эксперименте. Так, придумали специальную селективную среду, на которой могут выживать только те клетки, в которых синтезируется фермент тимидинкиназа. Если для гибридизации с клетками человека взять в качестве партнера мутантные клетки мыши, не синтезирующие тимидинкиназу, то будут выживать только те гибриды, которые содержат хромосомы человека с геном тимидинкиназы. Таким путем впервые удалось установить локализацию гена тимидинкиназы на хромосоме 17 человека.
Несмотря на то, что изучение генома человека на уровне хромосом дало ряд важных его характеристик, они были самыми общими и дали относительно мало для полного понимания устройства и функционирования генетического аппарата человеческих клеток.
Как двухметровая молекула умещается в микроскопическом ядре?
Как уже говорилось, молекулы ДНК, содержащиеся во всех хромосомах одной клетки человека, имеют общую длину около 2 метров. Это в среднем в миллион раз больше, чем диаметр клеточного ядра, составляющий порядка микрометра. Как же умещаются столь гигантские молекулы в таком маленьком ядре? Изучение структуры хромосом позволило ответить на этот вопрос. Оказывается, в ядре осуществляется «насильственная» упаковка молекул ДНК. Это достигается с помощью специальных механизмов, обеспечивающих изгибание двойной спирали ДНК. Существует несколько уровней «компактизации» ДНК в клетке (рис. 11).
Некоторые из особенностей упаковки ДНК изучены хорошо, а о некоторых существуют пока лишь приблизительные представления. Первый уровень компактизации заключается в накручивании нити ДНК, как нитки на катушку, на специальный комплекс ядерных белков (гистонов).
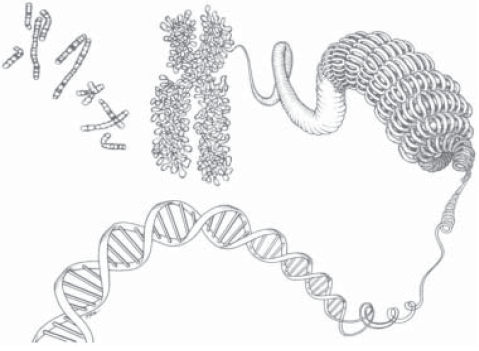
Рис. 11. Стадии упаковки ДНК в хромосомах (от двойной спирали до целых хромосом)
Нить ДНК делает около двух оборотов вокруг одного комплекса, а затем снова около двух оборотов вокруг второго комплекса и т. д. В результате образуется структура, напоминающая бусы. Отдельные бусинки в этой структуре получили название нуклеосомы. На одной нуклеосоме размещается около 200 пар нуклеотидов ДНК. Между нуклеосомами остается фрагмент ДНК размером до 60 пар оснований, называемый линкером. Этот уровень укладки позволяет уменьшить линейные размеры ДНК в 6–7 раз.
На втором уровне компактизации «бусы» укладываются в спираль, состоящую из шести нуклеосом на виток. При этом линейные размеры ДНК уменьшаются в сумме до 1 мм, т. е. в 25–30 раз.
Третий уровень компактизации молекул ДНК изучен еще плохо. Скорее всего, это петельная укладка фибрилл — образование петельных доменов, которые под углом отходят от основной оси хромосомы (уплотнение в 680 раз). Их можно видеть в обычный световой микроскоп.
На последнем уровне компактизации ДНК происходит ее уплотнение примерно в 10000 раз.
Анализ суммарной ДНК — новые сведения о структуре генома человека
На первом этапе непосредственного исследования структуры генома человека, когда еще не существовала методология генной инженерии, для изучения ДНК применяли традиционные физико-химические методы. В этих опытах использовали суммарные препараты ДНК, целиком выделенные из ядер клеток человека.
Пожалуй, первые сведения о молекулярной структуре генома человека были получены в результате центрифугирования в пробирке растворов ДНК в хлористом цезии при довольно высоких скоростях. В процессе вращения соли цезия создают тонкие слои раствора с различной плотностью (градиент плотности) вдоль пробирки и молекулы ДНК перемещаются в этом градиенте, пока не достигнут такой области, где плотность солевого раствора будет точно такой же, как их собственная. А плотность ДНК сильно зависит от содержания АТ и ГЦ-пар нуклеотидов, т. е., как говорят, от нуклеотидного состава. Оказалось, что основная масса ДНК человека после центрифугирования располагается преимущественно в одной зоне градиента (это соответствует среднему содержанию ГЦ-пар в геноме человека, равному 42%). Однако наряду с этим неожиданно обнаруживались и небольшие (минорные) полосы, в которых также содержались молекулы ДНК, но с иной плотностью и, следовательно, с иным содержанием нуклеотидных пар. Такие минорные, или дополнительные фракции ДНК получили название «сателлитных». Такое имя дали этим фракциям не случайно. В то время как раз был запущен первый советский спутник (лат. satellitis — спутник). Это и натолкнуло исследователей на такое название.
Вскоре после того, как была установлена двухспиральная структура ДНК, обнаружили, что при сильном нагревании ДНК две ее цепи расходятся (расплавляются) и ДНК из двунитевой превращается в однонитевую. Это приводит к нарушению ее естественной структуры, что получило отражение в названии данного процесса — денатурация ДНК. Однако при охлаждении денатурированной ДНК комплементарные цепи находят друг друга и соединяются строго так, как они располагались в исходной неденатурированной молекуле, по типу застежки — «молнии». Этот процесс получил название ренатурации или реассоциации. Сразу же после обнаружения этого явления оно было использовано экспериментаторами в целях изучения структуры генома.
Немного совсем простой математики для тех самых любопытных, кто недавно закончил ВУЗ, изучал химию и еще не забыл все, чему его учили. Процесс реассоциации ДНК во многом сходен с обычной химической реакцией второго порядка и, по этой причине, может быть описан довольно простой формулой:
Сt /C0 = 1/(1 + k2 (C0 t)),
где C0 и Сt — концентрации однонитевых ДНК соответственно в начальный (нулевой) момент времени и в момент времени t после начала реакции реассоциации, k2 — константа скорости реакции второго порядка.
Для удобства изображения процесса реассоциации строят график, в котором по оси ординат откладывают долю реассоциированных молекул, а по оси абсцисс — величину C0 t. При таком изображении кривые кинетики реассоциации ДНК простейших организмов (вирусов и бактерий) имеют S-образный вид. Это соответствует кинетике химической реакции второго порядка. Если в эксперименте наблюдают отклонения от этой кривой, то это должно указывать на гетерогенность цепей ДНК по скорости взаимодействия друг с другом: одни реагирует быстрее, другие, соответственно, медленнее. Когда ДНК человека порезали на куски небольшого размера и измерили кинетику их реассоциации, то обнаружилось, что кривая, описывающая этот процесс, далека от стандартной (рис. 12).
Это явилось результатом того, что в ДНК человека имеются нуклеотидные последовательности, реассоциирующие с разной скоростью, а суммарная кривая реакции, наблюдаемая в опыте, отражает совокупность множества независимых реакций второго порядка. Когда были проведены эти эксперименты, уже существовал математический аппарат, позволяющий, хотя и очень грубо, вычленять из сложной суммарной кривой отдельные относительно однородные кинетические компоненты. Различия в скоростях реассоциации разных компонентов ДНК человека были связаны с разной представленностью в ДНК отдельных нуклеотидных последовательностей. Участки, которые присутствуют в геноме всего один раз, назвали уникальными. Если в геноме определенная нуклеотидная последовательность не уникальна, а представлена неким числом одинаковых копий (т. е. повторяется, отсюда и название — повторяющаяся), то такая последовательность, естественно, по чисто химическим законам, будет в растворе находить комплементарную цепь и взаимодействовать с ней (реассоциировать) значительно быстрее первой.
В результате такого анализа нашли, что в геноме человека около 75% участков ДНК представлены 1 копией (уникальные) на гаплоидный геном (естественно, в ядре, являющемся диплоидным, имеется 2 копии каждой уникальной нуклеотидной последовательности). Остальную часть генома составляют повторяющиеся последовательности (повторы), среди которых 10% представлены очень быстро реассоциирующими повторами (104 и более копий на геном) и около 15% — умеренными повторами. Заметим сразу, что в дальнейшем эти оценки были существенно пересмотрены. Однако некоторые из этих результатов остались в силе до сих пор.
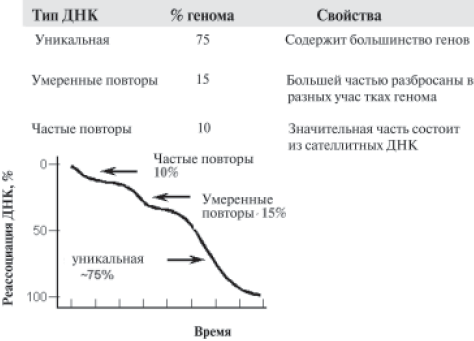
Рис. 12. Кинетика восстановления двунитевых молекул из искусственно разделенных комплементарных цепей ДНК человека (реассоциация). ДНК разбивают на небольшие фрагменты, денатурируют путем нагревания, а затем при охлаждении разошедшиеся цепи ДНК вновь соединяются. Чем чаще в смеси встречаются те или иные последовательности, тем быстрее они находят друг друга в растворе и реассоциируют. По этой кинетике определяли общее содержание повторяющихся и неповторяющихся (уникальных) нуклеотидных последовательностей в геноме человека
Первоначальные анализы показали, что среди быстро взаимодействующих друг с другом при реассоциации фрагментов ДНК присутствует некоторое количество таких, кинетика реассоциации которых отличается от реакции второго порядка. Причина этому оказалось в том, что эти участки представляют собой так называемые обращенные повторы, или палиндромы — взаимокомплементарные последовательности, расположенные не на разных, а на одной нити ДНК.
Таким образом, в ДНКовом текте присутствуют «предложения» — палиндромы («перевертыши»), одинаково читаемые слева направо и справа налево. Перевертыши хорошо известны из литературы — это предложения, которые читаются одинаково слева направо и справа налево без учета знаков препинания и интервалов между словами. В качестве примера приведем один из таких перевертышей:
УЖРЕДКОРУКОЮОКУРОКДЕРЖУ.
В ДНК перевертышами называют отрезки двойной антипараллельной спирали, которые имеют одинаковую нуклеотидную последовательность при чтении по обеим цепям в одинаковом направлении. Это выглядит как, например, в ниже приведенном случае:

Здесь стрелками показано направление цепей ДНК, а звездочками — водородные связи, образуемые между парами нуклеотидов. Общее число таких «перевертышей» в геноме человека оценено в интервале от 105 до 106. При этом они относительно равномерно распределены по ДНК.
Имеются в геноме человека и нуклеотидные последовательности, которые на всем своем протяжении построены из одной единственной «буквы». Если в одной цепи ДНК эта буква А, то в другой цепи, соответственно, будет буква Т. Такие участки названы гомополимерными. В случае приведенного выше примера последовательность нуклеотидов записывается, как поли(А) — поли(Т). Таким образом, выяснилось, что в геноме человека (а параллельно это изучали и в геномах других организмов) имеются все варианты нуклеотидных последовательностей, состоящих из 4 «букв», которые только можно себе мысленно представить.
Используя различные модификации метода реассоциации ДНК, установили также, что в большей части генома человека повторяющиеся и уникальные нуклеотидные последовательности перемежаются друг с другом, а средние длины перемежающихся повторяющихся и уникальных фрагментов ДНК составляют соответственно 300 и 2000 п. н.
Приведенные выше данные были, конечно же, усредненными и поверхностно отражали общую картину устройства генома человека. Тем не менее они послужили хорошей основой для дальнейших более углубленных исследований. Важно, что одновременно такие же работы проводились и с использованием других эукариотических организмов. Многие моменты оказались сходными у разных высших организмов и растений. Так постепенно начали вырисовываться в общих чертах основные принципы организации генома человека.
Новый этап — анализ индивидуальных элементов ДНК (генная инженерия)
Мысль ученых продолжала интенсивно работать. И в результате в 1970-х годах были разработаны принципиально новые методы работы с ДНК. Ее научились резать на фрагменты, сшивать их друг с другом, а затем переносить в клетки и целые организмы. На практике это сводится к созданию в пробирке (т. е. in vitro) новых молекул ДНК, состоящих из фрагментов разного происхождения (так называемых рекомбинантных ДНК), которые в естественных условиях не могут возникнуть благодаря установленным и тщательно охраняемым Природой межвидовым барьерам. Датой рождения нового революционизирующего направления, получившего название генной инженерии, принято считать 1972 год, когда в США была создана первая рекомбинантная молекула ДНК.
Становление генной инженерии происходило очень непросто. Уже в самом начале (в 1973 году) участники Гордоновской конференции направили письмо президенту Национальной Академии наук США, в котором высказывали серьезные опасения о возможной опасности рекомбинантных ДНК для здоровья человека и окружающей среды. Прозвучал даже призыв к мораторию на некоторые виды генно-инженерных исследований. Два года спустя состоялась конференция в Асиломаре (США), где также шла речь об опасности генно-инженерных манипуляций и их ограничении. Один из основных исследователей структуры ДНК Э. Чаргафф, в частности, вопрошал: «Имеем ли мы право посягать необратимым образом на эволюционную мудрость миллионов лет только для того, чтобы удовлетворить амбицию и любопытство нескольких ученых?» Озабоченность ученых объяснялась теоретической возможностью создания в пробирке новых генетических структур, способных вызывать необычные формы инфекционных заболеваний человека, или созданием организмов, неблагоприятно воздействующих на окружающую среду. Однако как тогда, так и по прошествии трех десятков лет не существует никаких подтверждений тому, что рекомбинантные ДНК представляют опасность для человека. Современное состояние молекулярной генетики и как вершина ее развития — секвенирование генома человека — свидетельствуют о том, что генная инженерия полностью оправдала большие надежды ученых и поддерживающей ее общественности. Сейчас уже практически нет спора в отношении важности и необходимости использования генной инженерии для решения как научных, так и практических задач, стоящих перед человечеством.
Генная инженерия как принципиально новая технология возникла в значительной мере на базе достижений, которых ученые добились при изучении молекулярных процессов, которые происходят в бактериальной клетке. Было сделано несколько важных открытий, прежде чем исследователи научились легко и направленно манипулировать с ДНК, а не просто смешивать фрагменты ДНК с бактериями и отбирать среди них случайно возникающие варианты (рекомбинанты).
Бактерии имеют высокоэффективный механизм защиты от чужеродной ДНК. Исследование этой проблемы привело к обнаружению в бактериях специальных ферментов, получившие название рестриктаз. Первые из них получены еще в 1970 г. Сейчас уже выделено несколько сот разнообразных рестриктаз из клеток разных видов бактерий. Каждый из таких ферментов «узнает» строго определенные короткие (обычно 4–6 п. н.) нуклеотидные последовательности ДНК, которые чаще всего представляют собой палиндромы, и разрезает ДНК на фрагменты по этим участкам. В результате этих свойств рестриктазы стали незаменимым инструментом в исследовании генома, своеобразным скальпелем для ДНК.
Большой удачей для экспериментаторов было то, что в большинстве случаев при нарезании рестриктазами ДНК образующиеся фрагменты содержат «липкие» концы, т. е. способны в дальнейшем соединяться друг с другом. Для восстановления химической связи таких слипшихся фрагментов стали использовать еще один новый класс ферментов — лигазы. Так появились первые инструменты, позволяющие целенаправленно манипулировать с молекулами ДНК in vitro. Следующий важный этап — размножение сконструированных рекомбинантных ДНК, чтобы можно было с ними работать дальше. Для этой цели стали использовать специальные ДНК — векторы, которые представляют собой или бактериофаги, или внехромосомные кольцевые молекулы — плазмиды, которые обладают способностью размножаться в бактериальных клетках. Если любой фрагмент ДНК внести в состав ДНК бактериофагов или плазмид, то при переносе в бактериальные клетки он будет там размножаться вместе с вектором. Наконец, были разработаны специальные подходы для отбора бактериальных клеток, в которых содержатся необходимые рекомбинантные ДНК. Все эти достижения позволили проводить клонирование ДНК, т. е. выделять из сложной смеси молекул определенные участки ДНК и размножать их.
Клонирование фрагментов ДНК дало в руки исследователей принципиально новый подход к выделению из сложной смеси ДНКовых фрагментов конкретных индивидуальных последовательностей. При этом они могли содержать осмысленные тексты (гены) или не содержать таковых. Традиционная биохимия не могла обеспечить подобную процедуру в силу того, что различные фрагменты ДНК химически очень сходны. Но генной инженерии это оказалось вполне под силу. Схематически процесс клонирования ДНК изображен на рис. 13.

Рис. 13. Схема процесса клонирования ДНК с использованием в качестве вектора бактериальной плазмидной ДНК
После разрезания ДНК на фрагменты с помощью рестриктазы все они соединяются ковалентно с вектором (вектор разрезан той же рестриктазой) в результате «слипания» концов молекул и последующей обработки «гибридов» лигазой. Так в пробирке создается искусственная или рекомбинантная ДНК. Затем осуществляют перенос множества образовавшихся рекомбинантных молекул в бактериальные клетки — трансформацию. Особенность процесса трансформации заключается в том, что в одну бактериальную клетку попадает лишь одна рекомбинантная молекула ДНК. После этого, благодаря отбору, размножаются только бактерии с рекомбинантными ДНК, содержащими требуемые нуклеотидные последовательности.
Для изучения структуры генома необходимо не только клонировать все его участки в виде рекомбинантных молекул, но, главное, расшифровать в них последовательность нуклеотидов, т. е. «прочесть» ДНКовый текст.
Важным моментом во всей этой генно-инженерной «кухне» было создание принципиально новой технологии размножения индивидуальных фрагментов ДНК in vitro. Этот удивительно простой метод получения фрагментов ДНК в неограниченном количестве копий был придуман при необычных обстоятельствах — ночью, во время автомобильной поездки в горах Калифорнии. Автор этой идеи нобелевский лауреат Кэри Б. Мюллис так вспоминает момент озарения. «Иногда удачная идея приходит в голову совершенно неожиданно. Со мной, например, это случилось в одну из апрельских ночей в 1983 г., когда я, сидя за рулем автомобиля, пробирался по освещенной луной горной дороге в секвойные леса Северной Калифорнии. Мысль моя случайно натолкнулась на процесс, благодаря которому можно получать копии генов в неограниченных количествах. Теперь он называется «полимеразной цепной реакцией». За создание новой технологии ее автор получил Нобелевскую премию.
Полимеразная цепная реакция (сокращенно ПЦР) дает возможность в течение дня из одной молекулы ДНК получать 100 миллиардов идентичных по структуре молекул. Эта реакция довольно проста в исполнении: нужны лишь ДНК, пробирка, несколько реагентов и источник нагревания и охлаждения. Препарат ДНК, который необходимо копировать, может быть получен и из кусочка ткани, и из капли засохшей крови, и из засушенной мумии, и даже из тела мамонта, пролежавшего несколько тысяч лет в вечной мерзлоте. Суть этого метода изображена на рис. 14 на цветной вклейке.
Сама процедура ПЦР заключается в следующем. Прежде всего, ДНК денатурируют, нагревая ее до 98°С. При этом две цепи ДНК, относительно слабо связанные между собой, разделяются друг от друга. Далее в ход идут так называемые затравки (праймеры) — короткие однонитевые фрагменты ДНК, которые комплементарны краям того участка генома, который собираются размножать (амплифицировать). Эти затравки гибридизуются с комплементарными участками однонитевых молекул ДНК, после чего специальный фермент (ДНК-полимераза) удлинняет затравки, строя молекулу ДНК по матрице (цикл 1). Затем продукты реакции вновь денатурируют и процедуру повторяют необходимое число раз. За 20–30 циклов из одной молекулы можно получить миллионы копий ДНК. Этот процесс подобен цепной ядерной реакции, но осуществляется в пробирке с помощью специального фермента — термостабильной ДНК-полимеразы. По этой причине он и получил название полимеразной цепной реакции.

Рис. 14. Схема протекания полимеразной цепной реакции (ПЦР).
Конечная цель — определение полной последовательности нуклеотидов в ДНК человека
Длительное время искали эффективные методы, позволяющие определять последовательность нуклеотидов в длинных молекулах ДНК (такое определение нуклеотидной последовательности получило название секвенирование, от анг. sequence — последовательность). Только в середине 70-х годов секвенирование протяженных участков ДНК стало возможным. Связано это было с изобретением принципиально новых подходов. В 1976 г. А. Максамом и У. Гилбертом был разработан метод прямого секвенирования, основанный на химической деградации ДНК. В данном случае осуществляется специфическая химическая фрагментация длинной цепи ДНК (полинуклеотида), радиоактивно меченной с одного конца. Затем препарат меченой ДНК разделяют на четыре порции и каждую из них обрабатывают реагентом, модифицирующим одно или два из четырех оснований, содержащихся в ней. После разделения в специальном геле меченых фрагментов по размерам (с помощью электрофореза) на рентгеновских пленках смотрят, что при этом происходит с нуклеотидной последовательностью, и на основании этого делают вывод о порядке расположения нуклеотидов друг за другом в каждом фрагменте ДНК. Однако метод оказался довольно сложным. В становлении этого метода на его начальных этапах существенную роль сыграл российский ученый академик А. Д. Мирзабеков, работавший в лаборатории У. Гилберта.
Чуть раньше английский ученый Фред Сэнгер предложил иной способ расшифровки структуры ДНК, который в конечном итоге после разных модификаций стал основным. Согласно методу Сэнгера молекулу ДНК с помощью специальной обработки ферментами не только расщепляют на фрагменты, но и «расплетают» ее двойную спираль на две нити. Потом по каждому из полученных обрывков «нитей» с помощью специальных затравок восстанавливают недостающую вторую нить ДНК. При этом синтез второй нити осуществляется не полностью, а с помощью специального приема обеспечивается прекращение синтеза строго на одном из 4 нуклеотидов. В результате этого получался набор цепей ДНК с разной длиной — «лесенка». Эта «лесенка» становится видимой глазом после разделения всех фрагментов по размерам за счет того, что концы всех фрагментов содержат специфическую — или радиоактивную, или флуоресцентную метку. Следует отметить, что в разработку этого поистине революционизирующего метода существенный вклад был сделан и двумя российскими учеными: профессором С. К. Василенко и академиком Е. Д. Свердловым.
За разработку методов секвенирования Гилберт и Сэнгер получили Нобелевскую премию. Интересно, что для Сэнгера эта была уже вторая премия, первую он получил за расшифровку аминокислотной последовательности первого белка — инсулина.
Все автоматы-секвенаторы, которые появились позднее, были построены по принципу метода Сэнгера, поскольку он оказался более удобным для автоматизации процесса и компьютерной регистрации результатов. В настоящее время ряд крупных фирм занимается производством таких автоматов, а также стандартных наборов реактивов для анализа ДНК. Секвенирование стало достаточно рутинной лаборантской работой. А метод Максама–Гилберта имеет сейчас скорее историческое, чем практическое значение.
Во всех случаях основное правило заключается в том, чтобы в препарате ДНК, который собираются секвенировать, все фрагменты имели, по крайней мере, один одинаковый конец, т. е. одну точку отсчета. В этот фиксированный конец вводят радиоактивную (или флуоресцентную) метку. После этого проводят дальнейшие специфические расщепления молекул с помощью ферментов или химических агентов по строго определенным азотистым основаниям. Условия расщепления при этом таковы, что на каждый меченый фрагмент в среднем приходится один разрыв. В результате после расщепления образуется набор фрагментов разной длины, каждый из которых начинается в точке отсчета, а заканчивается на или перед определенным типом нуклеотида.
Полученные фрагменты разделяют по размерам с помощью электорофореза в гелях. Маленькие фрагменты движутся быстрее более крупных, и в результате такой процедуры все фрагменты выстраиваются друг за другом в зависимости от своей длины. Результат такого разделения изображен схематически на рис. 15.

Рис. 15. Схема, поясняющая процесс подготовки и прочтения ДНКового текста
Так осуществляют секвенирование небольших фрагментов ДНК (не более 1000 нуклеотидов). Но геномы даже самых примитивных организмов имеют размер свыше 500 000 п. н. Как же их секвенируют? Для этого разработано несколько стратегий. Не будем вдаваться в подробности, но укажем на некоторые основные из них.
Секвенирование простых геномов
Для определения нуклеотидной последовательности (т. е. первичной структуры) конкретного района ДНК в первую очередь необходимо упростить ее, что достигается путем разрезания ее на относительно короткие фрагменты. Сделать это можно, например, с помощью специальных «скальпелей» для ДНК — ферментов рестриктаз, о которых уже шла речь выше.
При секвенировании простейших организмов, у которых геном относительно невелик, обычно используют процедуру, называемую условно «сверху вниз». Всю ДНК «разрезают» на кусочки с помощью уже упоминавшихся выше ферментов рестриктаз, затем секвенируют эти кусочки по отдельности, а после «склеивают» из них полный геном. «Склеивание» оригинала осуществляется за счет того, что нуклеотидные последовательности разных кусочков перекрываются друг с другом, т. е. одинаковы по концам. Эта методология получила название «дробовика». Суть данной процедуры отражена на рис. 16.

Рис. 16. Схема стратегии «дробовика», используемая для секвенирования больших молекул ДНК
Однако в случае такого очень сложного генома, как геном человека, начали с другого, а именно с определения положения известных генов и других генетических маркеров на отдельных хромосомах, то есть с генетического картирования генома. Подобную задачу генетическими экспериментами на более простых объектах пытался решить еще Т. Морган, который за свои работы получил Нобелевскую премию в 1933 году. Теперь появились более эффективные методы. Один из них, называемый методом «радиационных гибридов», заключается в следующем. Клетки человека, растущие вне организма в питательной среде, облучают рентгеном, что приводит к гибели клеток в результате разрыва хромосомной ДНК на куски, содержащие от 2,5 до 25 млн. п. н. Но прежде, чем убитые облучением клетки распадутся, их сливают с клетками хомяка, в результате чего в разные клетки хомячка попадают разные наборы фрагментов ДНК человека. Затем «гибридные» клетки размножают в культуре, при этом в них наряду с собственной ДНК реплицируются и фрагменты чужеродной ДНК. Затем определяют состав известных генов и других генетических маркеров в каждой клеточной линии и, статистически обработав полученные данные, выводят наиболее вероятное их взаимное расположение в хромосомах. В качестве генетических маркеров использовали как гены, так и фрагменты ДНК с неизвестной функцией. Для картирования хромосом важным свойством маркеров являлся их полиморфизм, т. е. существование разных форм среди индивидуумов.
Так были построены первые генетические карты генома человека, на которых первоначально были отмечены различные генетические маркеры, отстоящие друг от друга на расстоянии не более 2 миллионов нуклеотидных пар (млн. н. п.).
Затем были составлены физические карты хромосом: первоначально с разрешением 0,1 млн. н. п., а затем 0,001 млн. н. п. Для этой цели на первом этапе применяли методы окрашивания хромосом и гибридизации с хромосомами in situ. И лишь позднее использовали рестриктазы. С помощью этих удивительно точно работающих ферментов «дробили» ДНК по строго определенным участкам на миллионы перекрывающихся между собой по нуклеотидной последовательности фрагментов, «разбирали» каждый из них по отдельности, после чего из них «склеивали» оригинал. «Склеивание» проводили на основании перекрывания фрагментов по нуклеотидной последовательности. Так постепенно шли все выше и выше. Поэтому данная стратегия получила название «снизу вверх». Со всей очевидностью можно сказать, что решалась грандиозная по масштабам и сложности задача. И решить ее ученые смогли только с помощью суперкомпьютеров. В результате были созданы физические карты разных областей ДНК и целых хромосом, состоящие из последовательно перекрывающихся друг с другом фрагментов. Набор таких «родственных» фрагментов получил название контиг (рис. 16).
А далее наступила очередь секвенирования отдельных рестрикционных фрагментов. Это привело в конечном итоге к построению секвенсовых карт, на которых степень разрешения была доведена до своего максимального значения. Если 20 лет назад расшифровка нуклеотидной последовательности ДНК длиной 1000 п. н. считалась большим научным достижением (за это можно было сразу получить степень доктора наук), то уже к 1990 году секвенирование ДНК стало массовой технологией. А сейчас квалифицированный лаборант проделывает такую работу всего за несколько часов.
После появления эффективных методов секвенирования ДНК и нескольких стратегий использования этого метода стал стремительно нарастать вал расшифрованных нуклеотидных последовательностей, в первую очередь таких простых организмов, как вирусы, а также отдельных клонированных фрагментов ДНК различных видов высших организмов. Так, еще в конце 1970-х годов была расшифрована структура первого живого объекта — вируса бактерий — бактериофага, обозначаемого как ?? 174, имеющего длину 5386 п. н. Затем последовала очередь других.
В конце 80-х гг. были начаты крупные международные проекты, целью которых было полное секвенирование геномов бактерий, грибов, дрожжей, дрозофилы, мыши, пшеницы, человека и др. Первоначально была определена первичная структура ДНК микроорганизмов с размерами генома до 20 млн. п. н., к концу 1998 г. их число составило уже 18 (см. табл. 2). Наименьший размер генома у свободно живущих организмов (например, у бактерии Mycoplasma genitalium) составляет лишь около 600 000 п. н. У этой бактерии содержится всего 500 генов, причем 150 из них (если их удалять по одиночке) никак не влияют на её жизнеспособность. Так возникло предположение, что элементарная «машина жизни» теоретически должна работать при наличии всего лишь 350 генов.
Первые объекты для секвенирования были выбраны неслучайно. Большинство из этих микроорганизмов (архебактерии, спирохеты, хламидобактерии, кишечная палочка, возбудители пневмоний, сифилиса, гемофилии, метанобразующие бактерии, микоплазмы, риккетсии, цианобактерии) способны вызывать различные патологии у человека. В настоящее время многие из этих проектов уже завершены; исследовано свыше 800 полных клеточных геномов микоплазм, архебактерий, кишечной палочки, возбудителей ряда болезней человека, а также пекарских дрожжей, маленького червя-нематоды, дрозофилы и весьма интересного в практическом плане растения арабидопсиса. Весьма вероятно, что истинное число секвенированных к настоящему времени геномов гораздо больше, потому что многие фармацевтические фирмы засекречивают свои результаты, не публикуя их в открытой печати.
Таблица 2. Некоторые микроорганизмы, геномы которых полностью секвенированы к настоящему времени

ТАЙНА ТАЙН ЗА 6 МИЛЛИАРДОВ ДОЛЛАРОВ
Лучше изучить лишнее, чем ничего не изучить.
Сенека Старший
Кто хочет много знать,
тому надо мало спать.
Русская пословица
И вот дошла очередь до расшифровки сокровеннейшей тайны человека — ДНКового текста его генома, который некоторые называют Книгой жизни или Энциклопедией человека.
Напомним еще раз, как все это начиналось и происходило. В 1988 году был создан проект «Геном человека» Национального института здоровья США. Главой работ по полному секвенированию генома человека стал нобелевский лауреат Джеймс Уотсон. Одновременно в России с этой же идеей выступил академик А. А. Баев. Государственная программа «Геном человека» была принята в этом же году в Советском Союзе. Позднее к программе подключились другие страны, и широкомасштабные координированные исследования стали проводиться под эгидой международной организации Human Genom Organisation (HUGO). На работу по секвенированию генома человека, осуществленную этим мировым консорциумом, было потрачено в сумме более 3 миллиардов долларов. В России членами этой организации являются сегодня около 80 российских ученых (председатель Российского совета по геному человека — академик Л. Л. Киселев). Из 24-х хромосом генома человека ученые России в основном концентрировались на 3-й, 13-й и 19-й хромосомах. При этом непосредственно секвенированием ДНК они занимались очень мало, основное внимание было обращено на структурно-функциональные исследования генома. В материальном отношении наш вклад был настолько скромен, что сейчас при общих подсчетах его вообще не учитывают.
Первоначально огромный объем предстоящей работы очень пугал многих исследователей. И действительно ситуация на первых этапах не была слишком обнадеживающей. В первые 2 года работы проекта «Геном человека» скорости секвенирования были еще очень низкими. Для полного завершения работы такими темпами потребовалось бы около 100 лет. Это удручало одних исследователей, но не останавливало других. Последним стало очевидно, что решение данной задачи невыполнимо традиционными методами и необходим поиск новых подходов и технологий расшифровки нуклеотидных последовательностей фрагментов ДНК, а также создание новой вычислительной техники и оригинальных компьютерных программ. Все это, конечно, было невыполнимо в рамках отдельно взятого государства. По этой причине к проекту были привлечены около 20 различных стран, организован международный банк данных, куда поставлялась вся информация, полученная в процессе решения данной задачи. В результате технических новаций постепенно возрастала производительность аппаратуры, стали использовать промышленные роботы, многие процессы были автоматизированы. И вскоре скорость секвенирования достигла 10 млн. нуклеотидных пар в сутки! Теперь уже выполнение проекта стало реальностью. За 1995 г. длина участков ДНК человека с установленной последовательностью нуклеотидов увеличилась почти в 10 раз, но это составляло еще менее 0,001% от всего генома человека. К началу 1998 г. было секвенировано всего около 3% генома.
Примерно в это время к работе по секвенированию ДНК человека неожиданно присоединилась частная американская компания из штата Мериленд «Celera Genomics» под руководством Крега Вентера, которая объявила, что закончит свою работу на 4 года раньше международного консорциума. Это сильно подхлестнуло всех участников.
Следует отметить, что два конкурирующих коллектива — HUGO и Celera — использовали в своей работе разные подходы к секвенированию ДНК. Эту разницу можно сравнить с процессом создания подробной маршрутной карты. Можно описать подробнейшим образом каждую горку, каждую канавку, каждый бугорок. А можно описать весь путь, но при этом отметить только наиболее важные участки. Международный консорциум применил в своей работе традиционный метод, который заключался в том, что «кусочки» молекул ДНК выстраивали друг за другом: сначала делали карты хромосом, а потом по ним «прогуливались». Таким образом, ученые теряли время на подготовке материала, картировании, но выигрывали в секвенировании — не нужно было помногу раз делать одно и то же. Руководитель компании «Селера» Крег Вентер предложил ускоренный вариант, так называемый «шрапнельный» метод расшифровки структуры целого генома. Этот метод предусматривает разделение всего генома на небольшие фрагменты ДНК без предварительного их картирования, а затем расшифровку последовательностей с использованием высокопроизводительных автоматов и «сборку» фрагментов в нужном порядке с помощью суперкомпьютера с учетом соответствия перекрывающихся нуклеотидных последовательностей на концах фрагментов. Все это напоминает сборку гигантского неизвестного паззла по отдельным совершенно абстрактным его фрагментам. Метод, конечно, казался очень простым, но при этом одни и те же «кусочки» неизбежно попадали в аппарат-секвенатор по 10, а то и по 20 раз. «Celera», конечно же, теряла на том, что по многу раз секвенировала одни и те же фрагменты, поскольку до начала их секвенирования ничего о них не знала. Это казалось многим непроизводительной тратой средств и времени. Но в конечном итоге в результате использования своего подхода «Селера» сильно сэкономила время и деньги на предварительной подготовке материала, так как нужно было только раздробить ДНК на фрагменты и не заниматься трудоемким процессом их предварительного картирования. Кроме того, «Селера» почти с самого начала использовала специальный робот, который способен автоматически расшифровывать ДНК. Этот робот обладал способностью метить разные «буквы» ДНКового текста различными флюоресцирующими красками, а затем с помощью лазера считывать последовательности цветов, как последовательность букв. Огромный объем информации обрабатывался с помощью уникального суперкомпьютера. Celera по-латински обозначает «быстрая». И компания оправдала свое название. Еще в 1995-м году на основе предложенного Вентером подхода было осуществлено секвенирование генома бактерии Haemophilus influenzae. А когда «Селера» приступила к секвенированию генома человека, то и здесь добилась большого успеха, быстро встав по числу секвенированных нуклеотидных последовательностей генома человека вровень с международным консорциумом.
Началась беспримерная в науке гонка. Два коллектива работали независимо, не жалея сил, чтобы придти к финишу первыми. Технология все время совершенствовалась. В результате жесткой конкуренции была создана, можно сказать, новая индустрия по секвенированию ДНК. В Англии, США, Франции, Германии, Японии появились гигантские автоматизированные фабрики — геномотроны, — секвенирующие по несколько миллионов нуклеотидов в неделю.
И вот произошло долгожданное событие: в декабрьском номере журнала Nature за 1999 год появилась статья под названием «Нуклеотидные последовательности первой хромосомы человека». В этой статье коллектив, состоящий из более чем двухсот авторов, сообщил о полном секвенировании одной из самых малых хромосом человека — хромосомы под номером 22. Выход этой статьи окончательно подтвердил тот факт, что проект «Геном человека» будет выполнен. Произошедшее событие некоторые ученые сравнили с первым взглядом на ландшафт новой планеты.
Между разными участниками гонки, призом в которой была полная последовательность нуклеотидов генома человека, с самого начала возникло еще одно существенное противоречие. Суть его заключалась в том, что Вентер и его компания «Селера» настаивали на праве индивидуального владения всеми данными, полученными при установлении последовательности нуклеотидов, и возможности получать коммерческую выгоду от всех видов использования этих материалов. Руководители международного проекта считали, что результаты расшифровки генома должны быть доступны всем ученым и использоваться ими без всяких ограничений. Спор достиг такого накала, что в это вынуждены были вмешаться даже главы разных правительств. Весной 2000 года президент США Билл Клинтон и британский премьер-министр Тони Блэр выступили с совместным заявлением, в котором поддержали позицию руководителей международного проекта «Геном человека». В конечном итоге консенсус был достигнут, и в июне 2000 года два конкурирующих коллектива — «Celera Genomics» и международный консорциум, — объединив свои данные, официально объявили о том, что их совместными усилиями в целом завершено секвенирование генома человека, создан его черновой вариант.
Проект «Геном человека» оказался одним из наиболее дерзновенных, дорогостоящих и потенциально важных проектов в истории науки. Согласно первоначальным расчетам, работа по расшифровке генома человека должна была окончиться в 2005-м году и стоить в общей сложности 3 миллиарда долларов. Но жизнь внесла свои существенные поправки, и в конечном итоге проект реализовался на 5 лет быстрее, но на его реализацию потребовалось уже примерно 6 миллиардов долларов, т. е. чуть меньше чем по 2 доллара за каждую пару нуклеотидов. Дополнительные 3 миллиарда долларов были добавлены частным капиталом присоединившейся позднее компании Celera Genomics. Научные публикации чернового варианта структуры генома человека появились в феврале 2001 года. Качество секвенирования достаточно высокое и предполагает в среднем наличие только одного ошибочно определенного нуклеотида на протяжении более 50 тыс. п. н.
Итак, на сегодняшний день в основном геном человека секвенирован, т. е. определен порядок расположения нуклеотидов во всех молекулах ДНК на всех хромосомах. Текст этот огромен. По последним данным он состоит из 3,2 миллиардов «букв». Вся эта информация теперь содержится в сверхмощных компьютерах (книга с этим текстом не издана и едва ли будет издана когда-либо). Вокруг этого события сразу же поднялся невероятный шум и ажиотаж. Но только специалисты понимали до конца и тот огромный успех, который был достигнут в результате реализации первого этапа программы, и сверхтрудность тех задач, которые еще предстоит решить человечеству до достижения конечной цели. Важно понимать, что все произошедшее не означает автоматически, что геном человека расшифрован, что мы можем уже этот текст читать как любую другую книгу без всяких проблем. Секвенирование (определение последовательностей нуклеотидов) не приводит автоматически к пониманию того, что написано (т. е. собственно говоря, к расшифровке). С имеющимся текстом предстоит еще очень долго разбираться, в частности, правильно расставить знаки пунктуации, выверить опечатки и др. Где-то они уже намечены, а где-то еще предстоит их проставить. Расшифровать нуклеотидную последовательность — это все равно, что читать книгу, просто произнося названия букв подряд. Найти ген значит понять, как буквы складываются в слова. Но нужно еще понять и смысл фразы. И это теперь основная проблема. Кроме того, следует еще добавить, что ДНКовый текст написан на «мертвом» языке, в расшифровке которого науке помочь попросту некому — надеяться нужно только на себя. Как воображение кошки во дворце английской королевы не поднялось выше мышки, так, вероятно, обстоит дело и с нашим сегодняшним пониманием генома. Все богатство этой Энциклопедии нам еще предстоит осознать.
У читателя может возникнуть вполне естественный вопрос: геном какого же человека определен в результате этих титанических усилий, кто этот конкретный человек? Четкого ответа пока нет, но ясно, что это не один человек, а, по крайней мере, 7–10 различных людей. Согласно имеющимся данным, фирма Celera в основном ориентировалась на геном одного человека, о котором известно лишь, что это белый мужчина среднего возраста. Скорее всего, это был сам глава корпорации Крег Вентер, хотя другие источники утверждают, что Celera использовала 5 человек (3 мужчин и 2 женщины), относящихся к разным расам — афро-американской, монголоидной и европеоидной. Международный консорциум использовал в своей работе материал не менее семи различных людей. В любом случае каждый из двух соперничавших коллективов брал для анализа ДНК из своего источника. А в результате опубликована усредненная нуклеотидная последовательность одного человеческого генома.
На основании полученных данных мы сегодня имеем общую характеристику нуклеотидных последовательностей ДНК, образующих геном человека, которая не будет существенно пересмотрена в дальнейшем. Можно ожидать, что множество деталей еще будет уточняться и меняться, но общая характеристика безусловно останется неизменной. Это сродни догмату папской непогрешимости: Roma locuta res finita est (Рим сказал свое слово, дело окончено).
Теперь вспомним основные этапы, по которым двигалась наука на пути к достижению полного секвенирования генома человека.
ОСНОВНЫЕ ВЕХИ ГЕНЕТИКИ И ГЕНОМИКИ
Inventas vitam juvat excoluisse per artes.
Изобретения улучшают жизнь, искусство украшает ее.
Надпись на нобелевской медали, фраза из «Энеиды» Вергилия
1865 год
Открытие Г. Менделем (1822–1884) факторов наследственности и разработка гибридологического метода, т. е. правил скрещивания организмов и учета признаков у их потомства.
1868 год
Ф. Мишер из спермы лосося выделил фосфорсодержащее вещество, происходящее из клеточных ядер, которое он назвал нуклеином (теперь его называют дезоксирибонуклеиновой кислотой).
1871 год
Ч. Дарвин публикует свою книгу «Происхождение человека и половой отбор».
1875 год
Ф. Гальтон демонстрирует возможность использования близнецов для изучения относительного влияния на организм наследственности и окружающей среды.
1900 год
Формальное рождение генетики как науки. Независимая публикация статей Г. де Фриза, К. Корренса и Э. Чермака с изложением основных законов наследования. «Переоткрыты» и стали известны широкой научной общественности исследования Г. Менделя.
1902 год
В. Саттон и Т. Бовери независимо создают хромосомную теорию наследственности.
1905 год
У. Бэтсон предлагает слово «генетика» (от греч. ???????? — порождать) для нового направления науки.
1910 год
Т. Г. Морганом установлено, что гены расположены в хромосомах в линейном порядке, образуя группы сцепления. Морган установил также закономерности наследования признаков, сцепленных с полом (Нобелевская премия 1933 г. по физиологии и медицине за экспериментальное обоснование хромосомной теории наследственности).
А. Кёссель получил Нобелевскую премию по химии за установление того, что в состав ДНК входят четыре азотистых основания: аденин, гуанин, цитозин и тимин.
1922 год
Н. И. Вавилов сформулировал «закон гомологических рядов» — о параллелизме в изменчивости родственных групп растений, то есть о генетической близости этих групп. Закон Вавилова установил определенные правила формообразования и позволил предсказывать у данного вида еще не открытые, но возможные признаки (аналогия с системой Менделеева).
1925 год
Г. А. Надсон, Г. С. Филиппов, Г. Мюллер проводят первый цикл работ по радиационным методам индукции мутаций.
1926 год
С. С. Четвериков написал статью, заложившую основы популяционной генетики и синтеза генетики и теории эволюции.
1927 год
Г. Мюллер доказал мутационный эффект рентгеновских лучей, за что в 1946 г. получил Нобелевскую премию в области физиологии и медицины.
Н. К. Кольцов выдвинул идею матричного синтеза, которая и сегодня отвечает современным представлениям биологов: «В основе каждой хромосомы лежит тончайшая нить, которая представляет собой спиральный ряд огромных органических молекул — генов. Возможно, вся эта спираль является одной гигантской длины молекулой».
1928 год
Открытие явления трансформации у бактерий (Ф. Гриффит).
1929–1930 годы
А. С. Серебровский и Н. П. Дубинин впервые продемонстрировали сложную природу организации гена; первые реальные шаги на пути создания современного представления о тонкой структуре гена.
1931 год
Барбара Мак-Клинток продемонстрировала наличие кроссинговера.
1934 год
Н. П. Дубинин и Б. Н. Сидоров открыли особый тип эффекта положения.
Б. Л. Астауров осуществил успешные опыты по получению у шелкопряда потомства из неоплодотворенных яиц (одно из самых интересных достижений в прикладной генетике того времени).
1935 год
Н. В. Тимофеев-Ресовский, К. Г. Циммер, М. Дельбрюк осуществили экспериментальное определение размеров гена. Ими дана трактовка гена с позиций квантовой механики, тем самым был создан фундамент для открытия структуры ДНК.
1940 год
Дж. Бидл и Э. Татум сформулировали теорию «один ген — один фермент». (Нобелевская премия по физиологии и медицине за 1958 г.).
1943 год
И. А. Рапопорт, Ш. Ауэрбах и Дж. Г. Робсон впервые показали индукцию мутаций химическими веществами.
1944 год
О. Эвери, К. Маклеод и М. Маккарти установили, что «веществом гена» служит ДНК. Начало «эры ДНК».
М. Дельбрюк, С. Лурия, А. Херши произвели пионерские исследования по генетике кишечной палочки и ее фагов, после чего эти объекты стали модельными для генетических исследований на многие десятилетия. (Нобелевская премия по физиологии и медицине за 1969 год за открытие цикла репродукции вирусов и развитие генетики бактерий и вирусов).
Л. А. Зильбер сформулировал вирусно-генетическую теорию рака.
1950 год
Э. Чаргафф сформулировал знаменитое «правило Чаргаффа», которое гласит: в ДНК число нуклеотидов А равно числу Т, а число Г — числу Ц.
Б. Мак-Клинток показала существование перемещающихся генетических элементов. С большим опозданием (только в 1983 г.) она получила за это Нобелевскую премию в области физиологии и медицины.
1951 год
Р. Франклин и М. Уилкинсон получили первую рентгеннограмму молекулы ДНК.
1953 год
Ф. Крик и Дж. Уотсон, опираясь на результаты опытов генетиков и биохимиков и на данные рентгеноструктурного анализа, создали структурную модель ДНК в форме двойной спирали. В 1962 году им совместно с М. X. Ф. Уилкинсом присуждена Нобелевская премия по физиологии и медицине.
1956 год
Ю. Тио и A. Леван установили, что диплоидный набор хромосом у человека равен 46.
А. Корнберн обнаружил первый фермент, способный синтезировать ДНК в пробирке — ДНК-полимеразу I. В 1959 году он совместно с С. Очоа получил Нобелевскую премию по физиологии и медицине за исследование механизма биологического синтеза РНК и ДНК.
1958 год
М. Мезельсон и Ф. Сталь доказали полуконсервативный механизм репликации ДНК.
1960 год
Открытие РНК-полимеразы С. Б. Вейсом, Дж. Гурвицем и А. Стивенсом.
И. А. Рапопорт сообщил об открытии «супермутагенов».
1961 год
В работах М. У. Ниренберга, Р. У. Холли и X. Г. Кораны начата расшифровка «языка жизни» — кода, которым в ДНК записана информация о структуре белковых молекул. В 1968 году все трое разделили Нобелевскую премию по физиологии и медицине, которая была присуждена им «за расшифровку генетического кода и его функционирования в синтезе белков».
Ф. Жакоб и Ж. Моно пришли к выводу о существовании двух групп генов — структурных, отвечающих за синтез специфических (ферментных) белков, и регуляторных, осуществляющих контроль за активностью структурных генов. В 1965 г. Нобелевская премия по физиологии и медицине присуждена А. М. Львову, Ф. Жакобу и Ж. Моно за открытие генетической регуляции синтеза ферментов и вирусов.
1962 год
Дж. Гёрдон осуществил первое клонирование животного организма (лягушка).
Дж. Кэндрью и М. Перутц были удостоены Нобелевской премии по химии за впервые осуществленную расшифровку трехмерной структуры белков миоглобина и гемоглобина.
1965 год
Р. Б. Хесин показал, что регуляция синтеза белка осуществляется путем включения и выключения транскрипции генов.
1966 год
Б. Вейс и С. Рихардсон открывают фермент ДНК-лигазу.
1969 год
Х. Г. Корана синтезировал химическим путем первый ген.
1970 год
Открытие обратной транскриптазы, фермента, синтезирующего ДНК с использованием комплементарной РНК в качестве матрицы. Это было сделано будущими Нобелевскими лауреатами по физиологии и медицине (1975) Г. Теминым и Д. Балтимором.
Выделена первая рестриктаза — фермент, разрезающий ДНК в строго определенных местах. За это открытие в 1978 году Нобелевская премия по физиологии и медицине была присуждена Д. Натансу, Х. Смиту и В. Арберу.
1972 год
В лаборатории Пола Берга получены первые рекомбинантные ДНК (Нобелевская премия по химии за 1980 г. вручена П. Бергу и Г. Бойеру). Заложены основы генной инженерии.
1973 год
С. Коэн и Г. Бойер разработали стратегию переноса генов в бактериальную клетку.
1974 год
С. Милстайн и Г. Келер создали технологию получения моноклональных антител. Ровно десять лет спустя они (вместе с Н. К. Ерне) получили за это Нобелевскую премию по физиологии и медицине.
Р. Д. Корнберг описывает структуру хроматина (нуклеосомы).
1975 год
С. Тонегава показал различное расположение генов, кодирующих вариабельную и константную часть иммуноглобулинов, в ДНК эмбриональных и миелоидных клеток, что дало основание для вывода о перегруппировках генов иммуноглобулинов при образовании клеток иммунной системы (Нобелевская премия по физиологии и медицине в 1987 г.).
Осуществлено первое клонирование кДНК.
Е. Саузерн описал метод переноса фрагментов ДНК на нитроцеллюлозные фильтры, метод получил название Саузерн-блот гибридизации.
1976 год
Открытие у животных (на примере дрозофилы) «прыгающих генов», сделанное Д. Хогнессом (США) и российскими учеными во главе с Г. П. Георгиевым и В. А. Гвоздевым.
Основана первая генно-инженерная компания (Genentech), использующая технологию рекомбинантных ДНК для производства различных ферментов и лекарственных средств.
Д. М. Бишоп и Г. Э. Вармус сообщили, что онкоген в вирусе представляет собою не истинный вирусный ген, а клеточный ген, который вирус «подхватил» когда–то давно в ходе репликации в клетках и теперь сохраняет в измененном мутациями виде. Было также показано, что его предшественник, клеточный протоонкоген, в здоровой клетке играет важнейшую роль — управляет ее ростом и делением. В 1989 г. оба этих ученых получили Нобелевскую премию по физиологии и медицине за фундаментальные исследование канцерогенных генов опухоли.
1977 год
Опубликованы быстрые методы определения (секвенирования) длинных нуклеотидных последовательностей ДНК (У. Гилберт и А. Максам; Ф. Сенгер с соавт.). Появилось реальное средство анализа структуры генов как основа для понимания их функций. В 1980 году У. Гильберт и Ф. Сенгер совместно с П. Бергом получили Нобелевскую премию по химии «за существенный вклад в установление первичной структуры ДНК; за фундаментальные исследования биохимических свойств нуклеиновых кислот, в том числе рекомбинантных ДНК».
Полностью секвенирован геном бактериофага ??174 (5386 п. н.).
Секвенирован первый ген человека — ген, кодирующий белок хорионный соматомаммотропин.
П. Шарп и Р. Робертс показали, что гены у аденовирусов (позднее выяснилось, что и у эукариотических организмов) имеют мозаичную экзонинтронную структуру, и открыли явление сплайсинга (Нобелевская премия по физиологии и медицине в 1993 г.).
К. Итакура с соавт. синтезируют химически ген соматостатина человека и осуществляет искусственный синтез гормона соматостатина в клетках кишечной палочки E. coli.
1978 год
Компания Genentech осуществила перенос эукариотического гена инсулина в бактериальную клетку, где на нем синтезирован белок — проинсулин.
Определена полная последовательность нуклеотидов ДНК вируса SV40 и фага fd.
1979 год
Показано, что химически трансформированные клетки содержат активированный онкоген BAS.
1980 год
Дж. Гордоном с соавт. получена первая трансгенная мышь. В про-нуклеус оплодотворенного одноклеточного эмбриона микроинъекцией введен ген тимидин-киназы вируса простого герпеса и показано, что этот ген работает во всех соматических клетках мыши. С тех пор трансгеноз стал основным подходом как для фундаментальных исследований, так и для решения практических задач сельского хозяйства и медицины.
1981 год
Определена полная нуклеотидная последовательность митохондриальной ДНК человека.
Несколько независимых исследовательских групп сообщили об открытии человеческих онкогенов.
1982 год
Определена полная нуклеотидная последовательность бактериофага ? (48502 п. н.).
Показано, что РНК может обладать каталитическими свойствами, как и белок.
1983 год
С помощью биоинформатики найдена гомология фактора роста PDGF с известным онкобелком, кодируемым онкогеном SIS.
Показано, что разные онкогены кооперируют при опухолевой трансформации клеток.
Ген болезни Хантигтона локализован на хромосоме 4 человека.
1984 год
У. Мак-Гиннис открыл гомеотические (Hox) регуляторные гены, ответственные за построение общего плана тела животных.
А. Джеффрис создает метод геномной дактилоскопии, в котором нуклеотидные последовательности ДНК используются для идентификации личности.
1985 год
Создание К. Б. Мюллисом революционизирующей технологии — полимеразной цепной реакции, ПЦР — наиболее чувствительного до сих пор метода детектирования ДНК. Эта технология получила широкое распространение (Нобелевская премия по химии за 1993 г.).
Клонирование и определение нуклеотидной последовательности ДНК, выделенной из древней египетской мумии.
1986 год
Клонирование гена RB – первого антионкогена — супрессора опухолей. Начало эпохи массированного клонирования генов опухолеобразования.
1987 год
Созданы первые дрожжевые искусственные хромосомы — YAC (Yeast Artificial Chromosomes). Они сыграют большую роль как векторы для клонирования больших фрагментов геномов.
1988 год
Создание международного проекта «Геном человека», поставившего своей целью полное секвенирование ДНК человека.
Под эгидой Комитета по науке и технике в СССР начала работу программа «Геном человека», которую возглавил Научный совет по геномной программе во главе с академиком А. А. Баевым.
Показана возможность анализа митохондриальной ДНК из очень древних образцов при исследовании мозга человека давностью 7000 лет.
Предложен метод «нокаута» генов.
1989 год
Т. Р. Чех и С. Альтман получили Нобелевскую премию по химии за открытие каталитических свойств некоторых природных РНК (рибозимов).
1990 год
Создана Международная организация по изучению генома человека (HUGO), вице-президентом которой в течение нескольких лет был российский академик А. Д. Мирзабеков.
Ф. Коллинз и Л.-Ч. Тсуи идентифицировали первый ген человека (CFTR), ответственный за наследственное заболевание (кистозный фиброз), который расположен на хромосоме 7.
В. Андерсоном осуществлено первое успешное применение генной терапии для лечения больной с наследственным иммунодефицитом.
Определена полная последовательность генома вируса осповакцины (192 т. п. н.).
1992 год
Э. Кребсу и Э. Фишеру присуждена Нобелевская премия по физиологии и медицине за открытие обратимого фосфорилирования белков как важного регулирующего механизма клеточного метаболизма.
1995 год
Определена полная последовательность генома первого самостоятельно существующего организма — бактерии Haemophilus influenzae (1 830 137 п. н.). Становление геномики как самостоятельного раздела генетики.
1997 год
Определена полная последовательность нуклеотидов геномов кишечной палочки E. coli и дрожжей Saccharomyces cerevisiae.
Нобелевская премия по физиологии и медицине присуждена американцу С. Прузинеру за вклад в изучение болезнетворного агента белковой природы, приона, вызывающего губчатую энцефалопатию, или «коровье бешенство» у крупного рогатого скота.
Я. Вильмут с сотрудниками впервые клонировали млекопитающее — овцу Долли.
1998 год
Определена полная нуклеотидная последовательность первого высшего организма — нематоды Caenorhabditis elegans.
У нематоды C. elegans обнаружен механизм РНК-интерференции.
1999 год
Полностью секвенирована ДНК хромосомы 22 человека.
Роберт Фурчготт, Луис Игнарро и Ферид Мурад получили Нобелевскую премию за открытие роли оксида азота в качестве сигнальной молекулы (то есть, регулятора и переносчика сигналов) сердечно-сосудистой системы.
Клонировали мышь и корову.
2000 год
Вчерне завершено полное секвенирование генома человека и дрозофилы.
Нобелевская премия по физиологии и медицине присуждена А. Карлссону, П. Грингарду и Э. Кенделу за открытие, касающееся «передачи сигналов в нервной системе».
Клонировали свинью.
2001 год
Нобелевская премия по физиологии и медицине присуждена Л. Хартвеллу, Т. Ханту и П. Нерсу за открытие ключевых регуляторов клеточного цикла.
2002 год
Полностью секвенирован геном мыши.
Нобелевская премия по физиологии и медицине присуждена С. Бреннеру, Р. Хорвитцу и Дж. Салстону за их открытия в области генетического регулирования развития органов и запрограммированной клеточной смерти.
ГЕНЫ — ОСНОВНОЙ ТЕКСТ ГЕНОМА
Гены — это атомы наследственности.
С. Бензер
Орлы летают одиноко, бараны пасутся стадами.
Ф. Сидни
Необходимо отметить, что термин «ген» многие, даже неспециалисты, воспринимают легко без всякого специального пояснения. Слишком много и давно об этом говорят и довольно часто используют этот термин в разных ситуациях. И всем вроде бы все ясно: ген — это участок ДНК, который кодирует определенный белок. Согласно центральной догме молекулярной биологии, информация, записанная в ДНК с помощью четырехбуквенного нуклеотидного алфавита, переводится простым механическим способом на другой, аминокислотный, алфавит из 20 букв, которым записывается строение белковых молекул. «Один ген — один белок» — вот каким был многие годы основополагающий тезис молекулярных генетиков. Для того, чтобы ген правильно работал, необходимы специальные знаки, обозначающие начало и конец инструкции для синтеза сначала мРНК, а потом белка. Для того, чтобы началась считывание (транскрипция) гена, в первую очередь необходим структурный элемент, получивший название промотора (старт-сигнал транскрипции). Для окончания транскрипции существует другой специальный сигнал. Обязательными элементами гена являются также сигналы, определяющие начало и конец трансляции мРНК на рибосомах. Все эти старт- и стоп-сигналы записаны в ДНК с помощью того же самого четырехбуквенного алфавита, что и информация для построения молекулы белка. Между двумя такими знаками препинания записаны инструкции для синтеза белка. В таком упрощенном виде ген определяют как последовательность нуклеотидов, расположенных между старт-сигналом и стоп-сигналом и кодирующих одну белковую цепь (полипептид). Однако на самом деле все обстоит намного сложнее. Кроме генов, кодирующих белки, существуют гены, кодирующие РНК, которые выполняют в клетке только структурную роль и не транслируются. Более того, в последние годы было обнаружено большое число ранее неизвестных РНК, которые выполняют в клетке специальные регуляторные функции. Обо всем этом мы поговорим далее. Современное понимание того, что же из себя представляет ген, складывалось на протяжении всех этих долгих лет, наполняясь постепенно конкретным и обобщенным содержанием, преодолевая сомнения, заблуждения и неожиданные повороты. В результате на сегодняшний день трудно дать однозначное определение термину «ген», хотя вроде бы этот вопрос в общем виде был решен Менделем почти 140 лет назад.
Конечно же, в секвенированном ДНКовом тексте генома человека в первую очередь внимание ученых было обращено на участки, кодирующие белки, то есть на белок-кодирующие гены. Отметим, что первый ген человека — ген, кодирующий белок со сложным названием хорионный соматомаммотропин, — был секвенирован еще в 1977 году. А что же выяснилось в результате секвенирования всего генома человека? Оказалось, что в геноме человека нуклеотидные последовательности, кодирующие белки (экзоны), занимают лишь 1,1–1,4% от длины всех молекул ДНК. Но именно эти мизерные проценты ДНКового текста человека и стали объектом пристального внимания. Для сравнения отметим, что у червя C. elegans доля таких последовательностей в геноме составляет 27%, у мухи дрозофилы — 20%, у дрожжей — 70%, а у бактерий — 86%. То есть, просматривается закономерность: по мере усложнения организмов доля кодирующих белки участков ДНК в их геномах резко падает.
Генам при их открытии, как людям при рождении, сразу же присваивают различные имена. Без этого невозможно было бы разобраться, о чем идет речь и что изучают разные ученые в каждом конкретном случае. Правда, путаница в этом вопросе пока еще существует, особенно если ген одновременно открывают в разных лабораториях и при этом называют по-разному. Известно, что в лингвистике существует целая наука об именах людей — ономастика. Эта наука давно уже отметила влияние разных факторов и причин на формирование имен, связь с историей, географией и многими другими науками, а также процессами, протекающими в обществе. Так, в постреволюционные годы появились имена Вилен (В. И. Ленин), Даздраперма (Да здравствует первое мая), при Б. Ельцине появились Борели, а при В. Путине уже официально зарегистрированы такие имена, как Путилла, Владпут и даже Затерсор (замочим террористов в сортире).
Конечно, и на имена, присваиваемые генам, также влияют разные обстоятельства. Но вообще-то этот процесс довольно стихийный. Нередко наименование гена связывают с выполняемой им функцией (например, дистрофин — ген, мутации в котором ответственны за дистрофию мышц). В других случаях используют особенности структуры гена (например, присутствие специфической последовательности в гене, называемой homeo box, автоматически приводит к имени Hox). Иногда авторы напрягают свою фантазию, и тогда появляются такие экзотические имена, как харакири (ген-самоубийца), икарус, vang (по имени художника ван Гога) или indy (первые буквы от слов I'm not dead yet — я еще не умер — название для гена, который влияет на продолжительность жизни). Ген SHH назван в честь популярной видеоигры Соника Хеджхога, (англ. hedgehog — ежик). Некоторые гены называются именами богов (например, гефестин — от греческого бога огня и кузнечного дела Гефеста). На практике генетики используют сокращенные обозначения генов, состоящие обычно из 3–5 латинских букв. Поскольку функции многих генов еще не известны, а удается только определить, что какая-то конкретная область генома человека способна теоретически кодировать белок, то часто пока еще перед названиями генов появляется слово «гипотетический».
Анализ генома человека позволил на конец 2002 года обнаружить порядка 30 000–40 000 генов, кодирующих белки. Эти гены сильно отличаются друг от друга по размерам. Подсчитано, что средняя длина гена у человека составляет около 27 тыс. п. н. Такой усредненный ген содержит 9 экзонов (средний размер каждого около 150 п. н.) и 8 интронов (средний размер каждого чуть меньше 3400 п.н.). Но это лишь средние значения. Самые короткие гены содержат всего два десятка букв-нуклеотидов, например, гены эндорфинов — полипептидов, вызывающих ощущение удовольствия. В то же время самый длинный ген, кодирующий один из белков мышц, — миодистрофин содержит 2,4 млн. п. н.
Кроме того, гены не равномерно распределены между разными хромосомами. При средней плотности один ген на 100 т. п. н. генома их содержание в хромосоме 19 составляет около 2 на 100 т. п.н., а в хромосомах 2, 13 и Y-хромосоме — от 0,15 до 0,7. Если сравнить плотность генов с плотностью расселения людей, то Y-хромосома напоминает нашу Сибирь, а хромосома 19 — Европейскую часть России. Для сравнения: в геноме бактерий содержится свыше 1000 генов на 1,0 млн. п. н., у дрожжей около 450 генов на 1,0 млн. п. н., а у червя C. elegans — около 200. Следовательно, плотность расположения генов на единицу длины генома заметно падает по мере эволюционного усложнения организмов.
«Жи, ши — пиши через и»
После секвенирования генома человека и ряда других организмов был проведен детальный компьютерный анализ нуклеотидных последовательностей. Подсчитано, например, сколько в ДНК может идти подряд букв А, или как часто Г встречается после Ц. И тут выяснилось, что в генах эти сочетания подчиняются определенным правилам, тогда как в промежутках между генами, там, где ничего существенного в ДНК не записано, частота сочетаний разных нуклеотидов близка к случайной. Где много генов, там много букв Г и Ц, а где генов нет, там много букв А и Т. Здесь опять можно провести параллель с обычным текстом. По правилам грамматики русского языка, которые мы учили в школе, «жи, ши — пиши через и», в словах после букв ж и ш буква ы не встречается. Нечто подобное характерно и для генетических текстов — в кодирующих участках некоторые сочетания нуклеотидов практически не встречаются, а распределение других сочетаний сильно отличается от случайного. Это был один из первых, но далеко не единственный результат анализа ДНК.
Знаки препинания (Генетическая пунктуация)
Как в письменном языке пунктуация (точки, запятые, тире и т.д.) используется для членения и графической организации текста, так и в ДНКовом тексте существуют всевозможные знаки-сигналы, обозначающие границы отдельных функциональных элементов. Без таких сигналов генетическая информация не может быть правильно считана с носителя. Классический пример из лингвистики — предложение «Убить нельзя помиловать». Если не поставить запятую, то остается непонятным, то ли убить, то ли помиловать. Так и в гене. Знаки препинания, в отличие от генетического кода, не так универсальны в живом мире. Часть из них у низших организмов (прокариот) существенно отличаются по сравнению с высшими (эукариотами), включая человека.
Вот как выглядит, например, одна из страниц ДНКового текста, содержащаяся в томе (хромосоме) 11 человека (рис. 17).

Рис. 17. Страница Энциклопедии человека, на которой записана последовательность нуклеотидов ДНК человека, кодирующая белок альфа-интерферон. Ген интерферона выделен курсивом. Подчеркнут участок, кодирующий белок, состоящий из 188 аминокислот. Жирным шрифтом выделены знаки пунктуации в этом гене, обеспечивающие его правильную транскрипцию с образованием мРНК и последующую правильную трансляцию этой мРНК
Глядя на этот рисунок, даже специалисту сразу трудно что-то понять. Однако простая компьютерная программа быстро позволяет найти здесь участок, кодирующий белок интерферон. Это осуществляется в результате того, что в генах имеются специальные сигналы-ярлычки, которые можно рассматривать как знаки препинания в ДНКовом тексте. И компьютер способен их различить. Рассмотрим главные их них.
Так, в генах человека, как и у других высших организмов, имеются специальные последовательности-сигналы, которые определяют начало и конец процесса транскрипции, то есть синтеза мРНК.
Фермент, называемый РНК-полимеразой, узнает эти сигналы и осуществляет синтез «правильных» молекул мРНК (со строго запрограммированными в геноме концами). Одним из таких знаков препинания в ДНКовом тексте, отмечающим начало процесса транскрипции, служит короткая последовательность нуклеотидов: ТАТА (как пример, см. рис. 17).
Для процесса трансляции, то есть синтеза белка на мРНК, также имеются свои специальные знаки препинания. Таковыми являются отдельные тройки нуклеотидов (триплеты). На рис. 17 они выделены жирным шрифтом. Место, с которого начинается кодирование белка, — старт-сигнал — триплет АУТ. Далее следуют триплеты, которые кодируют аминокислоты в белке. А в конце текста имеется специальный стоп-сигнал (триплет УГА).
Но это еще не все. ДНК иногда претерпевает некоторые химические изменения. Известна такая химическая модификация ДНК, как метилирование, которая происходит строго по динуклеотидам-сигналам, представляющим собой пару нуклеотидов, в которой первым идет Г, а за ним Ц. Наконец, важными сигналами в генах являются участки, определяющие такой важный процесс, как сплайсинг, который происходит уже после образования РНК на гене. Об этом и пойдет речь дальше.
Гены построены из кусков
Успехи в изучении генома человека, а еще ранее — проведенный анализ отдельных генов других высших организмов, привели к ряду принципиально новых и совершенно неожиданных для генетиков результатов в отношении устройства генов, особенно тех, которые кодируют белки. Со времени появления центральной догмы молекулярной биологии думали, что непрерывная линейная последовательность нуклеотидов в ДНК с помощью триплетов нуклеотидов кодирует непрерывную последовательность нуклеотидов в мРНК, а последняя как посредник передает эту информацию на рибосомы, которые, считывая ее, осуществляют синтез линейных молекул белков. Это соответствовало ситуации, которую первоначально наблюдали при изучении генов у бактерий. Однако у высших организмов, включая человека, (и даже у некоторых низших) картина оказалась более сложной.
Когда сравнивали мРНК и соответствующий белок, то действительно обнаруживали непрерывность их нуклеотидных и аминокислотных последовательностей. То же наблюдали и при сопоставлении последовательностей аминокислот в белках и нуклеотидов в геномах вирусов. Однако с появлением возможности секвенировать протяженные участки ДНК (т. е. непосредственно генов) как у некоторых вирусов, так и у высших организмов получили совершенно неожиданные результаты. Внутри нуклеотидных последовательностей ДНК, кодирующих белок, были обнаружены какие-то иные, ничего не кодирующие участки. Чудеса, да и только! В чем же дело? Оказалось, что многие гены «расчленены» на отдельные куски. Одни из этих кусков, как и положено, кодируют белок (их назвали экзонами), а другие никакие белки кодировать не способны (их назвали интронами) и расположены между экзонами. Таким образом, в гене кодирующие и не кодирующие участки перемежаются друг с другом (рис. 18). Так устроено большинство белок-кодирующих генов. Хотя имеются и исключения. В этих случаях говорят, что ген устроен из одного экзона и интронов не содержит.

Рис. 18. Схематическое изображение экзон-интронного строения некоторых генов человека. Экзоны — прямоугольнники, интроны — линии между прямоугольниками. Темные прямоугольники — участки генов, кодирующие белок, белые прямоугольники в первом и последнем экзонах — специальные участки гена, кодирующие мРНК, но не кодирующие белок
Такое разорванное (экзон-интронное) строение оказалось характерным для подавляющего большинства (хотя и не для всех) генов человека. Вместе с тем у большинства простейших организмов интроны не обнаружены.
Размеры интронов часто значительно превышают размеры экзонов, что существенно увеличивает общую длину нуклеотидных последовательностей ДНК, образующих ген. При этом в геноме человека интроны в целом существенно длиннее, чем у других организмов.
Каким же образом разорванный ДНКовый текст реализуется в клетках в виде неразорванного РНКового, а затем белкового? Выяснилось, что первоначально при транскрипции гена синтезируется большой РНК-предшественник, копия ДНКового текста (с экзонами и интронами вместе). Далее в результате работы специфических ферментов происходит нарезание РНК-предшественника на куски. Те из них, которые ничего не кодируют (интроны), отбрасываются, а кодирующие куски (экзоны) соединяются между собой, обычно в том же порядке, как они располагались исходно в ДНК. В результате формируется зрелая молекула мРНК. Этот сложный процесс и получил название сплайсинга (рис. 19).

Рис. 19. Образование молекул мРНК на РНК-предшественнике в результате сплайсинга. Из РНК-предшественника вырезаются фрагменты, синтезированные с интронных последовательностей гена, а участки, синтезированные на экзонах, соединяются друг с другом, что в конечном итоге приводит к формированию зрелой функционально активной мРНК
В интронах содержатся особые сигналы, которые узнаются специальными ферментами, осуществляющими сплайсинг. Так, в 98% случаев интроны начинаются с динуклеотида ГТ, а заканчиваются динуклеотидом АГ. Они-то и служат главными сигналами для правильного осуществления сплайсинга.
Во всем этом и состоит основное ноу-хау в организации генов человека и других эукариотических генов. «Лоскутное» устройство большинства генов — чрезвычайно важное эволюционное приобретение высших организмов. За счет сплайсинга в РНК может происходить соединение не только между соседними экзонными нуклеотидными последовательностями, но и между другими, отстоящими порой в гене на значительном расстоянии. Это называют альтернативным сплайсингом (рис. 20). В геноме человека альтернативный сплайсинг характерен для более трети генов. Этому можно привести следующую аналогию: из слова «администрация» за счет удаления отдельных букв и слогов можно образовать множество совершенно разных по смыслу слов: ад, министр, амнистия, астра, нация. Существование множества альтернативных вариантов сплайсинга в конечном итоге обеспечивает появление более чем одного белка при экспрессии одного единственного гена. В частности, на гене белка тропонина человека, содержащем 18 экзонов, за счет альтернативного сплайсинга может образовываться 64 различных продукта! Сейчас подсчитано, что в среднем один ген у человека способен кодировать около 3-х разных белков. Альтернативный сплайсинг зависит от множества внутриклеточных и внешних факторов, в том числе, как показано недавно, даже от вирусного воздействия на клетку.

Рис. 20. Схематическое изображение альтернативного сплайсинга. Прямоугольниками разного оттенка обозначены экзоны, черными линиями — интроны. Показаны лишь две из множества возможных мРНК, образующихся на одном гене
Экзон-интронное строение генов дало принципиально новую возможность для эволюции генов — комбинировать отдельные элементы при формировании генов. В результате этого в эволюции возникали новые гены, кодирующие разные белки за счет разного сочетания экзонов одного и того же гена. То есть из уже готовых «слов» составляются совершенно разные «предложения». И такой подход, используемый природой, оказался весьма продуктивным.
Следует отметить, что и в зрелой мРНК, которая образуется уже после удаления из первичного транскрипта интронных нуклеотидных последовательностей, также не все участки кодируют белок. Однако, в отличие от интронов, такие последовательности нуклеотидов расположены в начале и в конце молекулы (см. рис. 18). Их размеры также существенно различаются.
Так, в разных мРНК человека некодирующая область, расположенная в начале молекулы, имеет длину от 2800 до 18 нуклеотидов (в среднем 200 нуклеотидов), а та, которая расположена в конце, составляет от 8500 до 20 нуклеотидов (в среднем 1000 нуклеотидов). Эти некодирующие белок области гена очень важны для нормального функционирования мРНК, ее трансляции, стабильности и локализации в клетке. Как уже говорилось, на одном гене за счет альтернативного сплайсинга может образовываться несколько мРНК. Следует подчеркнуть, что и на одной уже сформировавшейся мРНК могут образовываться разные белки. Это происходит за счет наличия в 50% мРНК человека не одного, а двух АУГ-кодонов, являющихся старт-сигналами для синтеза белка на мРНК. За счет этого, в разных ситуациях клетка может начать синтез белка с разных мест мРНК, в результате чего образуются разные по длине, а порой и по своим свойствам, белки. Опять же пример из лингвистики. Если читать текст не с первой, а со второй буквы, смысл зачастую совершенно меняется (сравните: удочка и дочка).
В связи со всем этим понятно, что классическая формула генетиков «один ген — один белок», предложенная лауреатами Нобелевской премии Джоржем Бидлом и Эдуардом Татумом, оказывается в реальности справедливой лишь для небольшой группы генов, а многие гены (возможно, большинство) кодируют семейства родственных, но существенно отличающихся белков, то есть нередко действует принцип «один ген — много белков». За счет этого в геноме осуществляется принцип экономии генетического материала (компактная запись) и достигается большой набор генных продуктов — белков — на относительно небольшом числе генов.
В таблице 3 приведена общая характеристика белок-кодирующих генов, выявленных в результате секвенирования генома человека.
Таблица 3. Усредненные данные о структуре белок-кодирующих генов генома человека

В реальности размеры разных генов, а также их экзонов и интронов сильно отличаются. И основной вклад в эту вариабельность вносят интроны. Уже говорилось, что максимальный по размерам ген дистрофина занимает в геноме человека 2,4 млн. п. н. Подавляющая часть занята именно интронами (их средний размер составляет несколько десятков тысяч п. н.). Наибольшую кодирующую последовательность в геноме человека имеет ген по имени титин. Его размер равен около 81000 п. н. Этот ген — чемпион и по числу интронов (178 штук!), и по длине единичного экзона (17106 п. н.).
Важно отметить, что разбивка генов на отдельные экзоны неслучайна. Индивидуальный экзон часто кодирует не просто какую-то часть белковой молекулы, а определенный фрагмент белка, выполняющий в целом белке отдельную функцию. Такой отдельный структурно-функциональный фрагмент, входящий в состав целого белка, называют доменом.
Перекрывание генных текстов
Принцип компактности записи информации в ДНК проявляется еще в одном. Важный факт, обнаруженный первоначально при анализе последовательностей генов у вирусов, заключается в том, что в одном и том же участке ДНК иногда может быть записана информация о двух совершенно разных РНК (и, соответственно, о совершенно разных белках). Такое случается и в геноме высших организмов, включая человека. Как же это осуществляется? Вспомним, что записанный в ДНК текст явно не разбит на слова (буквы — нуклеотиды — следуют в молекуле ДНК одна за другой). Но слова в этом тексте есть, просто знаки пунктуации и разрывы между словами скрыты от глаза и узнаются клеткой после перекодировки информации из ДНК в РНК. Для большей наглядности приведем широко известный пример такого текста:
НАПОЛЕОНКОСИЛТРАВУПОЛЯКИПЕЛИСОЛОВЬЯМИ.
В зависимости от разбивки этого текста на слова получается два предложения с совершенно разным значением:
НА ПОЛЕ ОН КОСИЛ ТРАВУ ПОЛЯ КИПЕЛИ
СОЛОВЬЯМИ
НАПОЛЕОН КОСИЛ ТРАВУ ПОЛЯКИ ПЕЛИ
СОЛОВЬЯМИ.
Теоретически на двух цепях ДНК с учетом того, что код триплетный, можно записать 6 разных текстов: три на одной цепи и три на другой. Это может быть достигнуто за счет сдвига точки начала считывания информации, что называют сдвигом рамки считывания (начало считывания возможно с любого из 3-х разных рядом лежащих нуклеотидов) (см. рис. 21). Такое явление получило название перекрывания генов. Впервые оно было обнаружено у вирусов. И здесь было понятно, зачем это потребовалось. Вирусные геномы обычно очень маленькие. Перекрывание генов диктовалось необходимостью как можно компактнее разместить информацию на относительно коротких молекулах ДНК. Большой геном человека теоретически позволяет обойтись без такого перекрывания. Однако и в геноме человека, хотя и относительно редко, перекрывание генов также имеется.

Рис. 21. Схематическое изображение перекрывания двух ДНКовых текстов, записанных на одном участке ДНК. Белок А образуется на мРНК, которая транслируется с одних кодонов, а белок Б образуется на мРНК, читаемой (транслируемой) со сдвигом в один нуклеотид. В результате кодоны (они разделены пробелами) совершенно разные, и, соответственно, при трансляции мРНК образуются совершенно разные белки
Каков может быть смысл в сохранении этого феномена в геноме человека? Пока еще не все ясно, но кое-какие моменты уже проясняются. Например, в ряде случаев обнаружили считывание РНК с разных цепей одного участка ДНК. Это приводит к образованию таких РНК, которые в силу комплементарности могут взаимодействовать друг с другом в клетке, образуя в результате двунитевые РНК. А в дву-нитевом виде мРНК не способна к такому важному процессу, как трансляция. Таков реальный механизм специфической регуляции (инактивации) экспрессии генов человека, число которых, по последним оценкам, составляет ~ 1600.
Не все гены кодируют белки
Прежде всего, следует отметить, что кроме генов, кодирующих белки, в геноме имеются еще гены, на которых синтезируется РНК, которые не являются мРНК (то есть, не кодируют белок), но выполняют ряд самостоятельных важных функций в клетках. В результате получается ситуация, что традиционное привычное определение гена надо расширять, включив в него гены, кодирующие белки, и гены, не кодирующие белки, но кодирующие функционально значимые РНК.
Давно уже известно, что кроме мРНК на ДНК синтезируются разнообразные вспомогательные РНК, которые сами не транслируются (т. е. они не кодируют белки), но участвуют в разных клеточных процессах. В первую очередь это РНК «домашнего хозяйства» — рибосомные РНК (рРНК), транспортные РНК (тРНК) и др., которые участвуют непосредственно в синтезе белка на мРНК. Эти РНК кодируются участками, которые также называются генами, и составляют основную массу РНК в клетках. рРНК входят в состав рибосом, являясь важным компонентом их структурной организации. У человека присутствует два основных типа рРНК размером около 1900 нуклеотидов и более 5000 нуклеотидов в малой и большой субчастицах соответственно. Еще одни некодирующие белок РНК — тРНК, которые обеспечивают аппарат трансляции, подтаскивая к рибосомам различные аминокислоты, вступающие в реакцию друг с другом. В геноме человека гены, кодирующие рРНК и тРНК, представлены многочисленными копиями. Так, в секвенированной ДНК человека обнаружено около 500 генов, кодирующих тРНК. Генов для рРНК в геноме человека выявлено около 200 копий, которые расположены на 5-ти разных хромосомах (13, 14, 15, 21 и 22).
Изучение свойств РНК привело к тому, что представление об исключительности белков в катализе биохимических реакций пришел конец. Выяснилось, что в природе имеются виды РНК, которые, подобно белкам, обладают высокоспецифической каталитической активностью.
Очень важным стало обнаружение в геноме человека множества других генов, также производящих РНК, но не способных кодировать белок. Постепенно выяснилось, что некоторые из таких не кодирующих белки РНК принимают участие в важнейших процессах, происходящих в клетке: регуляции транскрипции ДНК, сплайсинга и трансляции мРНК, модулировании функций белков и их пространственного распределения в клетке. По этой причине их назвали риборегуляторами. И примеров таких риборегуляторов уже сейчас можно привести немало. Так, установлено, что не кодирующий белок участок гена H19 имеет отношение к ряду процессов, протекающих в клетках, и, в частности, к их злокачественному перерождению. Другой РНК-кодирующий ген контролирует работу белок-кодирующего гена HFE, вовлеченного в метаболизм железа и связанного с наследственным заболеванием хемохроматозом. В последнем случае РНК-продукт кодируется тем же самым геном, который он регулирует, но его образование осуществляется на другой нити ДНК. В результате так называемый антисмысловой (комплементарный) РНК-продукт способен взаимодействовать с мРНК, образуя гибриды, неспособные транслироваться в рибосомах с образованием белка. Еще один интересный ген — ген РНК-активатора стероидного рецептора. Он обеспечивает активность стероидных рецепторов за счет образования комплекса с этим белком.
В клетках человека, как и у других организмов, выявлены короткие двунитевые РНК (микроРНК), отдельные из которых, по-видимому, могут участвовать в процессе регуляции экспрессии генов через механизм, названный РНК-интерференцией. Этот механизм впервые был обнаружен в 1998 году у низших организмов. Различные микроРНК в клетках червя C. elegans оказались в состоянии «приглушать» работу строго определенных генов путем воздействия на процесс синтеза кодируемых ими белков. Вполне вероятно, и у человека микроРНК играют подобную роль.
Таким образом, мы видим, что продукты генов, кодирующих только РНК, вмешиваются в различные клеточные процессы, используя при этом совершенно разные механизмы. Гены риборегуляторов составляют, по-видимому, заметную часть генома человека. Примерные оценки говорят о величине на порядок больше, чем доля белок-кодирующих нуклеотидных последовательностей. Сам факт существования таких генов, неспособных кодировать белок, но реально проявляющих себя в производстве функционирующих в клетках РНК, ставит большой вопрос перед исследователями генома. И, в первую очередь, что следует после этого считать собственно геном?
Ген в гене (генная матрешка)
Изредка обнаруживаются варианты, когда внутри одного гена целиком содержится другой, меньший по размерам ген. Этакая своеобразная «матрешка», построенная из генов. Такая организация генов весьма редка. Так, в хромосоме 22 имеется лишь 2 таких случая. Чаще всего белок-кодирующий ген располагается в интроне другого белок-кодирующего гена. Но встречаются и другие варианты. В качестве примера можно привести ситуацию, имеющую место для митохондриального гена одной из рибосомных РНК. Ген, кодирующий эту рРНК, обеспечивает ею рибосомы митохондрий в качестве структурного компонента (т. е. не кодирует белок). Однако вместе с тем небольшой участок, расположенный внутри этого гена, кодирует короткий белок (полипептид), получивший название гуманин (от англ. human — человек), который принимает участие в процессе программированной клеточной гибели. То есть в РНК-кодирующем гене может содержатся белок-кодирующий ген. Другой вариант — уже упоминавшийся выше ген H19. Здесь, наоборот, ген, кодирующий белок, содержит внутри своей кодирующей части другой более короткий ген, кодирующий только РНК, которая принимает участие в регуляции работы этого гена.
Генные семейства
Как у людей имеются семьи, так и у генов нередко существуют семейства. Семейством генов называют набор из двух или более генов, чьи экзоны родственны между собой, т. е. похожи (хотя и не идентичны) по нуклеотидной последовательности. В геноме человека присутствует около полутора тысяч таких семейств генов. Причем только около сотни из них специфичны для человека и других позвоночных животных, тогда как основная масса генных семейств имеется и у человека, и у червя.
Разные члены одного семейства генов возникали в эволюции из одного гена-предшественника (условно — от одного прапрапрадеда, как и в человеческой популяции). Процесс, в результате которого появлялись «копии», получил название дупликации, т. е. удвоения. Такие дупликации в некоторых случаях происходят не одноразово, а многократно. Сейчас стало ясно, что дупликации играют очень важную роль в эволюции. Подсчитано, что в геноме человека в сумме дуплицировано около 3,6% нуклеотидных последовательностей размером в 1000 и более п. н.
Разные копии одного семейства генов могут располагаться в геноме рядом и следовать друг за другом (это называют тандемной дупликацией). Рассмотрим несколько примеров. Так, гены, кодирующие рибосомную РНК (рРНК) и белки гистоны, расположены в геноме человека в виде кластеров, построенных из одних и тех же последовательностей, следующих друг за другом (рис. 22).

Рис. 22. Строение участка генома человека, состоящего из множества генов, кодирующих рибосомные РНК. Утолщенные линии — транскрибируемые участки
Такие «гроздья» одинаковых генов обычно требуются организму для того, чтобы нарабатывать большие количества определенного продукта. Действительно, рРНК составляет по массе основную часть всей клеточной РНК, входя в состав таких важных «машин» клетки, как рибосомы. Огромная масса гистонов нужна клетке для упаковки гигантских молекул ДНК и плотной укладки их в хромосомы. Во всех таких случаях говорят о большой «дозе» гена в геноме, которая в конечном итоге и обеспечивает клетку большим количеством продукта.
Однако в большинстве других случаев возникающие в результате дупликации «копии» генов постепенно претерпевают изменения (мутации), что приводит к возникновению определенных различий между ними, хотя формальное родство при этом сохраняется. Такой процесс был назван дивергенцией, т. е. расхождением. Дивергенцию обычно выражает в процентах различий между двумя родственными последовательностями нуклеотидов в ДНК или последовательностями аминокислот в белках.
Однако даже после того, как разные «копии» генов одного семейства становятся не совсем похожими друг на друга, они чаще всего выполняют сходную функцию. Они остаются очень дружной семейкой! Но экспрессируются разные члены одного такого семейства обычно в разное время или в разных типах клеток. Так, в геноме человека обнаружено тридцать генов, кодирующих родственные факторы роста клеток кожи (фибробластов). А вот у низших организмов число таких генов существенно меньше (у дрозофилы и червя их всего 2). Другой пример — гены, кодирующие кератины — белки наружного слоя кожи и ее производных (волосы, ногти). Их у человека 111 штук! Но и это не предел. Геном человека, как ни удивительно, имеет около 1 000 копий генов-рецепторов обоняния.
Дивергировавшие в ходе эволюции человека гены семейства иногда оказываются разбросанными в разных местах на одной или даже разных хромосомах. При этом ген может быть удвоен целиком, а может происходить удвоение небольшого набора его экзонов или даже всего лишь одного из его экзонов.
Как и в семье не без урода, так и в семействах генов встречаются иногда такие члены, которые не утруждают себя никакой работой. Нарушение их способности функционировать в клетке обычно связано с накоплением опечаток в их ДНКовом тексте. Такие гены-тунеядцы получили название «псевдогенов». Перед их названием ставят греческую букву ?. Не совсем ясно, зачем геному нужны такие гены, почему он сохранил их в эволюции, не избавился от них. Но факт остается фактом. По имеющимся оценкам, в геноме человека имеется около 20000 таких, подобных вымершим реликтам, псевдогенов. В частности, в огромной семействе генов-рецепторов обоняния, состоящем из примерно 1000 генов, около 60% являются псевдогенами. Считается, что массивная потеря функциональных генов произошла за последние 10 млн. лет, и связано это со снижением роли обоняния у человека по сравнению с другими позвоночными организмами. Здесь, по-видимому, действует принцип отмирания из-за неупотребления. Установлено, что существует, по крайней мере, два механизма, приводящих к образованию псевдогенов. Один из них заключается в удвоении уже существующего гена (дупликация), а потом дополнительная копия накапливает мутации, которые препятствуют его работе. Другой механизм связан с процессом сплайсинга и обратной транскрипции. На сформировавшейся мРНК синтезируется ее ДНК-копия, которая в дальнейшем встраивается в геном. Такие псевдогены не содержат ни интроны, ни промоторные участки. Кроме того, в них со временем накапливаются многочисленные мутации, не позволяющие этим генам обеспечивать синтез нормального белка.
Все вышесказанное можно проиллюстрировать на примере семейства генов, кодирующих белки крови человека (рис. 23). У человека имеется два семейства глобиновых генов (альфа и бета). Эти семейства расположены на разных хромосомах. Каждое семейство состоит из нескольких членов, имеются здесь и псевдогены. Нормальные гены глобиновых семейств экспрессируются в клетках крови на разных стадиях развития человека. Одни у эмбрионов (?, ?), другие у плода (G?, А?, ?1), а третьи — у взрослого организма (?2, ?, ?). Функция у всех глобиновых генов одинакова — синтез глобинов, участвующих в переносе кислорода клетками крови. И место их работы одно — клетки крови эритроциты. Отличаются они лишь тем, что включаются в разное время, в результате чего выполняют одну и ту же роль, но на разных стадиях развития организма.

Рис. 23. Строение двух локусов генома, состоящих из кластеров родственных глобиновых генов человека. Экспрессирующиеся гены указаны стрелками (направление транскрипции), молчащие гены (псевдогены) — квадратиками
Организация кластеров глобиновых генов у человека совершенно одинакова с организацией этих генов у гориллы и павиана. Это указывает на то, что такая организация полностью сформировалась еще от 20 до 40 млн. лет назад и с тех пор не изменялась. Анализ мутаций в межгенных областях позволил сделать вывод об эволюции не отдельных генов, собранных в такой кластер, а кластера как единого целого супергена.
По-иному ведут себя многочисленные гены семейства актинов, которые кодируют сократительные белки клетки. Эти гены экспрессируются почти все время, и их экспрессия происходит как в мышечных клетках, так и во многих других немышечных. При этом функция актинов везде одинакова.
Новые предложения из фрагментов старых текстов
Экзон-интронная организация генов способствует еще одному механизму возникновения новых генов — созданию новых ДНКовых текстов из фрагментов старых. Это осуществляется в результате «тасования» уже предсуществующих экзонов, что может приводить к появлению нового их сочетания и новых белков с новыми функциями. Чаще всего это происходит за счет процесса присоединения новых экзонов к старым. Примером этому может служить случай, представленный на рис. 24.

Рис. 24. Пример формирования новых генов за счет различного сочетания уже имеющихся экзонов. Изображены четыре разных белка, состоящих из сходных блоков-доменов (обозначены разными символами), которые кодируются разными экзонами
В процессе эволюции из общего предшественника образовались гены дрозофилы trx и ген человека alr. Ген человека hrx возник в результате присоединения к гену trx четырех новых экзонов. Это приводит к появлению в белке, кодируемом этим геном, четырех новых функциональных доменов, что существенно меняет его свойства по сравнению с предшественником. Такая ситуация вообще-то характерна для всех высших организмов, но у человека она встречается в 2–5 раз чаще, чем, например, у дрозофилы или червя.
После получения всех этих новых многочисленных сведений об особенностях организации и эволюции генов у человека (сходным образом обстоит дело и у других высших организмов) стало ясно, что дать строгое определение того, что же такое собой представляет ген, довольно сложно. Но даже если бы такое определение сегодня имелось, его, как и всякое другое, не следовало бы считать незыблемым. Не зря говорил Спиноза: «Всякое определение есть ограничение». Однако в целом базовое представление о гене осталось в силе. Ген — это физическая (определенный участок ДНК) и функциональная (кодирует белок или РНК) единица наследственности.
Сколько же всего генов у человека?
Это наиболее интересный вопрос, ради которого собственно и затевалось полное секвенирование генома человека. После получения основной информации о структуре генома человека в первую очередь были произведены различные анализы по поиску генов и определению их числа. Однако задача оказалась не простой. Это может показаться странным для читателя, но однозначного ответа на поставленный вопрос до сих пор нет.
Сколько же всего генов в ДНК человека? Еще несколько лет назад полагали, что их около 100 тыс., затем решили, что не более 80 тыс. В конце 1998 г. пришли к выводу, что в геноме человека не более 50–60 тыс. генов и на их долю приходится около 3% общей длины ДНК.
Последние подсчеты общего числа генов в геноме человека проводили несколько международных команд ученых. Уже упоминавшаяся компания «Celera» провела собственные исследования, результаты которого изложены в журнале «Science» в 2001 году. По ее оценкам общее число генов в геноме человека составляет от 26383 до 39114. Средний размер гена оценивается равным примерно 3000 п. н. Если принять, что число генов у человека порядка 30 тысяч и на каждый ген приходится примерно 3 тыс. п. н., то нетрудно подсчитать, что в кодировании белков принимает участие менее 1,5% хромосомной ДНК. Таким образом, генетические инструкции по формированию человеческой личности занимают меньше 3 сантиметров на двухметровой молекуле ДНК. Удивляет и малое количество генов, несущих эти инструкции, — их всего в пять раз больше, чем, например, у такого на наш взгляд совершенно примитивного организма, как муха дрозофила.
Вторая команда исследователей из Национального института геномных исследований США во главе с Френсисом Коллинзом, подсчитав число генов у человека независимым способом и на основе своих данных, получила сходный результат — около 32000 генов содержится в геноме каждой клетки человека.
Разнобой в окончательные оценки пока вносят два других коллектива ученых. Доктор Вильям Хезелтайн (руководитель фирмы «Хьюмэн Геном Сайенс») продолжает настаивать, что в их банке содержится приватизированная информация на 120 тыс. генов. Этой информацией он не собирается пока делиться с мировой общественностью. Фирма вложила деньги в патенты и собирается заработать на полученной информации, поскольку она относится к генам широко распространенных болезней человека. Фирма «Инсайт» сообщила о том, что имеет в настоящее время каталог, состоящий из 140 тысяч идентифицированных ей генов человека, и также настаивает на этом количестве общего числа генов у человека.
Очевидно, что наспех приватизированная генетическая информация будет еще тщательно анализироваться и проверяться в ближайшие годы, пока точное число генов станет окончательно «канонизировано». Дело в том, что устройство генов весьма многообразно и до конца еще не поняты все возможные варианты. Вот мы прочитали последовательность нуклеотидов ДНК. Определено, что она способна кодировать белок. Но один ли? Выше уже говорилось о том, как транскрипция и последующие модификации РНК, а затем трансляция и модификации полипептидов, способны обеспечить огромное многообразие белков, кодируемых одним участком ДНК. И понять это исходя только из нуклеотидной последовательности ДНК очень часто просто невозможно. Тем не менее структура генома представляет собой единственную базу для осмысления данных, получаемых такими новыми направлениями, рожденными геномикой, как транскриптомика (исследует совокупность РНК-транскриптов организма), протеомика (исследует совокупность белков организма), метаболомика (исследует обмен веществ — метаболизм — в организме). Эти направления призваны дополнить лежащий в основе структурной геномики метод геномного секвенирования, дать возможность выйти за пределы его разрешающей способности.
Выше уже также говорилось об альтернативном сплайсинге. Сейчас хорошо известно, что за счет этого процесса с одних и тех же генов могут считываться разные белки, которые затем взаимодействуют друг с другом, образуя неповторимую смесь, как из основных цветов в живописи — желтого, красного и голубого можно получить мириады оттенков. Такой сплайсинг характерен не менее чем для половины генов человека. Считается, что в среднем с одного гена человека за счет альтернативного сплайсинга может образовываться три разных пептида. Но некоторые гены имеют до 10 альтернативно сплайсируемых экзонов, что позволяет теоретически получать более 1000 различных вариантов белков всего лишь на одном гене. В реальности число разных белков, кодируемых одним геном, достигает 10. Кроме того, существуют еще и альтернативные промоторы, альтернативные кодоны инициации трансляции, редактирование РНК (превращение Ц в У или А в аналог Г — инозин). Все вышесказанное пока еще невозможно учесть при оценке общего числа генов у человека.
Но и это не все. Кроме генов, кодирующих белки, имеются еще гены, конечным продуктом которых являются РНК. Вспомним об упоминавшихся выше генах-риборегуляторах — они не кодируют белки, но производят функционирующую в клетках РНК. Так что скорее всего окончательная оценка числа генов у человека будет сделана еще нескоро.
На сегодняшний день ученым известны функции всего лишь около восьми-десяти тысяч из них. А детальные сведения о механизмах их регуляции еще более скудны. Тем не менее, приведенные выше данные о строении и функционировании генов человека свидетельствуют о том, что у человека, царствующего в природе, в отличие от других существующих на нашей планете организмов, очень высока сложность протеома — полного набора функциональных белков в клетке, которая обеспечивается не просто за счет крупного размера генома или большого числа генов, а благодаря всевозможным инновациям, связанным с функционированием генов и формированием белков: большее число доменов-модулей, более высокая комбинаторика (перемешивание) этих модулей в белках, активное использование альтернативного сплайсинга и многое другое, о чем мы поговорим дальше.
ОСНОВНАЯ ЧАСТЬ ГЕНОМА — ТЕРРА ИНКОГНИТА
Прогресс в биологии — это переход
от ложного знания к истинному незнанию.
В. Я. Александров
В природе нет ничего бесполезного.
М. Монтень
Теперь стало возможным оценить, что РНК синтезируется лишь максимум на 25–28% нуклеотидных последовательностей генома человека. А на кодирование белков используется вообще всего лишь чуть более 1% генома. Остальные транскрибируемые участки ДНК — это интроны белок-кодирующих генов и гены для РНК, не кодирующих белки. Таким образом, большая часть генома (свыше 70%) не имеет, по-видимому, прямого отношения ни к каким генам и инертна в плане транскрипции. Как это ни странно на первый взгляд, но факт остается фактом. Большая часть генома не кодирует ни белки, ни какую-нибудь РНК вообще, т. е. не относится к генам или каким-то другим, функционирующим на уровне транскрипции (РНК), нуклеотидным последовательностям.
В ДНК, на которой не образуется никакая РНК и которая, таким образом, для кодирования информации совершенно нейтральна, записаны длинные тексты, которые сегодня представляются для ученых полной абракадаброй, смысл и происхождение которой совершенно не ясен. Зачем нужны клетке эти «бессмысленные» и никак, на первый взгляд, не работающие участки ДНК, пока никто не знает, хотя априори ясно, что ничего лишнего в природе не должно быть. При полном секвенировании генома человека, естественно, была определена последовательность не только генов, но и этих пока ничего не обозначающих для ученых участков. Но из чего-то они все-таки состоят. Когда провели их детальный анализ, то выяснилось, что здесь присутствует скопище всех мыслимых и немыслимых вариантов расположения букв, бессмысленных слов и предложений, различных повторов одного и того же «текста», палиндромов и так далее и так далее. Рассмотрим подробнее хотя бы основные из них.
ДНКовый текст человека перенасыщен повторами
Как уже было показано в ранних экспериментах, описанных выше, в ДНК человека содержатся многочисленные элементы, которые не кодируют никакие белки, но при этом многократно встречаются в ДНКовом тексте. В «догеномную» эру считалось, что такие повторы составляют около 25% генома человека. Секвенирование ДНК показало, что их существенно больше: повторяющиеся последовательности в сумме занимают около 50% ДНКового текста. А общее число таких повторов в геноме человека равно приблизительно 5 миллионам. Для сравнения: у дрозофилы доля повторов в геноме составляет менее 5%, у червя — 6–7%, а у других млекопитающих — чуть меньше, чем у человека. Повторы напоминают бессмысленные фразы, которые с упорным постоянством в разных вариациях повторяются в тексте, но от этого смысл в них все равно не возникает.
На рис. 25 приведены некоторые основные варианты расположения повторов в геноме человека, а далее мы подробнее остановимся на описании отдельных из них.
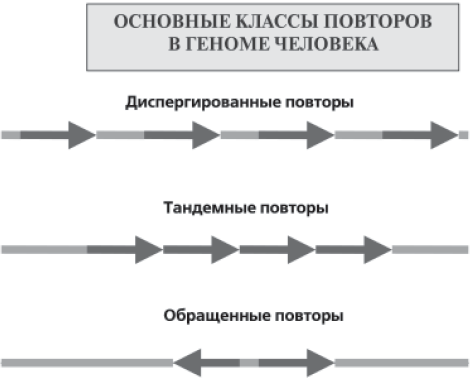
Рис. 25. Основные варианты расположения повторяющихся последовательностей в геноме человека. Повторы обозначены стрелками, неповторяющиеся участки — серыми линиями
Перевёртыши (обращенные повторы)
В ДНКовых текстах человека, как, впрочем, и в ДНК других организмов, присутствуют уже упоминавшиеся обращенные повторы, перевертыши или, как их еще часто называют, палиндромы. Уже говорилось о том, что перевертыши-палиндромы хорошо известны из литературы — это предложения, которые читаются одинаково слева направо и справа налево без учета знаков препинания и интервалов между словами. Считается, что палиндромы известны еще со времен Древней Греции, т. е. свыше двух тысяч лет. На Руси палиндромы когда-то назывались «рачьими стихами». В качестве примера приведем две державинские строки:
Я разуму уму заря,Я иду с мечем судия.Особое свойство таких участков ДНК заключается в том, что при определенных состояниях ДНК они способны образовывать структуры, называемые крестами. На рис. 26 дан пример одного из таких возможных крестов.

Рис. 26. Крест, способный образовываться последовательностью ДНК, состоящей из обращенных повторов
В реальной ситуации в клетке такие структуры действительно могут формироваться. Но зачем это нужно? Окончательного ответа на этот вопрос нет. Одно из предположений сводится к тому, что кресты могут быть местами связывания с какими-то специфическими белками, обеспечивающими регуляцию или процессов транскрипции, или репликации ДНК. С другой стороны, при транскрипции таких структур в РНК должны формироваться «шпильки», а такие структуры в РНК часто являются значимыми (то есть выполняют определенные функции — или способствуют транскрипции, или, наоборот, препятствуют ей).
Простые тандемные повторы (сателлиты)
Как и у других организмов, в геноме человека присутствуют короткие повторяющиеся нуклеотидные последовательности, которые расположены вплотную друг за другом (тандемно). Их часто называют сателлитными ДНК. Мы уже говорили о сателлитных ДНК ранее. Это те участки ДНК, которые при центрифугировании в градиенте солей цезия осаждаются отдельно вне области основной массы ДНК. В разных типах сателлитной ДНК различные копии представлены неодинаково — их численность варьируется от сотен до миллионов. Если записать их структуру текстом, то это выглядит, как, например, предложение из одного и того же слова: столстолстолстолстолстолстолстолстол. Ясно, что такие предложения не могут кодировать никакую серьезную информацию. Тем не менее выяснилось, что с сателлитными нуклеотидными последовательностями в некоторых случаях могут специфически взаимодействовать отдельные белки. А это уже некоторое довольно серьезное указание на возможное участие таких повторов в каких-то клеточных процессах.
К настоящему времени в геноме человека обнаружено по крайней мере шесть видов сателлитных повторов. Это в первую очередь три типа так называемых классических сателлитов. Сателлит 1 состоит из элементарной повторяющейся последовательности нуклеотидов длиной 42 п. н. (располагается на семи разных хромосомах); сателлиты 2 и 3 состоят из элементарных повторяющихся единиц длиной 5 п. н. (первый из них обнаружен на четырех, а второй — на двенадцати разных хромосомах).
Кроме того, во всех хромосомах человека присутствуют альфа-сателлитные повторы. Они имеют элементарную повторяющуюся нуклеотидную последовательность длиной 171 п. н. Существуют еще бета-сателлитные повторы с элементарной повторяющейся единицей длиной 68 п. н., которые встречаются лишь на девяти хромосомах. Еще реже представлены в геноме человека гамма-сателлитные повторы, имеющие элементарную повторяющуюся единицу длиной 220 п. н. Такие повторы присутствуют только на двух хромосомах человека (8 и X).
Распределение всех сателлитных ДНК вдоль хромосом не выглядит случайным. Так, некоторые из них «гнездятся» в районах, прилежащих к концам хромосом, и в области центромеры (перетяжка на хромосомах, которая не всегда расположена в самом центре, см. рис. 7). В частности, центромеры всех хромосом человека, размер которых варьирует от 0,1 до 4 млн. п.н., состоят преимущественно из альфа-сателлитных ДНК.
Наряду с типичными сателлитными ДНК, в геноме человека имеются нуклеотидные последовательности, получившие название мини- и микросателлитов, которые разбросаны по большинству участков всех хромосом и в сумме составляют около 3% генома человека. В среднем один из таких сателлитов содержится в каждых 2 тыс. п. н. человеческого генома. Минисателлиты представляют собой повторяющиеся нуклеотидные последовательности размером от 11 до 500 п. н. Кластеры таких повторов занимают от 0,1 до 20 тысяч п. н. в человеческом геноме, а общее число таких районов во всех хромосомах человека составляет несколько тысяч. Еще меньше по размерам микросателлиты. Их повторяющаяся нуклеотидная последовательность состоит из 10 и меньше п. н. Микросателлиты занимают в геноме человека обычно небольшие участки (до 150 п. н.). Когда же в тексте повторяется всего одна «буква» из четырех, такие структуры называют гомополимерными нуклеотидными последовательностями. Примером гомополимерной последовательности нуклеотидов в геноме человека может служить последовательность ААААААААААААААААААААААА на одной нити и, соответственно, ТТТТТТТТТТТТТТТТТТТТТТТ на другой.
Микросателлиты, состоящие из двух пар нуклеотидов (динуклеотидные повторы), занимают около 0,5% генома человека. Наиболее частыми динуклеотидами являются АЦ и АТ (50 и 35% всех динуклеотидов, соответственно). А вот динуклеотидный повтор, состоящий из пары ГЦ, в ДНКовом тексте человека занимает всего лишь 0,1%. Наиболее частые из более «сложных» микросателлитов (тринуклеотидных повторов) являются ААТ (33% от всех тринуклеотидных повторов) и ААЦ (21%). Триплет ЦГГ, который довольно редок в геноме, присутствует в гене FMR–1, определяющем синдром ломкости X-хромосомы. У нормальных людей число копий ЦГГ в гене варьирует от 6 до 54. А вот у больных индивидуумов такие триплеты «размножаются» и их число в гене может достигать 200–1300 копий. Подробнее о связи между сателлитными повторами и различными заболеваниями человека мы еще поговорим далее. Но остается загадкой: зачем такие нуклеотидные последовательности вообще нужны геному.
Выше приведенный пример и множество других случаев указывают на то, что микро- и минисателлиты весьма изменчивы, т. е., как говорят, полиморфны. Их распределение и число в геноме каждого конкретного человека столь специфично, что может использоваться в качестве аналога отпечатков пальцев. Как только это было обнаружено, этим фактом сразу воспользовались. В настоящее время ненужная вроде бы фракция генома человека (а на самом деле возможно и нужная, но мы просто о ней мало что знаем) стала востребована человеком для своих практических целей. На основании вариабельности сателлитных ДНК была развита диагностика родственных связей между людьми, склонности человека к различным заболеваниям и др. (см. об этом подробнее далее в разделе о геномной дактилоскопии).
И, наконец, еще один вид сателлитной ДНК был обнаружен при секвенировании генома человека, который получил название мегасателлитов. Эти тандемные повторы имеют размер от 2,5 до 5 тыс. п. н. и повторяются от 50 до 400 раз. Мегасателлиты присутствуют лишь в небольшом числе хромосом (в 4, 8, 19 и X).
Диспергированные повторы
В ДНКовом тексте генома человека содержится множество более длинных повторяющихся нуклеотидных последовательностей, которые в отличие от сателлитных повторов рассеяны (диспергированы) по всему геному. Эти повторы называют вездесущими, так как они присутствуют во всех районах всех хромосом, а иногда обнаруживаются даже и внутри генов. В сумме около половины ДНКового текста генома человека представлено такими повторами.
Исследователи разделяют эти разбросанные по геному (диспергированные) повторы на четыре основных типа. Наиболее представленными в геноме являются длинные диспергированные повторы (сокращенно ДДП). Их длина достигает 6 тыс. п. н., а повторяются они в геноме человека примерно 8,5х105 раз (в сумме ДДП составляют около 21% генома). Далее — это короткие диспергированные повторы (сокращенно КДП) длиной 100–400 п. н. В ДНК человека содержится примерно 1,5х106 копий КДП (это составляет около 13% генома). Имеются еще повторяющиеся элементы, окруженные с двух сторон дополнительными повторами (последние называют длинными концевыми повторами). Их назвали ретротранспозонами. (Как появилось такое сложное название, будет ясно из дальнейшего изложения). Длина этих повторов варьирует от 1,5 до 11 тыс. п. н., а общее число копий в ДНК человека составляет около 4,5х105, (8% генома). Наконец, в геноме человека присутстуют повторы, названные ДНК-транспозонами. Длины разных ДНК-транспозонов существенно отличаются (от 80 до 3000 п. н.). В геноме их меньше, чем других повторов (всего 3%), а общее число составляет 3х105.
Более подробно о структуре и характерных особенностях этих типов повторов мы поговорим далее в связи с одной чрезвычайно важной их особенностью — способностью перемещаться в геноме. Здесь же отметим, что имеется большое различие в распределении всех этих диспергированных повторов вдоль молекул ДНК. Хотя повторы имеются во всех участках хромосом, некоторые места почему-то сильно заселены ими, а другие, наоборот, практически их не содержат. Так, область размером 525 тыс. п.н. в хромосоме 11 на 89% состоит из таких повторяющихся элементов. А вот в хромосоме 2 имеется участок ДНК размером 100 тыс. п.н., в котором расположены кластеры генов некого семейства HOX, ответственных за процессы развития при эмбриогенезе, и который содержит всего около 2% рассеянных повторов. Однозначного объяснения этому нет, можно строить только разные предположения. Например, в случае с блоком генов HOX отсутствие здесь повторов, возможно, связано с очень сложной координированной регуляцией в этой области, а наличие бесполезных повторов могло бы нарушить такую регуляцию.
Диспергированные повторы умеют «прыгать»
В соответствии с законами классической генетики ожидалось, что в геноме все должно быть четко размечено, все гены-предложения должны располагаться в строго определенных местах текста. И большинство элементов генома действительно подчиняется этому общему правилу. Но из общего правила всегда есть исключения. Оказалось, что некоторые участки ДНК могут «путешествовать», меняя свое место, вытесняя друг друга. Подавляющее большинство генов никогда не покидают родную хромосому. Но в отличие от них определенные специфические нуклеотидные последовательности ДНК изредка с корнем вырываются из генома, выпрыгивают из одной хромосомы и приземляются в случайном месте на другой. При этом они могут влезть в середину гена, вызывая хаос, а могут примкнуть с края, слегка видоизменяя его регуляцию.
Впервые данное явление обнаружила у растений американская исследовательница Барбара Мак-Клинток еще в конце 30-х годов. Но очень долгое время ей никто не верил, исходя из общего принципа: «этого не может быть, поскольку не может быть никогда». Генетикам трудно было даже представить, чтобы гены прыгали с места на место, «ломая» наследственную информацию. Маститые ученые, если речь заходила о Мак-Клинток, с иронией приводили «прыгающие гены», «скачущие гены» как пример научной торопливости, некритического отношения к собственным результатам, стремления прославиться. Но прошло время и российские ученые (академик Г. П. Георгиев и член-корреспондент В. А. Гвоздев) обнаружили перемещения некоторых участков и в ДНК животного организма (дрозофилы). В конечном итоге научная общественность воздала Мак-Клинток должное. Она дождалась своего звездного часа и получила за свое открытие под конец своей жизни Нобелевскую премию (1983 г.).
Таким образом, было установлено, что отдельные участки генома высших организмов, подобно некоторым индивидуумам в нашем обществе, могут не хотеть жить по общим правилам. Их мало интересует постоянная прописка, и при определенной ситуации они берут и просто «переезжают» в любое заинтересовавшее их по каким-то причинам место или, как говорят, «перепрыгивают» в иные, видимо, более удобные для них районы ДНК. Другими словами, стало ясно, что геном не так уж и стабилен, законсервирован, как он казался многим исследователям до этого.
У человека возможность перестроек в геноме впервые была продемонстрирована при изучении генов иммуноглобулинов, связанных непосредственно с иммунной системой организма. Оказалось, что в процессе индивидуального развития в лимфоцитах (белые кровяные шарики) происходит перетасовка отдельных участков этих генов, в результате чего и формируются тысячи и даже миллионы новых вариантов иммуноглобулинов-антител, убивающих многочисленные чужеродные вмешательства различных живых агентов в человеческий организм. Это позволяет за счет сравнительно небольшого набора исходных генов обеспечивать образование огромного разнообразия всесторонне направленных иммуноглобулинов. Другие хорошо известные гены никогда не «прыгают». Такая ситуация оказалась уникальной именно для иммуноглобулиновых генов. Основное перемещение в геноме человека осуществляют не гены, а элементы совершенно другого типа, получившие название транспозонов. К ним относят различные элементы, входящие во все четыре выше перечисленных основных типа диспергированных повторов генома. Транспозоны способны к разным инновациям в геноме. Перемещаясь, они могут изменять регуляцию других генов и даже принимать участие в создании новых генов. Так, после полного секвенирования генома человека в нем удалось обнаружить около пятидесяти генов, произошедших из транспозонов. Несколько сотен генов в геноме человека используют длинные концевые повторы транспозонов в качестве терминаторов при транскрипции.
Теперь рассмотрим по отдельности структурные особенности разных семейств этих «прыгающих» время от времени элементов генома человека.
Семейство повторов по имени LINE
Как среди населения земли имеются многочисленные нации и меньшинства, так и в геноме одни повторы редки, а другие представлены большим числом копий. Основной представитель длинных диспергированных повторов генома человека — семейство повторов, получившее имя LINE (сокращенно от англ. long interspersed elements). Отличительная особенность этих повторов заключается в том, что они способны кодировать два белка-фермента, которые и принимают участие в перемещении их самих, а заодно они способны обеспечивать «перепрыгивание» и коротких диспергированных повторов (КДП). Это осуществляется главным образом за счет уже упоминавшегося фермента ревертазы. РНК, образующиеся после транскрипции LINE-повторов, превращаются в ДНК-копии, которые и встраиваются в новые места генома. В процессе синтеза ДНК-копии на РНК иногда происходит преждевременная остановка этого процесса, поэтому в геноме человека наряду с «полноразмерными» ДДП присутствуют элементы укороченной длины. Ферменты, кодируемые LINE-повторами, участвуют и в процессе появления в геноме некоторых псевдогенов, т. е. генов, которые вообще не способны функционировать. Но, как оказалось, не только их. Сейчас уже известно с десяток нормально функционирующих генов, которые возникли за счет обратной транскрипции мРНК. Такие гены, конечно же, не содержат интронов (их называют безинтронными).
Итак, в геноме человека источником активной ревертазы являются, по-видимому, ретротранспозоны L1, число копий которых достигает 100 тыс. Однако реально число активных перемещающихся копий составляет всего 30–60 тыс., тогда как остальные настолько повреждены, что не транскрибируются и, следовательно, уже не могут перемещаться.
Семейство повторов по имени Alu
Основную массу коротких диспергированных повторов (КДП) составляют так называемые Alu-повторы, которые занимают в ДНКовом тексте генома человека почти в 10 раз больше места, чем все последовательности, кодирующие белки. Свое название они получили по имени рестриктазы, для которой у них имеется определенный сайт. В сумме в геноме насчитывают около одного миллиона Alu-повторов. Такое их огромное количество не поддается нашему пониманию. Для чего они нужны? Ведь это относительно короткие повторы (около 300 п. н.), которые не способны кодировать никакие белки. Более того, разные члены семейства Alu-повторов не полностью похожи друг на друга, хотя родство между ними прослеживается однозначно (в среднем последовательности двух любых Alu-повторов сходны на 85%). Считается, что этот вид повторов появился в ходе эволюции у приматов (и только у них) свыше 65 млн. лет назад. Попав в геном человека, Alu чудовищно размножились и причудливо расселились по разным хромосомам, то скапливаясь в некоторых местах, то перемежаясь с генами или даже влезая в некоторые из них. В частности, Alu-повторы нередко присутствуют в тех районах генов, которые транскрибируются при образовании мРНК, но не транслируются при синтезе белка. При этом, как число, так и расположение Alu-повторов в геноме может заметно отличаться у разных индивидуумов.
Большинство из диспергированных повторяющихся элементов ДНКового текста обладают способностью к перемещению в геноме. Свидетельства этому «перепрыгиванию» были получены, в частности, при сравнительных исследованиях структуры отдельных районов генома у человека и других близкородственных приматов. Более того, и сейчас продолжается время от времени регистрация перемещения отдельных повторов. Так, установлено, что Alu-повторы изредка встречаются у некоторых людей в тех местах генома, где у большинства других их нет. Один из таких ярких примеров — обнаружение внедрения Alu-повтора в ген фактора свертываемости крови VIII при такой патологии, как гемофилия А.
Итак, геном — это не застывшая ДНК, а динамическая структура, чем-то напоминающая атом. Последний имеет не только стабильное ядро, но и целый рой перемещающихся вокруг его элементов (в частности, электронов). Именно поэтому академик Г. П. Георгиев справедливо отметил, что «ген постоянен в своем непостоянстве»!
Стоит сразу оговориться, что перемещение транспозонов происходит крайне редко. Тем не менее его значимость для генома человека весьма велика и определяется, по-видимому, тем, что этот процесс продолжается безостановочно на протяжении многих тысячелетий. Можно думать, что в результате этого подвижные или мобильные элементы способны в ходе эволюции заметно «тасовать» текст Энциклопедии человека подобно тому, как игроки тасуют колоду карт.
Перечень подвижных элементов генома не ограничивается различными описанными выше диспергированными повторами. К таковым относятся и некоторые элементы, доставшиеся нам в ходе эволюции от таких простейших организмов, как вирусы и бактерии.
Вирусы — составная часть генома человека
Незримая борьба между человеком и такими «внутриклеточными паразитами», как вирусы, происходила на протяжении тысячелетий. Только после обнаружения вирусов Д. И. Ивановским в 1892 году человечество наконец-то распознало своего невидимого врага, который, проникая в клетку человека, использует все ее возможности в своих корыстных целях, тем самым нарушает нормальный метаболизм клетки и вызывает различные тяжелые патологии. Ряд вирусов обладает способностью внедряться в геном человека и по сути становиться как бы его собственными генами. В первую очередь это относится к так называемым ретровирусам. Они так были названы по своему образу жизни. Исходно геном этих вирусов представляет собой РНК. Но, попав в клетку, вирус на своей РНК с помощью обратной транскриптазы строит ДНК-копию (см. основную догму молекулярной биологии). После этого ДНК-копия вируса встраивается в геном клетки, что служит обязательным условием для жизненного цикла ретровируса. Встраиваемая в геном клеток человека ДНК-копия вируса была названа провирусом. Затем на провирусе синтезируются вирусные РНК, на базе которых образуются новые вирусные частицы. Таков жизненный цикл обычного ретровируса. Так ведет себя, например, хорошо известный ретровирус, получивший название вируса иммунодефицита человека (ВИЧ), когда он инфицирует клетки крови.
Казалось, что все это есть проблема отдельных инфицированных клеток. И действительно, вирусы инфицируют в основном соматические клетки. Затем вирусы и провирусы погибают вместе с теми клетками, в которых они похозяйничали. Т. е. вирусы сами подготавливают и свою собственную смерть. Однако это не всегда так происходит. Очень редко в эволюции человека происходило инфицирование вирусами клеток зародышевого пути, образовывались провирусы, но организм выживал и внедренный провирус становился наследуемым элементом генома человека. Так в клетке появляется «лжепрограмма» (провирус), которая изменяет геном гораздо сильнее, чем это возможно при «нормальной» эволюционной изменчивости.
Когда секвенировали геном человека и многих других млекопитающих, оказалось, что в их составе содержится очень большое число повторяющихся элементов, имеющих сходство с инфекционными вирусами. Повторяющиеся элементы, способные кодировать 2–3 белка и окруженные с двух сторон еще одними особыми повторами — названными длинными концевыми повторами (ДКП), — были отнесены к семейству, получившему название ретротранспозонов. У человека они составляют довольно существенную часть — около 8% генома. Такие элементы назвают часто эндогенными ретровирусами, в отличие от типичных ретровирусов, существующих в природе вне организмов (их называют экзогенными ретровирусами). Структура типичного эндогенного ретровируса (провируса) изображена на рис. 27 на цветной вклейке. Она напоминает структуру отдельных современных экзогенных ретровирусов (на рисунке вверху), хотя часто существенно отличается от них. Все-таки за миллионы лет древним провирусам трудно было остаться неизменными. Большая часть этих элементов представляет собой дефектные вирусные последовательности или даже отдельные их короткие фрагменты. Происходило это главным образом за счет накопления точечных мутаций и различных делеций. В частности, у многих эндогенных ретровирусов отсутствует ген env. Концевые участки ретровирусов, названные длинными концевыми повторами (ДКП), нередко существуют в геноме человека сами по себе, оторвавшись от своего эндогенного ретровируса в ходе эволюции и собственного перемещения по геному.
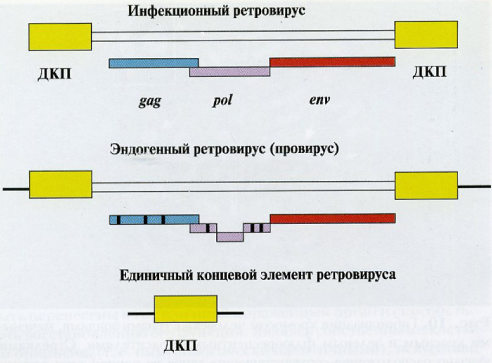
Рис. 27. Типичные структуры инфекционных и эндогенных ретровирусов, а также их отдельных элементов в геноме человека. ДКП — длинный концевой повтор (обозначен желтым цветом). Типичные гены ретровирусов — gag, pol, env. Черные горизонтальные линии — последовательности генома человека. Черные поперечные полосы в генах — мутации.
Мутации, накопившиеся в ходе эволюции в эндогенных ретровирусах, не позволяют им образовывать новые инфекционные вирусные частицы, как это происходит обычно в случае типичных экзогенных вирусов (например, вируса иммундефицита человека, вызывающего такое страшное заболевание, как СПИД).
Согласно проведенным оценкам, такие провирусы появились в геноме человека от 10 до 50 млн. лет назад в результате инфицирования зародышевых клеток наших предшественников и с тех пор передаются по наследству, как и все другие собственные элементы генома. Так «чужие» молекулы ДНК стали частью нашего генома. В сумме их насчитывается несколько десятков тысяч, они состоят из более 200 различных групп и подгрупп. Ретротранспозоны генома человека часто рассматривают как «ископаемые останки» древних ретровирусов.
Появление провирусов в геноме человека сродни процессу, который в лингвистике называют лексическим заимствованием. Во всяком языке имеются слова «свои» и «чужие» — те, которые пришли из других языков. Заимствование слов считается естественным ходом событий, необходимым для языкового развития. Возможно, и появление провирусов повлияло на ход становления человека как вида. По крайней мере известно, что число провирусов в геноме человека существенно больше, чем в геноме обезьян.
Итак, эндогенные провирусы являются «следами» от вирусов, которые инфицировали наших предков миллионы лет назад. Поселившиеся в геноме наших предков, они со временем потеряли способность образовывать новые вирусные частицы. Большинство таких «реликтовых» ретровирусов «молчит» (не функционирует). Однако сейчас уже установлено, что при определенных воздействиях на геном они могут «заговорить» и этим нарушить нормальный метаболизм в клетке. Таким образом, потенциально некоторые из них и по прошествии тысячелетий продолжают представлять потенциальную опасность для человека.
Выяснилось, что отдельные члены семейства ретровирусов сохранили способность синтезировать РНК, а также обладают склонностью к рекомбинациям и перемещению в геноме. Так, анализ эндогенных провирусов генома человека позволяет заключить, что отдельные из них являются копиями, появившимися в результате так называемой ретропозиции. Ретропозиция — это процесс появления новых копий в геноме не за счет нового инфицирования вирусом, а в результате транскрипции уже имеющегося в геноме провируса. Сначала образуется вирусная РНК-копия, затем на ней с помощью обратной транскрипции образуется ДНК-копия, и уже она внедряется в новое место в геноме. Другие элементы эндогенных провирусов, обнаруживаемые в геномах современных людей, возникли в результате рекомбинаций, таких, как, например, рекомбинации между концами провирусов, что привело к исчезновению внутренних участков провирусов и образованию коротких ретровирусподобных элементов. Таким образом, провирусы эндогенных ретровирусов — не просто окаменелые остатки прошлых эпох, а элементы генома человека, которые определяют присущую ему нестабильность (об этом подробнее поговорим дальше).
В геноме человека эндогенные ретровирусы встречаются во многих местах, но их распределение по хромосомам не совсем равномерное. Имеются участки, обогащенные ими, и в то же время некоторые области хромосом человека не содержат подобные элементы. Иногда отмечают, что местонахождение эндогенных ретровирусов и их производных коррелирует с распределение генов в геноме. Часто они располагаются в регуляторных областях генов. И в этом ученые усматривают особый смысл: регуляторные элементы эндогенных ретровирусов могут вмешиваться в регуляцию работы обычных генов человека.
Академик Е. Д. Свердлов считает, что вирусы могли сыграть решающую роль в «очеловечивании» обезьяны. Возможно, что в процессе эволюции молекулы ДНК человека включили в свой состав уже готовые фрагменты генетического материала вирусов с одной лишь целью — облегчить конструирование собственных генов для кодирования новых признаков. Включение генетического материала вирусов в геном человека служит еще одним подтверждением универсального характера молекул ДНК, имеющихся у всех живых существ — от самых простейших организмов вплоть до человека.
Еще одна группа спонсоров человеческого генома (ДНК-транспозоны)
В результате секвенирования ДНК человека был раскрыт еще один секрет генома. Кроме вирусов, проникших в наш геном извне и со временем сильно размножившихся там, заметную часть генома человека составляют и гены, пришедшие к нам от других наших постоянных симбионтов — бактерий. В геноме человека содержится множество так называемых ДНК-транспозонов. Они в сумме составляют около 3% генома человека и представлены в нем примерно 300 000 копиями, которые в свою очередь подразделяются на 7 разных классов. Все они по своей структуре очень напоминают ранее обнаруженные перемещающиеся элементы у бактерий — бактериальные транспозоны. Сходство выражается в первую очередь тем, что ДНК-транспозоны человека, как и бактериальные транспозоны, способны кодировать специальный фермент транспозазу, который и обеспечивает их подвижность.
Кроме бактериальных транспозонов, в геноме человека содержится свыше 220 генов, доставшихся нам «в наследство» непосредственно от бактерий, обитающих у нас в кишечнике. Половина из этих генов широко распространена в разных видах бактерий, но среди эукариот встречается только у позвоночных. Теперь стало окончательно ясно, что бактерии, также как и вирусы, внесли свой вклад в формирование генома современного человека. Все это, по-видимому, есть результат длительного сожительства человека с бактериями, когда при некоторых случайных событиях гены бактерий попали в геном человека и там закрепились. Мы давно знаем, что в нашем кишечнике живет много разных видов бактерий, которые не только для нас не вредны, но, наоборот, полезны, так как они служат поставщиками ряда биологически активных продуктов (в частности, некоторых витаминов). Перенос генов «по горизонтали», т. е. от одного вида организма в другой, в принципе был известен давно. В частности, он активно реализуется между разными видами бактерий.
Но то, что он столь масштабно выражен и между геномами таких эволюционно далеких организмов, как человек и бактерии, безусловно, стало для исследователей полной неожиданностью. Интересно, что гены, доставшиеся человеку от бактерий, содержат, как и многие другие, интроны. Последних нет у бактерий. Следовательно, в процессе эволюции после переноса бактериальных генов в геном человека произошло еще одно событие: в состав «бактериальных» генов, ставших генами человека, внедрились дополнительные нуклеотидные последовательности, которые теперь являются интронами.
Гены, доставшиеся человеку от бактерий, не случайно сохранились в геноме. Многие из них играют важную роль в метаболизме ксенобиотиков (чужеродных для человеческого организма веществ) и в ответе клеток на стресс. Можно отметить один из таких генов — ген МАО, кодирующий белок, на который направлено действие разных психофизиологических лекарств. Следовательно, приобретение по крайней мере некоторых из бактериальных генов дало человеку определенные селективные преимущества.
На этой почве существуют разные спекуляции. Одна из них изложена 3. Ситчиным в своей книге «Генезис пересмотренный и космический код». Согласно его рассуждениям, некие пришельцы из космоса по имени аннунаки прибыли на 3емлю приблизительно 450 тысяч лет назад. Они высадились на 3емлю в поисках полезных ископаемых, и им понадобилась рабочая сила. Рабочих решили не привозить издалека, а слегка усовершенствовать существовавшего тогда на 3емле гоминоида, добавив ему некоторые гены более «продвинутых» аннунаков. И космические генные инженеры внесли в геном гоминоида те гены, которые мы теперь называем бактериальными. А бактерии потом приобрели их от нас. Сформулировано, конечно, красиво, однако весьма напоминает фантастический роман.
В любом случае, геном человека представляет собой некое собрание генов, которые достались человеку от их предков, и генов, которые явно ведут свое происхождение от неродственных организмов — вирусов и бактерий. То есть можно сказать, что наш геном — это книга, в которой отдельные «предложения» заимствованы из других независимо написанных источников.
Нуклеотидные последовательности — «близнецы»
В результате секвенирования генома человека в нем, наряду с типичными повторяющимися элементами, были обнаружены протяженные нуклеотидные последовательности, которые представлены всего в двух-пяти копиях. Чаще всего эти копии очень похожи друг на друга, как близнецы (сходство по последовательности достигает 99%). Общее количество таких элементов в геноме человека составляет порядка 5%. Это значительно больше, чем в других секвенированных к настоящему времени геномах, таких, например, как червь и дрозофила. Появление в геноме ДНКовых текстов-близнецов связывают с процессом, названным сегментальной дупликацией, то есть случайным удвоением отдельных сегментов генома. Размер таких «близняшек» составляет от 1 до 200 тыс. п. н. Последовательности-близнецы иногда располагаются на одной и той же хромосоме, а иногда присутствуют на совершенно разных хромосомах. Например, геномный сегмент X-хромосмы размером 9,5 тыс. п. н., известный как участок, ответственный за развитие адренолейкодистрофии, присутствует практически в неизмененном виде на хромосомах 2, 10, 16 и 22. А в хромосоме 17 имеется пять копий одного сегмента размером 200 тыс. п. н., которые разделены между собой довольно длинными последовательностями. При анализе разных хромосом выявилось, что дуплицированные последовательности распределены по ним не равномерно. Больше всего их имеется в Y-хромосоме, а менее всего в хромосоме 7. Неравномерно они распределены и вдоль хромосом, концентрируясь в районах центромер и теломер. Предполагается, что появление последовательностей-близнецов может быть связано с эволюционным процессом и приводит к увеличению разнообразия белков за счет «тасования» уже существующих экзонов.
В таблице 4 даны суммарные данные о содержании разных видов последовательностей в геноме человека.
Таблица 4. Нуклеотидные последовательности, входящие в состав генома человека

Имеется ли в геноме «эгоистичная» ДНК?
Когда полностью секвенировали довольно крупный геном круглого червя С. elegans, то обнаружили, что в нем 27% нуклеотидных последовательностей кодируют структурные белки, 26% принимают участие только в начальной стадии кодирования и в дальнейшем от синтеза белка отстраняются (интроны), а оставшиеся 47% приходятся на повторы и межгенные участки, которые в кодировании белков не участвуют и в настоящее время представляются нам «лишним» материалом. При сравнении этих данных с геномами животных, стоящих на различных ступенях эволюционной лестницы, выяснилось, что чем сложнее устроен организм, тем меньше в его геноме доля кодирующих участков и тем больше в нем доля непонятной для нас информации. И больше всего ее в геноме человека. На первый взгляд это выглядело парадоксально.
Так в чем же дело? Этот вопрос возник еще в конце 70-х годов прошлого века. В 1980 году лауреатом Нобелевской премии Дж. Уотсоном и рядом других исследователей было впервые предложено считать участки, не способные кодировать белки, и при этом повторяющиеся в геноме, никчемными, лишними. Появился даже специальный термин «selfish DNA», что переводится как «эгоистичная ДНК». По мнению Уотсона, эгоистичная ДНК существует сама по себе и сама для себя. Накопление избыточной некодирующей белки ДНК — не что иное, как «эгоистическое» самоумножение селективно нейтральных молекул. В попытках объяснить наблюдаемое явление ученые пренебрежительно назвали «лишнюю» «эгоистичную» ДНК строительным «мусором», издержкой эволюции, которая служит платой за совершенство остальной ее части. В одном из последних изданий Oxford English Dictionary приводится такое значение слова эгоистичный: «Применительно к гену или генетическому материалу: обладающий тенденцией к воспроизведению или распространению, несмотря на отсутствие фенотипического (т. е. проявляемого внешне) эффекта».
После секвенирования генома человека, когда было установлено, что и в ДНК человека подавляющая часть последовательностей представляют собой участки, не кодирующие никакие белки или функционально значимые РНК (рРНК, тРНК и др.), стало ясно, что в отличие от трудяг-генов основная масса ДНК действительно не работает, т. е. не выдает никакой информации для производства белков или РНК. И это при любом расчете более 70% всей ДНК! Что-то слишком много для эгоистичной ДНК или «мусора». Такого количества геномного «мусора» нет ни у бактерий, ни у дрожжей, ни у мух.
Что это значит? Или наш геном в отличие от геномов более примитивных организмов ленится выгребать накапливающийся «мусор», или это совсем не мусор, а некое ценное эволюционное приобретение, которое дало когда-то человеку определенные преимущества, и поэтому геном от такого «мусора» не спешит избавиться.
На сегодняшний день мы еще многого не знаем об этой огромной части генома человека, пока условно называемой «эгоистичной». Однако уже сейчас ясно, что определение «эгоистичности» или «бессмысленности» для большинства участков генома на самом деле нельзя признать полностью справедливым. Если мы сегодня не в состоянии понять, для чего нужны какие-то участки ДНК, это еще не значит, что они пренебрежительно могут быть названы мусором. У бактерий «бессмысленных» участков вообще нет. У дрожжей почти нет. Но по мере повышения уровня организации живого организма накапливается все больше и больше вроде бы ничего не кодирующей ДНК. Трудно согласиться с предположением, что это результат некой неосознанной деятельности эволюции. Можно предположить, например, что эти нуклеотидные последовательности ДНК являются резервуаром эволюции, складом «запчастей». Если с каким-либо геном что-то не в порядке, клетка использует фрагменты некодирующей ДНК для «ремонта» поврежденного. Сегодня ученые вынуждены отказываться от многих своих первоначальных, довольно ограниченных представлений. Время идет, и сейчас уже по крайней мере у некоторых из этих участков обнаружены определенные специфические функции.
И каковы же эти функции у ДНК, считавшейся много лет «эгоистичной»? Давно уже известно, что повторами в геноме человека являются представленные сотнями копий гистоновые гены, имеются тысячи копий генов, кодирующих рибосомные РНК, транспортные РНК и др. В дальнейшем выяснилось, что существуют и повторы, расположенные в концевых некодирующих белки участках мРНК, которые принимают, по-видимому, участие в таком важном процессе, как трансляция этих молекул. Оценено, что у человека такие элементы встречаются в 12% начальных некодирующих участков мРНК и в 36% некодирующих участков, расположенных в конце молекулы, что существенно выше, чем у других организмов. Повторы, расположенные в участках, кодирующих мРНК, несут определенную функциональную нагрузку. Они нередко участвуют в правильном и своевременном считывании информации при образовании белка на мРНК. Однако в сумме доля таких значимых или потенциально значимых повторяющихся участков генома человека весьма невелика.
Среди транспозонов, которые также были прежде отнесены к «эгоистичной» ДНК, постепенно обнаруживаются различные неизвестные ранее регуляторные последовательности, которые управляют работой ряда генов. Некоторые из транспозонов выступают в роли энхансеров (усилители транскрипции), сайленсеров (ослабители транскрипции), терминаторов транскрипции и прочих красиво звучащих элементов генома. Более того, выяснилось, что не менее полусотни генов генома человека имеют свое происхождение из транспозонов. Наконец, следует отметить, что определенные некодирующие белки участки ДНК обеспечивают процесс ее репликации, другие — упаковку в хромосомы, третьи — прикрепление к определенным структурам в ядре и т. д.
Можно привести ряд конкретных примеров. Так, Alu — повторы, о которых шла речь выше, обычно рассматривали как типичные представители «эгоистичной» ДНК, поскольку они имеют высокую повторяемость и при этом ничего не кодируют. Тем не менее и им может быть найдено применение в геноме, например, в регуляции работы генов. Похоже, в эволюции геномной ДНК действует некий «принцип слоненка Киплинга». Хобот у слоненка возник из-за его желания узнать, что ест крокодил на обед. Слоненок вначале огорчился своему носу, но не растерялся и нашел ему разные полезные применения. Так и повторяющиеся последовательности генома. Они возникают и меняются по своим внутренним молекулярно-генетическим законам, но для их вариаций потом может найтись полезная функция в геноме. Сейчас выяснилось, что способность Alu-повторов к перемещению может играть существенную роль в эволюции генома. Например, описаны случаи, когда, внедряясь в экзон или интрон какого-нибудь гена, такой повтор менял регуляцию его экспрессии. Alu-повтор способен также модулировать процесс репликации ДНК, регулировать сплайсинг и некоторые другие генетические процессы. Имеются данные, что эти повторы участвуют в подавлении трансляции РНК при клеточном ответе на стрессовые воздействия. Различные описанные в литературе функции, выполняемые Alu-повторами, помогают понять и объяснить причину их длительной «фиксации» в человеческом геноме. Скорее всего действительно многие из Alu сидят без дела до поры до времени, но отдельные представители не просто живут и размножаются, а и иногда работают.
Не находятся совсем без дела и длинные повторяющиеся последовательности. Так, показано, что они могут участвовать в процессе «тасования экзонов» (подробно тасованию карт), т. е. перемещения экзонов из одних генов в другие и формирования за счет этого новых генов.
Наконец, «бессмысленные» участки ДНК иногда могут осмысленно работать в хромосоме, например, когда они защищают свой вид от вторжения чужеродной ДНК. Выяснилось, что пустые концевые участки хромосом, как и область центромер (первичные места спаривания родительских парных хромосом), важны для сохранения вида: они определяют строгое распознавание макрорельефа хромосомы как органеллы клетки (а не микрорельефа — как молекулы ДНК) одного вида по принципу «ключ-замок». В результате этого сперматозоиды обезьяны не оплодотворяют яйцеклетки человека, т. к. хромосомы двух видов не распознают друг друга.
Таким образом, согласно современным оценкам, в участках «эгоистичной» ДНК скрыта определенная эволюционная информация. В результате перестройки некодирующих белки участков, что вообще-то не влияет на структуру самих генов, может происходить изменение в наборе формирующихся в конкретной клетке мРНК за счет изменения в их процессинге (альтернативный сплайсинг), использование альтернативных промоторов или даже формирование новых генов.
И последний пример функциональной значимости «эгоистичной» ДНК, который мы приведем здесь, — данные о строении концов хромосом.
Концы молекул ДНК — объект повышенного внимания
Устройство концов хромосом давно интересовало исследователей. Теперь стало ясно, что они устроены по особому. И эту некодирующую белки ДНК никак нельзя назвать «эгоистичной». Концевой участок ДНК, называемый теломерным, представляет собой область размером 3–20 тыс. п. н., состоящую из тандемно расположенных повторов TTAГГГ (рис. 28). С этими участками образуют комплекс различные специфические белки, и такой комплекс получил название теломера.
Самый-самый (в данном случае левый) кончик хромосомы человека выглядит так:
ГГГАТТГГГАТТГГГАТТГГГАТТГГГАТТГГГАТТ…
ЦЦЦТААЦЦЦТААЦЦЦТААЦЦЦТААЦЦЦТАА…
То есть каждый том Энциклопедии человека начинается с буквы Г, и первые 6 букв — это однонитевая ДНК, а вовсе не двунитевая, какова она на всем дальнейшем протяжении. В английском языке с буквы Г (G) начинается слово Бог (God), и некоторые исследователи склонны видеть в этом некий глубокий смысл. При определенном желании, конечно же, можно найти много всяких аналогий, но эта — безусловно случайная.

Рис. 28. Структура концов ДНК в хромосомах — теломер
3а короткими повторами располагаются более длинные повторяющиеся последовательности, которые назвали повторами, ассоциированными с теломерой. Далее следуют уникальные для каждой хромосомы последовательности, которые на практике используются для различения разных концов разных хромосом. Теломеры защищают основную часть ДНК от действия ферментов, которые в отсутствие теломер разрушали бы молекулы ДНК. Кроме того, теломеры способствуют правильной рекомбинации хромосом и их прикреплению к оболочке ядра.
Концевые участки хромосом не статичны. При каждом делении клеток происходит их укорочение в среднем на 50 п. н. Все известные ДНК-полимеразы, которые участвуют в процессе репликации ДНК, неспособны полностью реплицировать концы молекул. Поэтому каждая следующая копия короче предыдущей. Как если бы машинистка, перепечатывая книгу, всегда ленилась бы перепечатать последнюю страничку.
Чтобы не происходила потеря генетического материала при делении клеток, у эмбрионов концы молекул ДНК наращиваются перед каждой репликацией короткими повторяющимися последовательностями. В этом участвует специальный фермент — теломераза. Однако в клетках взрослого организма этот фермент перестает работать, и в результате хромосомы постоянно укорачиваются, съеживаются, как шагреневая кожа, при каждом цикле репликации ДНК. Так происходит до определенного предела, после чего деление клеток становится, по-видимому, невозможным и наступает их гибель.
«Белые пятна» генома
На фоне всеобщей эйфории, связанной с секвенированием генома человека, мало внимания было обращено на то, что необходимо еще некоторое время для получения действительно полной последовательности нуклеотидов генома. На современной карте генома человека все еще зияет множество «белых пятен». В сумме они составляли на начало 2002 года всего около 3–5%, что вообще-то сопоставимо с долей генома, занимаемой всеми генами. Причина этого заключается в первую очередь в существовании серьезных технических трудностей при секвенировании и картировании отдельных специфических участков ДНК. Так, некоторые нуклеотидные последовательности обладают нестандартной структурой, что усложняет процесс их расшифровки стандартными методами. В частности, это относится к таким районам хромосом, как теломеры — концевые участки, которые имеют необычную структуру. Их порой трудно выделять из общей массы нуклеотидных последовательностей в силу того, что они расположены на концах молекул ДНК. Другие участки трудно идентифицировать в связи с тем, что они часто повторяются и их пока не удается «вписать» в общий текст, поскольку не ясно, где их истинное место. Эти участки порой так похожи друг на друга, что нелегко понять, где какой из них точно расположен («Фигаро здесь, Фигаро там»). Такая ситуация характерна в основном для центромерных областей хромосом, содержащих тандемные кластеры альфа-сателлитных последовательностей, и районов расположения микро- и минисателлитов. Имеются проблемы и с секвенированием коротких «плечей» некоторых хромосом. Однако если сравнить эти проблемы с начальными этапами работы, то они теперь сродни «семечкам», большинство из которых исследователи безусловно «отщелкают» в самое ближайшее время, возможно даже еще до выхода в свет этой книги.
ОПЕЧАТКИ В ДНКовом ТЕКСТЕ (полиморфизм и мутации)
Изменчивость — источник всех отрад, суть музыки и вечности уклад.
Джон Донн
Как великий художник,
природа умеет и с небольшими средствами достигать великих эффектов.
Г. Гейне
Каждый человек уникален, следовательно, уникальным должен быть и его геном. По этой причине между любыми двумя людьми, если они не однояйцовые близнецы, всегда имеются значительные индивидуальные различия (их называют различиями в фенотипе). Они проявляются во многом, в частности, во внешности, в физических возможностях, в отношении предрасположенности к развитию определенных заболеваний, в реакции организма на воздействие факторов окружающей среды или лекарственных средств, в умственных способностях и поведении. Однако, как оказалось, из свыше 3,2 миллиардов генетических букв, из которых состоит ДНК человека, 99,9 процента одни и те же у всех людей. Выходит, что всего от одной десятой процента генома зависит, кто мы есть, — высокие или низкие, красивые или не очень, больные или здоровые, сильные или слабые, умные или глупые, оптимисты или пессимисты, добрые или, наоборот, жестокие и так далее.
Различия между нуклеотидными последовательностями ДНК разных индивидуумов связаны главным образом с тем, что за время длительной человеческой эволюции в нашем геноме накопилось довольно много случайных, вызванных разными причинами, изменений. Эти «опечатки» в ДНКовом тексте, которые каждому из нас достаются от двух родителей в случайном сочетании и наследуются, называют мутациями.
Очень трудно издать книгу (особенно если она большая по объему) без опечаток, хотя в процессе подготовки их тщательно отслеживают и автор, и редактор, и корректор. Известна старая история о споре двух издателей, когда один из них утверждал, что сумеет выпустить книгу без единой опечатки. И, действительно, при самой тщательной проверке в тексте этой книги опечаток не нашли. Но издатель проиграл спор: опечатка была в самом названии книги! И книга, которую сейчас читаете вы, наверняка будет содержать опечатки (хотелось бы только, чтобы их число было минимальным и чтобы их не было в названии).
Мутации в ДНК — естественные наследуемые изменения — опечатки в ДНКовом тексте. Каждый раз, когда клетка в очередной раз делится, необходимо выполнить грандиозную задачу — копировать свыше 3 млрд. букв. В клетке этим занимается целая армия специальных ферментов, которые выполняют свою гигантскую работу в среднем за один рабочий день (7 часов). При этом неправильные буквы первоначально возникают в 10000 участках нового ДНКового текста, а потом эти же ферменты, выступая уже в роли «корректоров», исправляют его. В конечном итоге при копировании ДНК остается только 1 ошибка на 10 млн. п. н. Из этого легко понять, что чем больше раз копируется (реплицируется) ДНК, тем больше в ней накапливается ошибок.
Изменения в структуре ДНК имеют разнообразный характер. В первую очередь это «точковые мутации». Такие мутации представляют собой опечатки в ДНКовом тексте, когда одна из 4 букв выпадает из текста или заменяется на какую-нибудь другую из них. В сумме эти опечатки в масштабах одного генома, как правило, невелики. (Уже говорилось, что мы в среднем отличаемся друг от друга приблизительно в одной позиции нуклеотидов из каждой тысячи). Это явление называют полиморфизмом генома. Отличие между мутациями и полиморфизмом достаточно условно. Когда один из вариантов нуклеотидных последовательностей определенного участка ДНК выявляется более чем у 1% людей в популяции, то такую вариабельность чаще всего называют полиморфизмом, если же менее 1% — просто мутацией.
Мутации могут быть простейшими заменами одного нуклеотида на другой, а могут представлять собой более сложные изменения ДНКового текста, в виде вставки в готовый текст других «букв» и текстов или, наоборот, потери ряда «букв», «слов» или целых «предложений». Изредка отдельные куски ДНКового текста даже переворачиваются. Все это и есть «опечатки». Однако опечатка опечатке рознь. Чаще всего мутации не сказываются заметным образом на фенотипе человека. Это и понятно. В абракадабре, которую из себя представляет свыше 70% ДНКового текста человека, появление 1–2 и даже порой сотни «опечаток» может ровным счетом ничего не менять. Но это не всегда так. Некоторые из них очень сильно влияют на человека.
Этому есть аналогия в лингвистике. Так, существуют слова-паронимы, которые сходны по строению, имеют общий корень, но смысл которых сильно отличается при разнице всего в одной букве. Пример: нового посетителя представляют гостям, но бывают нерадивые хозяева, которые предоставляют гостей самим себе.
Известно и множество случаев из жизни, которые свидетельствуют о важном значении некоторых на первый взгляд незначительных «опечаток». Яркий примером может служить судьба марок бывшей британской колонии — острова Маврикий. В давние времена на этом острове решили вдруг срочно отпечатать свои марки. На этом настояла жена губернатора, которая организовывала пышный прием, а вот марок для приглашений на острове не оказалось. Срочность заказа привела к тому, что гравер в спешке, да еще и спьяну перепутал надпись на марке и вместо «Почтовый сбор оплачен» написал «Почтовая контора». Теперь эти марки стоят у коллекционеров бешеных денег. Такова цена полиграфической опечатки.
Сходная ситуация имеется и в геноме человека. Некоторые «опечатки» в ДНКовом тексте, особенно расположенные в генах или непосредственно рядом с ними, весьма существенны для человека. В качестве примера можно привести широко известный случай одной из мутаций (делеция части ДНКового текста) в человеческом гене CCR5. Укороченный вариант этого гена обеспечивает невосприимчивость людей к вирусу иммунодефицита человека. В результате этого чума XX века — СПИД — таким людям не страшна. В Европе такой вариант довольно широко распространен и достигает в некоторых регионах 9%. А вот в Африке он обнаружен менее чем у 0,1% жителей.
Хотя известны различные виды генетического полиморфизма, однако полиморфизм единичных нуклеотидов является самым распространенным типом вариабельности нуклеотидных последовательностей ДНК. Более того, он оказался наиболее перспективным и для чисто практического применения. Сейчас подсчитано, что в геноме человека приблизительно 3 млн. п.н. должны быть вариабельными. Такие вариабельные (полиморфные) участки были названы снипсами (по-английски snps — от Single Nucleotide Polymorphisms — единичные (сингулярные) нуклеотидные полиморфизмы). Термином «снипсы» обозначаются «точечные» отличия (полиморфизмы) в нуклеотидных последовательностях ДНК различных индивидуумов, вызванные заменой единичного химического звена ДНК-нуклеотида. Постараемся запомнить этот непривычный пока еще термин — далее это нам очень пригодится.
Уже в процессе секвенирования генома человека в 1999 г. был создан специиальный международный консорциум для идентификации и картирования только снипсов — «The SNP Consortium Ltd». Целью нового многосотмиллионного исследовательского проекта стало создание сводной карты, показывающей расположение в геноме человека этих «генетических маркеров». В настоящее время установлены 2,2 млн. снипсов (напомним, что общее их число считается равным 3 млн.). Поскольку гены могут содержать от тысячи до миллиона нуклеотидов, то практически в каждом гене или рядом с ним можно обнаружить один или несколько снипсов. Сейчас выявлено 33,5 тыс. снипсов, расположенных в экзонах, что примерно соответствует общему числу генов у человека. Следовательно, большая часть снипсов (около 99%) расположена в тех участках молекулы ДНК, которые не кодируют синтез белков. По этой причине, как правило, снипсы не имеют существенного биологического эффекта. Хотя это и не всегда так.
Изначально было ясно, что создание карты снипсов — маркеров человеческого генома может стать весьма полезным для проведения различных генетических исследований в медицине и фармакологии, даст ключ к пониманию уникальности личности, роли наследственности в интеллектуальных способностях и чертах характера. И снипсы стали использовать, в первую очередь, в качестве генетических маркеров, поскольку пока нет возможности секвенировать целиком геном каждого индивидуума. Нет сомнения, что в обозримом будущем на этой основе станет возможным создание генетического паспорта каждого человека.
Когда такие опечатки в ДНКовом тексте, как снипсы, не меняют сильно сам текст, их называют нейтральными или «молчащими» мутациями. Однако имеются опечатки, которые так искажают «слова», что их уже невозможно прочесть. Их называют значащими, «говорящими» мутациями. Такие значащие мутации часто приводят к возникновению разнообразных наследственных болезней. Поскольку снипсы достаточно стабильно передаются от поколения к поколению, их можно использовать в качестве маркеров в генетических исследованиях по выявлению связи генов с теми или иными заболеваниями, по пониманию особенностей метаболизма лекарственных веществ у разных пациентов. Так, например, сравнивая «профиль» снипсов в группах больных и здоровых лиц, можно установить, какие из них наблюдаются чаще у пациентов с данным заболеванием. Последующий анализ этих и соседних со снипсами участков ДНК дает возможность идентифицировать гены, которые обусловливают предрасположенность к заболеванию. Таким образом, применение этого метода позволяет ускорить поиск генов, ответственных за развитие заболеваний, сделав его более направленным. В частности, ученые компании «Glaxo Wellcome» уже использовали методику картирования снипсов для выявления генов, принимающих участие в развитии таких распространенных заболеваний, как сахарный диабет II типа, псориаз и мигрень.
Такой же подход можно использовать для выявления у пациентов особенностей метаболизма, распределения или выведения лекарственных средств, то есть для исследований по фармакогеномике (подробнее об этом речь пойдет далее в специальном разделе). Врачи смогут использовать данные генетических исследований для обоснования индивидуального подхода при назначении лекарственных средств, что значительно снизит риск развития побочных реакций. Хотя перспективность такого подхода очевидна, подробная карта снипсов-маркеров пока еще не составлена. Но работа в этом направлении идет очень активно. Составление таких карт человеческого генома сделает в конечном итоге технически возможным проведение быстрого и относительно недорогого генотипирования большого количества пациентов.
Поскольку снипсов в геноме человека довольно много, то было предложено изучать их не только по отдельности, но и группами, в которые объединяются снипсы, расположеные относительно рядом в геноме. Такие наследуемые вместе группы снипсов получили название гаплотипов. Проведенный анализ показал, что число гаплотипов для каждого гена сильно варьирует и может составлять от 2 до 53 (в среднем, по разным оценкам, — от 4 до 14). Было проведено сравнение таких гаплотипов у 21 белого человека, 20 афроамериканцев, 20 человек азиатского происхождения, 18 латиноамериканцев и 3 американских индейцев. В результате не удалось обнаружить вариантов гаплотипов, характерных для той или иной этнической группы. Вместе с тем некоторые варианты чаще встречались у людей, которые родом из одного географического региона.
По оценке ученых компании Genaissance Pharmaceuticals в среднем существует 14 вариаций каждого человеческого гена. Ученые проанализировали 313 генов у большого числа американцев, относящихся к 4 расам. Если в геноме человека присутствует примерно 35 тысяч человеческих генов, следовательно, имеется от 400 до 500 тысяч их вариаций. Обнаружение столь большой амплитуды генетических изменений может потребовать пересмотра традиционных представлений о геноме человека. Сейчас планируется создание каталога гаплотипов каждого человеческого гена. Для этого потребуется проанализировать ДНК у тысяч представителей разных континентов нашей планеты.
Далее мы еще вернемся к вопросу о важности снипсов, когда будем говорить о практических применениях знаний о геноме человека для медицинской геномики и фармакогеномики. Помимо высокой плотности, снипсы имеют очень низкий уровень мутаций на поколение (~10–8), что делает их удобными маркерами для анализа молекулярной эволюции (далее мы поговорим о «молекулярных часах», которые эффективно используются генетиками в геногеографии и эволюционной геномике).
Другой вид полиморфизма генома человека связан с повышенной нестабильностью таких уже упоминавшихся повторов генома, как мини- и микросателлиты. Эта нестабильность проявляется в разном числе повторяющихся элементов в отдельных локусах у разных индивидуумов и приводит к сильному полиморфизму. Уровни нестабильности таких тандемно расположенных повторов значительно отличаются в разных локусах. Особое внимание привлекают к себе гипермутабельные сателлиты. В частности, нестабильность ди- и тринуклеотидных минисателлитов обуславливает так называемые динамические мутации, при которых увеличение числа копий повторяющихся элементов (экспансия) выше некого критического уровня приводит к опухолевому росту клеток и развитию некоторых наследственных нейромышечных заболеваний (миотоническая дистрофия, хорея Хантингтона, болезнь Кеннеди и др.). В результате экспансии число повторяющихся элементов в одном локусе может достигать нескольких тысяч. Например, число тринуклеотидных повторов ЦТГ в гене миотонинпротеинкиназы в норме не превышает 27, а при развитии миотонической дистрофии это число увеличивается обычно в тысячу и более раз. Причины такой нестабильности пока до конца не ясны. Как наиболее вероятный механизм этого явления — «проскальзывание» в ходе репликации ДНК.
Сильная изменчивость мини- и микросаттелитов нашла практическое применение и в так называемой геномной дактилоскопии. Наиболее известный пример ее использования — идентификация останков царской семьи. Подробнее об этом опять же поговорим дальше в специальном разделе.
МОЛЕКУЛЯРНЫЕ ЧАСЫ
Вы говорите — время идет.
Безумцы — это вы проходите.
Талмуд
Достаточно твердо установлено, что большинство из происходящих точечных мутаций в геноме не представляются ни полезными, ни вредными для человека, то есть являются нейтральными. Скачки скорее всего не свойственны эволюции. Частоты возникновения точечных мутаций невысоки (порядка 10–8 на генерацию) и относительно постоянны. Расчеты показывают, что при размере диплоидного генома человека около 7х109 п. н. в нем происходит в среднем 175 новых мутаций на генерацию (25 лет). Накопление мутаций можно сравнить с перетеканием песчинок в песочных часах, которые служат мерой времени. Но на практике ученые применили не песочные, а «молекулярные часы». Поскольку большинство мутаций никак не сказываются на самом организме, они могут спокойно сохраняться в эволюции на протяжении длительного времени. Именно за эти факты и ухватились ученые, когда создавали новый подход, названный «молекулярными часами».
На первом этапе была проведена «юстировка» этих часов. Для этой цели были использованы данные о скорости изменения ДНК разных видов организмов, для которых время расхождения в эволюции было надежно установлено по палеонтологическим и археологическим данным. И только после этого началось «чтение» разных эволюционных глав Энциклопедии человека.
«Молекулярные часы» довольно строго показывают, как часто за миллион лет (в среднем) в ДНК того или иного гена или генома в целом происходят мутации. На этой основе по различиям в ДНК можно судить о том, как давно два разных вида организмов, время возникновения которых не известно, были одним видом, когда произошла их дивергенция, то есть расхождение на две разные ветви эволюции. Таким же путем можно сравнивать человеческие популяции или даже ДНК отдельных людей и судить об общности их происхождения или родственных связях. В частности, по «молекулярным часам» удалось оценить более точно время отделения человека от обезьян. Согласно молекулярной оценке, это произошло примерно 5 млн. лет назад. Это внесло существенную поправку в данные палеонтологов, которые долгое время полагали, что разделение человека и обезьян произошло около 25 млн. лет назад. Массовый анализ митДНК из разных рас показал, что одни митДНК отличаются от других числом замен одних нуклеотидов другими, то есть числом мутаций. Были определены такие показатели, как количество индивидуальных мутаций, их расположение и тип. Эти получившие широкую известность данные выявили общность происхождения всех ныне живущих людей по женской линии. Если читатель не прекратит знакомство с книгой в этом месте, то более подробный рассказ об этих интереснейших исследованиях он найдет далее.
Метод «молекулярных часов», применяемый к ДНКовым текстам, очень похож по своему смыслу на метод глоттохронологии, используемый в лингвистике при установлении родства разных языков. Это специальный статистический метод определения возраста родственных языков, т. е. давности их разделения, по количеству слов, имеющих в этих языках одинаковое происхождение. Ведь язык человека, как и геном человека, все время меняется. Если племя или народ, говорящий на одном языке, по какой-то причине разделится на две части, которые потеряют связь между собой, то язык, как и геном, каждого из этих двух новых племен или народов будет меняться по-своему. Чем больше времени пройдет после разделения двух народов, тем меньше общего сохранится в их языках и геномах, но они по-прежнему останутся родственными. По степени сходства можно судить о том, когда произошло разделение. Лингвисты установили, что за 1000 лет в так называемом базовом словаре (он включает те слова, которые есть в любом языке, — «дом», «земля», «небо», названия частей тела и т. д.) сохраняется 86% слов, т. е. каждый из языков двух народов, обособившихся 1000 лет назад, имеет 86% общих слов с предковым языком. В результате, друг с другом эти языки имеют 74% (86% от 86%) общих слов. При сопоставлении эволюционного древа популяций человека с лингвистическим анализом выяснилось, что в большинстве случаев языки генетически родственных популяций принадлежат к одной лингвистической группе. Вывод ученых гласит: чем раньше разделились две популяции, тем дольше они эволюционировали независимо и тем больше накопилось замен, как в их ДНК, так и в их языках. Конечно, языки напрямую не зависят от генов, и корреляции генетического и лингвистического родства определяются лишь историческими обстоятельствами. Но для нас важно, что здесь одно исследование довольно часто подтверждает другое.
ХРОМОСОМЫ — ОТДЕЛЬНЫЕ ЧАСТИ ЦЕЛОГО (краткие аннотации)
Природа — единственная книга,
на всех своих страницах заключающая
глубокое содержание.
И. Гёте
Итак, мы уже знаем, что Энциклопедия человека состоит из 24 отдельных томов — хромосом, которые исторически были пронумерованы согласно цитологически измеренному размеру: наибольший размер у хромосомы 1 (том № 1) и наименьший — у хромосомы 22 (том № 22). Хотя со временем выяснилось, что хромосома 22 содержит больше ДНК, чем хромосома 21, порядок нумерации томов не стали менять, чтобы не вносить путаницу. Отдельно идут две половые хромосомы: X и Y (условно их можно назвать томами № 23 и № 24). Разные тома Энциклопедии сильно отличаются друг от друга как по числу страниц (размер ДНКового текста в хромосомах человека варьирует от 50 до 280 млн. п. н.), так и по важности того текста, который в них записан (в первую очередь по числу и свойствам генов). Тем не менее, только совокупность всех хромосом обеспечивает клетки полной информацией, позволяющей человеку нормально развиваться и жить.
В Энциклопедии женщин в норме содержится лишь 23 тома из 24-х, и все они представлены в соматических клетках двумя экземплярами. У мужчин же в клетках содержится вся Энциклопедия человека (все 24 тома-хромосомы), но два из них (хромосомы X и Y) существуют в единичных экземплярах. Это весьма строгое правило. Но, как и любое другое, оно не без исключений. В огромной человеческой популяции встречаются разные варианты. Известно множество хромосомных аномалий, и все они приводят к тяжелым хромосомным болезням человека. Их можно разделить на две группы: вызванные геномными мутациями, т. е. изменением числа хромосом (полиплоидии, анеуплоидии) при сохранении структуры последних, и обусловленные хромосомными мутациями, т. е. изменением структуры хромосомы (транслокации, делеции, инверсии).
В отсутствие любой из пар томов-хромосом в Энциклопедии человека жизнь конкретного индивидуума становится невозможной. Причина понятна — исчезает целостный план-эскиз, необходимый для формирования и/или существования организма. При потере по каким-либо причинам только одной из пары хромосом состояние человека сильно отличается от нормы. Так, например, изредка у людей встречается синдром Шерешевского—Тёрнера, который обусловлен моносомией по X-хромосоме. Этот синдром сопровождается недоразвитием половых органов, низким ростом и рядом врожденных пороков развития. Частичная моносомия хромосомы 5 (потеря части короткого плеча этой хромосомы) приводит к синдрому кошачьего крика. У детей с этой аномалией отмечается необычный плач, что обусловлено изменением гортани, а также черепа и лица. Здесь можно провести такую аналогию. Если в типографии при плохом издании многотомного произведения произойдет потеря лишь одного из томов или только части текста в одной из глав, это сделает издание неполноценным и существенно обеднит его для читателя.
С другой стороны, трудно себе представить, что кто-то, покупая многотомное издание, приобретет какой-то том в двойном количестве. Иногда при издании книг в результате типографических ошибок значительная часть текста повторяется несколько раз, что, безусловно, плохо характеризует издательство и вызывает раздражение у читателя. Такое же «раздражение» возникает и в клетках организма при появлении в нем изредка в силу тех или других причин большего числа томов-хромосом, чем в норме. Вроде бы ничего страшного не произошло — просто определенная информация дублировалась. Но и это чаще всего приводит к серьезным патологиям. Наиболее известная из них — болезнь Дауна, возникающая у людей, содержащих три хромосомы 21 (трисомия) вместо двух. Клинический синдром Клайнфелтера обусловлен трисомией XXY.
В таблице 5 приведены общие сведения о размерах молекул ДНК, содержащихся в отдельных хромосомах, суммарном числе генов в каждой из хромосом и количестве генов, которые к настоящему времени ассоциированы с разнообразными патологиями человека, а также о числе снипсов, о которых мы уже упоминали выше.
Представленные в таблице 5 данные на сегодняшний день отражают хотя и довольно точную, но пока еще некую приближенную к абсолютной ситуацию (до сих пор имеются небольшие отличия при сравнении разных источников и разных баз данных). Предстоит еще полностью закончить секвенирование генома человека, затем необходимо найти и изучить функции всех генов и других элементов генома. Поэтому пока еще нельзя дать полную и окончательную характеристику всех томов Энциклопедии человека. Но тем не менее общий план уже ясен, уже выявлены некоторые хромосомо-специфические моменты, особенности устройства отдельных хромосом.
Одной из целей исследования генома человека являлось построение точной и подробной карты всех этих хромосом. Генетическая карта представляет собой схему, описывающую порядок расположения на хромосоме генов и других генетических элементов-маркеров, а также расстояние между ними. Карты генома, как и географические карты, можно строить в разном масштабе. Максимально возможный уровень разрешения, достигаемый на генетической карте, — один нуклеотид, т. е. одна буква молекулы ДНК. В таком варианте генетическая карта не менее точна, чем, скажем, химическая формула, алгоритм или чертеж. Но для изображения таких карт генома человека требуется несколько сотен тысяч книг.
На рис. 29 изображены карты всех хромосом человека в уменьшенном масштабе, позволяющем наглядно отразить ряд основных параметров, характерных для хромосом: распределение снипсов, распределение установленных и гипотетических генов, расположение повторов, а также количество ГЦ-пар нуклеотидов в разных участках. Если эти карты рассматривать по отдельности, то может сложиться впечатление, что они очень похожи. Но при детальном сравнении выясняется, что на самом деле они существенно отличаются. «Узоры» расположения разных элементов на представленных картах весьма индивидуальны для разных хромосом, их можно сравнить с папиллярными узорами пальцев, которые строго специфичны для каждого человека.
Таблица 5. Общая характеристика хромосом — Из базы данных Ensembl http://www.ensembl.org (октябрь 2002 г.)

Теперь дадим по отдельности краткие аннотации содержанию ДНКовых текстов человека, расположенных в 24 томах-хромосомах. Начнем по порядку, т. е. с самой большой хромосомы под номером 1.
Хромосома 1
Эта наибольшая по физическим размерам и по содержанию ДНК хромосома человека. На ее долю приходится почти 10% генома человека. Поскольку хромосома 1 самая большая, то вполне естественно, что в ней содержится больше всего генов и больше всего снипсов, то есть полиморфных участков. По последним оценкам число генов в этой хромосоме приближается к 3000. Гены и снипсы расположены неравномерно вдоль хромосомы, они практически отсутствуют в области центромеры.
Подавляющая часть снипсов концентрируется в трех участках хромосомы 1. В этой хромосоме имеется множество (порядка 160) генов, связанных с разнообразными заболеваниями человека. Многие из этих болезней едва ли знакомы читателю, но для тех, кто с ними столкнулся в жизни, они являются как правило очень большой бедой. Перечислим лишь некоторые из них, связанные с генами хромосомы 1: болезнь Альцгеймера, нейропатия–2а, болезнь Гоше, синдром Чедиака—Хигаси, рак протоков молочной железы, кардиомиопатия, катаракта, эктодермальная дисплазия, гипотироидизм, острая лимфобластная лейкемия, нейробластома, рак простаты, атеросклероз.
Хромосома 2
Это вторая по размерам хромосома. Наибольшая плотность снипсов имеется в районе центромеры, а вот повторы здесь практически отсутствуют. На единицу длины в ней содержится заметно меньше генов, чем в хромосоме 1 и ряде других хромосом. Тем не менее, число заболеваний, связанных с мутациями в генах этой хромосомы, достаточно большое. Вот некоторые из них: синдром Альстрема, голопрозенцефалия 2, дистрофия большеберцовой мышцы, аутосомно-рецессивная глухота–9, дистрофия мышц конечности 2b, рак прямой кишки, цистинурия, диабет, фиброматозис, гипотироидизм, ожирение, болезнь Паркинсона, тромбофилия, синдром Валленберга, синдром Гилберта и др.
Хромосома 3
Это еще одна довольно большая хромосома. В отличие от хромосомы 2 у нее в области центромеры содержится мало как снипсов, так и повторов. Наибольшее количество снипсов расположено ближе к концам этой хромосомы, а наибольшее число генов — на коротком плече. Гены, содержащиеся в этой хромосоме, связаны с более чем 90 различными заболеваниями, среди которых можно отметить такие, как кардиомиопатия, рак прямой кишки, колоректальный рак, диабет, гемолитическая анемия, гипокальцемия, миелоидный лейкоз, В-клеточная лимфома, миотоническая дистония, карцинома почки, шизофрения.
Хромосома 4
Гены, повторы и снипсы распределены в хромосоме 4 довольно равномерно (за исключением района центромеры, где все они представлены малым количеством). Подсчитано, что общее число генов здесь меньше, чем в среднем на единицу длины генома. Среди заболеваний, ассоциированных с мутацями в генах этой хромосомы, можно отметить такие, как дисфибриногенемия, болезнь Хантингтона, синдром Эллиса—Ван-Кревельда, гипохондроплазия, гипогонадизм, маннозидозис, болезнь Паркинсона, фенилкетонурия, синдром Ригера, острый иммунный дефицит, синдром Вольфрама, склонность к алкоголизму и др.
Хромосома 5
Большинство генов этой хромосомы сконцентрировано в двух областях длинного плеча и одном районе короткого ближе к его концу. Имеются два района, расположенных вокруг центромеры, обогащенные снипсами. C генами хромосомы 5 связан ряд тяжелых заболеваний: мегалопластическая анемия, колоректальный рак, капиллярная гемангиома, дистрофия роговицы, аутосомно-доминантная глухота, синдром Гарднера, болезнь Гиршспрунга, кетоацитоз, острая промиелоцитная лейкемия, мышечная дистрофия, миелодиспластический синдром, астма и др.
Хромосома 6
Плотность и генов и снипсов наибольшая в нескольких районах на коротком плече этой хромосомы, а вот повторы распределены вдоль хромосомы довольно равномерно (их мало только в области центромеры). C генами хромосомы 6 связан ряд патологий человека: диабет, спиноцеребральная атрофия, гемолитическая анемия, аргининемия, дислексия, гепатоцеллюлярная карцинома, лейкемия, множественная миелома, болезнь Паркинсона, тромбофилия, чувствительность к туберкулезу и др.
Хромосома 7
Плотность снипсов наибольшая в прицентромерной области длинного плеча этой хромосомы. А вот гены расположены довольно равномерно вдоль хромосомы, за исключением одного участка в середине длинного плеча, где содержится наибольшее их количество. Среди заболеваний, ассоциированных с генами хромосомы 7, можно отметить такие, как хронический грануломатоз, рак прямой кишки, кистозный фиброз, аутосомно-доминантная глухота, вялая кожа, эритремия, гемолитическая анемия, карликовость, фамильный гиперинсулинизм, врожденная миотония, остеопороз, панкреатит, трипсиногеновая недостаточность, болезнь коронарной артерии и др.
Хромосома 8
Большинство снипсов в этой хромосоме сконцентрировано на конце короткого плеча, а на конце длинного плеча имеется область, сильно обогащенная генами. Число генов, ассоциированных с заболеваниями, в хромосоме 8 относительно небольшое. Среди них имеются гены, мутации в которых приводят к таким заболеваниям, как хондросаркома, эпилепсия, гипотироидизм, синдром Пфаффера, восприимчивость к атеросклерозу, синдром Вернера, лимфома Беркитта, сфероцитоз и ряд других.
Хромосома 9
Здесь и снипсы, и повторы, и гены распределены очень неравномерно вдоль хромосомы. Кроме того, хромосома 9 обогащена снипсами по сравнению с другими хромосомами (при расчете их числа на единицу длины). При этом наибольшее их число сконцентрировано в прицентромерной области длинного плеча. Одновременно эта же область, наоборот, обеднена повторами. Целый ряд заболеваний ассоциирован с мутацями в генах хромосомы 9: альбинизм, карцинома базальных клеток, недостаточность карнитинацетилтрансферазы, торзионная дистония, эпителиома, гиперглицинемия, ангиомиолипома, галактоземия, хроническая миелоидная лейкемия, меланома, порфирия, стоматоцитоз, синдром Валкера—Варбурга.
Хромосома 10
Эта хромосома является средней по числу содержащихся в ней генов, повторяющихся участков и снипсов на единицу длины, но распределение их по хромосоме далеко не равномерное: несколько участков на длинном плече сильно обогащены генами и снипсами. Среди заболеваний, ассоциированных с этой хромосомой, можно отметить такие, как кардиомиопатия, почечная гиперплазия, катаракта, болезнь Гиршспрунга, синдром Джексона—Вейсса, острая Т-клеточная лейкемия, болезнь Гоше, глиобластома, гиперфенилаланинемия, эндокринная неоплазия, наследственная нейропатия, аденокарцинома простаты, шизэнцефалия, орнитинаминотрансферазная недостаточность.
Хромосома 11
На конце короткого плеча и в прицентромерном районе длинного плеча этой хромосомы имеет место концентрация генов. Содержание снипсов повышено лишь в районе конца короткого плеча, а вдоль хромосомы оно относительно одинаковое. От общего числа генов этой хромосомы доля генов, с которыми ассоциированны различные патологии, здесь одна из наибольших. Среди заболеваний, определяемых генными мутациями в хромосоме 11, имеются такие, как альбинизм, амилоидоз, злокачественная анемия, не-Ходжкинская лимфома, рак груди, рак мочевого пузыря, рак простаты, глухота, эритремия, гиперпротромбинемия, острый комбинированный иммунодефицит, мужское бесплодие, множественная миелома, аномалия Петерса, серповидноклеточная анемия, талассемия, тромбоцитопения, пигментная ксеродерма, адренокортикальная карцинома, наследственная ангоидемия, гиперпроинсулинемия, параганглиома, паратироидный аденоматоз, остеопороз и др.
Хромосома 12
Эта хромосома является средней по большинству параметров. Гены распределены в ней весьма неравномерно. С ними ассоциирован ряд заболеваний: адренолейкодистрофия, амилоидозис, злокачественная неходжкинская лимфома, рак прямой кишки, эмфизема, энурез, задержка роста, гемолитическая анемия, кератодерма, липома, множественный липоматоз, наследственная миопатия, остеоартроз, фенилкетонурия, аденома слюнных желез, синдром Вагнера, болезнь фон Виллебранда, гистидинемия и др.
Хромосома 13
Короткое плечо этой хромосомы пока плохо секвенировано. Имеется концентрация снипсов в районе центромеры на длинном плече. Хромосома 13 относительно других хромосом обеднена генами (на 1 млн. букв в ней в среднем приходится всего около 5 генов). Наибольшее их количество содержится на обоих концах длинного плеча. Тем не менее, ряд тяжелых заболеваний ассоциирован с мутацями в генах этой хромосомы: рак мочевого пузыря, глухота, недостаточность факторов свертываемости крови VII и X, мышечная дистрофия, панкреатический агенезис, рак поджелудочной железы, пинеалома, ретинобластома, болезнь Вилсона, пигментная ксеродерма и др.
Хромосома 14
По картине распределения генов, повторяющихся последовательностей и снипсов эта хромосома весьма напоминает хромосому 13. Ее короткое плечо также долгое время (до января 2003 г.) не было секвенировано. Но по числу генов различия между двумя этими хромосомами значительны (в хромосоме 14 их примерно в два раза больше на единицу длины). В хромосоме 14 содержатся гены, важные для работы иммунной системы. C мутациями в ее генах (их около 60) связан ряд серьезных заболеваний: ранняя форма болезни Альцгеймера, разные формы потери слуха, кардиомиопатия, дистония, эллиптоцитоз, фибродисплазия, гипертироидизм, сфероцитоз, фенилкетонурия, тироидная аденома, температурочувствительный апоптоз, агаммаглобинемия.
Хромосома 15
Эта хромосома тоже пока секвенирована не полностью. В ней имеется несколько областей, обогащенных снипсами и генами, которые расположены в разных участках длинного плеча. Микроделеции в определенном районе хромосомы 15 приводят к возникновению синдрома Эйнджелмена и синдрома Прадера—Вилли. Выявлен большой спектр заболеваний, ассоциированных с мутацями в генах этой хромосомы: альбинизм, синдром Барттера, синдром Блюма, гинекомастия, острая промиелоцитная лейкемия, гипомеланоз, мышечная дистрофия, шизофрения, тирозинемия, эпилепсия и ряд др.
Хромосома 16
В этой хромосоме содержание генов на единицу длины выше среднего по геному. Большинство генов, как и большинство снипсов, сконцентрировано в 5–6 областях хромосомы. C генами хромосомы 16 связан ряд серьезных генетических заболеваний, таких, как рак груди, рак желудка, синдром Гительмана, хронический грануломатоз, эритроцитоз, болезнь рыбьих глаз, гепатический гликогенез, альфа-талассемия, поликистозная болезнь почек, миелоидная лейкемия, карцинома яичника, спастическая параплегия, тирозиемия, мукополисахароидоз, синдром Лиддла, болезнь Моркио и др.
Хромосома 17
Здесь также имеет место довольно высокое содержание генов по сравнению с другими хромосомами (при пересчете на единицу длины). Выявленные гены, так же как и повторы и снипсы, распределены вдоль хромосомы неравномерно. Большинство снипсов содержится в районах длинного и короткого плечей, прилежащих к центромере. Ряд заболеваний ассоциирован с мутацями в генах этой хромосомы: спорадический рак груди, рак прямой кишки, диабет, буллезный эпидермолиз, гемолитическая анемия, эссенциальная гипертония, рак языка, острая лейкемия, мышечная дистрофия, миостенический синдром, миелопероксидазная недостаточность, наследственная миотония, нейробластома, рак яичника, синдром Ватсона и др.
Хромосома 18
Как общее число генов, так и число генов, мутации в которых связаны с патологиями человека, в ней относительно невелико. В области центромеры практически отсутствуют гены, повторы и снипсы. Можно отметить концентрацию снипсов в прицентромерной области короткого плеча этой хромосомы. Среди заболеваний, ассоциированных с этой хромосомой, имеются амилоидоз, рак прямой кишки, буллезный эпидермолиз, рак поджелудочной железы, B-клеточная лейкемия/лимфома, эритропоэтическая протопорфирия и др.
Хромосома 19
ДНК, входящая в эту хромосому, имеет размер около 67 млн. п. н. Ее особенностью является то, что она наиболее богата ГЦ-парами нуклеотидов по сравнению с другими хромосомами человека. В ней также содержится большее, чем теоретически можно было рассчитать, число генов и подобных им участков (экспрессирующихся последовательностей, так называемых ESTs), что находится в соответствии с высоким ГЦ-содержанием ДНК этой хромосомы (на 1 млн. п.н. приходится 23 гена при среднем значении по геному около 10). Еще одно отличие этой хромосомы от других заключается в том, что в ней имеются последовательности, которые гомологичны последовательностям, расположенным на шестнадцати других хромосомах человека. Кроме того, для хромосомы 19 характерна наибольшая плотность расположения минисателлитов. Среди заболеваний, ассоциированных с этой хромосомой, имеются такие серьезные патологии, как гипертрофическая кардиомиопатия, рак прямой кишки, церебральная артериопатия, сахарный идиопатический диабет, гиперлипопротеинемия, наследственный гипотироидизм, острая лимфобластная лейкемия, миотоническая дистрофия, эритроцитоз, атеросклероз коронарной артерии и многие др.
Хромосома 20
Хромосома 20 стала третьей по времени полностью секвенированной хромосомой человека. По размеру эта хромосома составляет всего около двух процентов генетического кода генома человека. Гены, повторы и снипсы распределены вдоль хромосомы весьма неравномерно. В настоящее время выявлено, что в хромосоме 20 наряду с 600–700 генами, расположенными в нескольких основных областях, содержится множество (около 170) псевдогенов. Гены этой хромосомы несут информацию о ряде заболеваний человека, начиная от ожирения и экземы и заканчивая слабоумием и катарактой. С мутациями в генах хромосомы 20 связаны такие генетические заболевания, как болезнь Крейтцфельда—Якоба, тяжелые нарушения иммунной системы, болезни сердца, астма, скелетная дисплазия, гепатопленомегалия, диабет и др.
Хромосома 21
Эта хромосома является самой маленькой по размерам и информационной емкости (на ее долю приходится не более 1,5% от всего генома человека). Но секвенирована она была только вслед за хромосомой 22. Число генов в хромосоме 21 относительно невелико. При размере около 50 млн. пар нуклкотидов в ней обнаружено пока только около 200 генов. Для сравнения, 22-ая хромосома при чуть большем размере (56 млн. пар нуклеотидов) содержит почти 500 генов. Иногда говорят, что 21-ая хромосома представляет из себя «геномную пустыню». В ней, например, есть участок длиной в 7 млн. пар нуклеотидов (это больше полного генома бактерии Escherichia coli), содержащий только один ген. Имеющиеся гены концентрируются главным образом на конце длинного плеча, а снипсы — в области центромеры.
Хромосома 21 хорошо известна тем, что при наличие в клетках трех ее копий возникает болезнь Дауна. Предполагается, что из-за малого числа генов в этой хромосоме люди, больные синдромом Дауна, доживают до взрослого состояния (тогда как дети с тремя копиями других хромосом, кроме половых хромосом X и Y, после рождения живут всего несколько дней).
Мутации в генах хромосомы 21 способны вызывать такие серьезные болезни, как голопрозэнцефалию, синдром Ушера и некоторые формы злокачественных опухолей.
Хромосома 22
ДНК этой хромосомы была секвенирована первой (декабрь 1999 г.), поэтому она и описана более полно. В хромосоме 22 остались нерасшифрованными всего несколько участков (менее 3% длины ДНК). Она содержит около 500 генов и 134 псевдогена. Все эти генные последовательности вместе с внутригенными некодирующими районами (интронами) составляют всего 13 млн. п. н. Среди генов, присутствующей в хромосоме 22, имеются такие известные, как гены иммуноглобулинов, генные семейства, кодирующие различные ферменты, аполипопротеины и кристаллины. Подсчитано, что средний размер гена этой хромосомы — 19,2 тыс. п. н., хотя самый маленький состоит лишь из 1 тыс. п. н, а самый большой — из 583 тыс. п. н. Несколько генов содержат только один экзон, но, с другой стороны, имеется ген, состоящий аж из 54 экзонов. Величины экзонов варьируют от 8 до 7,6 тыс. п. н. Установлено, что два известных гена локализованы в протяженных интронах двух других генов («генные матрешки»). Что касается псевдогенов, на их долю приходится всего 204 тыс. п. н., причем большинство — это процессированные псевдогены, т. е. у них отсутствуют интроны. Установлено, что псевдогены хромосомы 22 в основном относятся к семействам иммуноглобулинов, кристаллинов, цитохромов и др. Обнаружен только один кластер, состоящий из 26 псевдогенов, рядом с центромерной областью хромосомы. Математическая обработка полученных данных показала, что еще определены не все гены и псевдогены хромосомы 22. Различные повторяющиеся последовательности, которые не кодируют белки, составляют 41,9% этой хромосомы. Alu-повторы формируют блоки в районе центромеры и почти в центре длинного плеча.
Для хромосомы 22 в настоящее время установлены функции примерно половины генов. Около 160 генов, расположенных на хромосоме 22, показывают значительную гомологию с генами мыши. Несмотря на свои небольшие размеры и малое число генов, ее патология установлена при некоторых генетических и онкологических заболеваниях. Сейчас известно 27 заболеваний, вызванных нарушениями в разных генах хромосомы 22 человека: от рака (миелоидная лейкемия) до предрасположенности к шизофрении и паркинсонизму, а также серьезных аномалий сердца и нервной системы. Известны многочисленные геномные и хромосомные мутации, связанные с этой хоромосомой. Так, трисомия (три вместо двух копий) хромосомы 22 вызывает синдром «кошачьего глаза» (колобома радужной оболочки), атрезию ануса, некоторые пороки развития и умственную отсталость. Трисомия хромосомы 22 — вторая по значению причина выкидышей у беременных. Выпадение (делеция) одного из районов длинного плеча (22q11.2) приводит либо к синдрому Ди Джорджи, который сопровождается аплазией тимуса, пороками сердца и аномалиями развития, несовместимыми с жизнью, либо, если делеция меньших размеров, к велокардиофациальному синдрому с характерными пороками сердца и крупных сосудов. При лейкозах и лимфомах также выявлены трисомии и моносомии, обмены участками (транслокации) различных хромосом и хромосомы 22. Самый известный пример — филадельфийская хромосома, образованная в результате транслокации между хромосомами 9 и 22. В солидных опухолях также достаточно часто обнаруживают различные транслокации с вовлечением хромосомы 22.
Хромосома X
Это женская половая хромосома. Наличие двух хромосом X определяет женский пол. Пара для хромосомы X у мужчин — омертвевшая и короткая Y-хромосома. У женщин в одной из 2 хромосом X происходит инактивация всех тех генов, которые не имеют пары на хромосоме Y. В ходе эмбрионального развития эта хромосома на всех нужных участках покрывается особым инактивирующим белком Xist или сжимается «пеленкой» белка-гистона так туго, что не может работать. Генов в хромосоме X немного, и они сосредоточены, главным образом, в двух областях: прицентромерном районе короткого плеча и на конце длинного плеча. Снипсы концентрируются в середине длинного плеча хромосомы. Укажем лишь на небольшую часть заболеваний, ассоциированных с генами хромосомы X: мышечная дистрофия Дюшенна, сидеробластическая анемия, рак груди, рак простаты, кардиомиопатия, хориоидеремия, дискератоз, эпилепсия, глицеролкиназная недостаточность, гонадотропиновая недостаточность, гемофилия В, ихтиоз, синдром Барта, мукополисахароидоз 2.
Y-хромосома
Эта маленькая половая хромосома определяет мужской пол у человека. Содержащиеся в ней последовательности рассматривают как очень «юные». Скорости мутаций в этой хромосоме в 4 раза выше, чем в хромосоме X. Гены, повторы и снипсы выявлены лишь на левом конце этой хромосомы (правый пока не полностью секвенирован). Здесь содержится большое число палиндромов. По этой причине появилось даже выражение: «Y-хромосома — зал зеркал». А вот генов в ней немного. По последним уточненным данным их максимальное число не достигает и 100. На 1 млн. букв-нуклеотидов в среднем приходится всего около 5 генов. Основная роль тех генов, которые имеются, заключается в контролировании дифференцировки пола, формировании яичек и процесса сперматогенеза. В частности, основной ген «самцовости», названный SRY (Sex-determining Region of Y), кодирует белок, который включает в работу многие гены других хромосом и тем самым вызывает каскад биохимических реакций (конечный результат — образование яичек). Ген SRY практически одинаков у всех людей, но в десять раз более отличен у людей и обезьян, чем все другие их гены. Иными словами, на сегодняшний день это самый консервативный ген внутри вида и самый динамичный между видами. Отмечены случаи, когда в клетках имеется не одна, а две и даже 3 копии хромосомы Y. Характерными признаками такой хромосомной патологии являются асоциальное поведение и различные психологические нарушения, характерные для 35% больных. Совсем немного генов в хромосоме Y ассоциировано с болезнями человека. Основные из них — гонадный дисгенез и синдром клеток Сертоли.
25-я ХРОМОСОМА — ВАЖНОЕ ДОПОЛНЕНИЕ (митохондриальный геном)
Мал золотник, да дорог.
Русская поговорка
Когда сейчас громогласно заявляют о полном секвенировании генома человека, то, как правило, подразумевают ядерный геном. На этом фоне как-то забывается, что в клетках имеются молекулы ДНК, расположенные не только в хромосомах, но и в таких уже упоминавшихся специфических внутриклеточных структурах, как митохондрии. И это тоже геном человека, но он называется митохондриальным, а ДНК — митохондриальной (сокращенно митДНК). МитДНК теперь называют иногда хромосомой 25 или М-хромосомой. Эта ДНК была секвенирована еще в 1981 году уже упоминавшимся Ф. Сенгером, что тоже было в свое время сенсацией, которая, однако, имела резонанс несопоставимо меньший, чем секвенирование ядерного генома. Что же представляет собой эта 25-ая хромосома человека?
В клетке человека насчитывается от 100 до 1000 митохондрий, в каждой из которых содержится от 2 до 10 молекул кольцевой митДНК длиной 16569 п. н. Таким образом, размер митохондриального генома примерно в 200 000 раз меньше ядерного. Интересно, что размер митДНК у человека — один из наименьших среди высших организмов (эукариот). Например, у дрожжей митДНК состоит из 78520 п. н. Человеческая митДНК содержит 37 генов, кодирующих 13 белковых цепей, 22 тРНК и 2 рибосомных РНК (рРНК) (рис. 30). Белковые цепи входят в состав белков, которые участвуют в основном в важнейшем внутриклеточном процессе, называемом окислительным фосфорилированием, который обеспечивает клетку энергией. За счет окислительного фосфорилирования в митохондриях осуществляется производство более 90% специальных молекул АТФ, являющихся основой энергетики клетки.
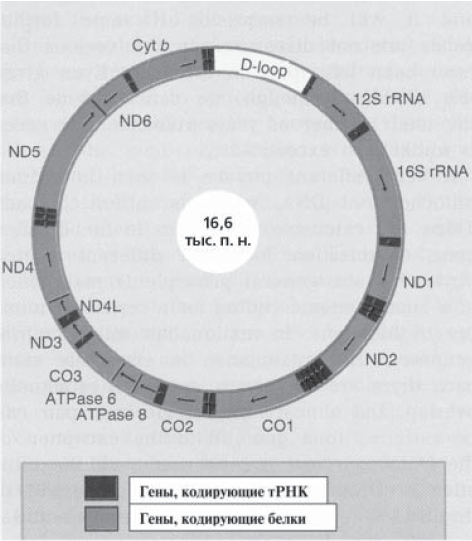
Рис. 30. Структура митохондриального генома человека (митДНК). В митДНК содержится 22 гена, кодирующих тРНК, 2 рибосомных гена (16S и 12S рРНК) и 13 белок-кодирущих генов. Стрелками указано направление транскрипции генов. Сокращения: ND1—ND6, ND4L — гены субъединиц НАД-Н-дегидрогеназного комплекса; COI—COIII — гены субъединиц цитохром-с-оксидазы; ATP6, ATP8 — гены субъединиц АТФ-синтетазы; Cyt b — ген цитохрома b
Всего же в процессе окислительного фосфорилирования задействовано 87 генов, но все недостающие 74 кодируются не митохондриальным, а ядерным геномом. Интересно, что в ядерном геноме обнаруживаются участки, подобные митДНК. Предполагается, что в процессе эволюции и при различных патологиях имела место миграция части митДНК в ядерный геном.
Важно, что устройство митохондриального генома существенно отличается от ядерного. В первую очередь, для митДНК характерно очень компактное расположение генов, как и в геноме бактерий. В отличие от ядерного генома митохондриальные гены соседствуют друг с другом и между ними практически отсутствуют межгенные промежутки. В ряде случаев они даже перекрываются на один нуклеотид: последний нуклеотид одного гена оказывается первым в следующем за ним. То есть гены набиты в митохондриальной ДНК, как сельди в бочке. Кроме того, большинство митохондриальных генов не содержит такие характерные для ядерных генов структуры, как интроны. Но это еще не все отличия. Выяснилось, в частности, что митДНК не подвержена такой модификации, как метилирование, которая характерна для ядерной ДНК.
Однако особенное удивление исследователей вызвал генетических код, используемый в митДНК. Хотя генетический код универсален (за очень небольшим исключением) во всем живом мире, в митохондриях используется некий его необычный вариант. Большинство кодонов в митохондриальных генах сходны с теми, которые имеются в ядерной ДНК, но наряду с этим имеются и принципиальные отличия. В митДНК человека изменили свой смысл четыре кодона. Терминирующими стали кодоны АГА и АГГ. Кодон УГА, являющийся в ядерной ДНК терминирующим, в митДНК не только не вызывает остановки трансляции, а кодирует аминокислоту триптофан. Аминокислоту метионин кодируют не один кодон АУГ, а еще кодон АУА, который в ядерном геноме кодирует аминокислоту изолейцин.
МитДНК ответственна в клетке за синтез всего лишь нескольких митохондриальных белков. Но эти белки очень важны для клетки, поскольку участвуют в осуществлении одного из важнейших процессов — обеспечении клетки энергией. Таким образом, митДНК — весьма ценное приложение к Энциклопедии человека. Белки, кодируемые непосредственно генами митДНК, синтезируются тут же в митохондриях. Для этой цели используется собственная РНК-полимераза и собственный аппарат белкового синтеза. Причина ясна — генетический код митохондрий особый, нужна и особая система биосинтеза.
Далеко не все белки, которые нужны для автономного существования митохондрий, кодируются митохондриальным геномом и синтезируются здесь же. Для этого их геном слишком мал. Большая часть митохондриальных белков и отдельных субъединиц этих белков кодируется основным, т. е. ядерным геномом и синтезируется в цитоплазме клеток. Затем они транспортируются в митохондрии, где взаимодействуют со специфическими белками, кодируемыми митДНК. Таким образом, между ядерным и митохондриальным геномом существует тесная взаимосвязь, они дополняют друг друга.
Почему в эволюции клетки случилось так, что очень небольшая часть ДНК содержится не в хромосомах ядра, а отдельно внутри митохондрий? В чем необходимость или преимущество такого распределения генетического материала, пока неизвестно. Для объяснения этого удивительного факта было придумано много гипотез. Одну из первых еще в далеком 1890 году высказал Р. Альтман. Однако она и на сегодняшний день сохранила актуальность. Согласно этой точке зрения, митохондрии появились в клетках высших организмов не в ходе внутриклеточного развития и дифференцировки, а в результате естественного симбиоза высших организмов с низшими аэробными организмами. Такое объяснение предполагает, что митохондриальный генетический код более древен, чем код, используемый в ядерной ДНК у современных организмов.
Но наряду с этим высказывалась и иная точка зрения, которая пока в равной мере имеет право на существование. Согласно последней, после перехода большинства генов из митДНК в ядерную ДНК в аппарате, обеспечивающем синтез белка в митохондриях, произошли какие-то мутации. Для того, чтобы процесс трансляции не нарушался, потребовались специальные мутации в генах митДНК, которые бы «компенсировали» нарушения и позволили бы измененному аппарату белкового синтеза осуществлять свою работу. Если исходить из этого предположения, тогда митохондриальный код следует рассматривать не как более древний, а, наоборот, скорее как более молодой.
В любом случае язык митДНК — это в определенном смысл «жаргон». Зачем он нужен митохондриям? Здесь можно провести параллель с жаргонами определенных социальных или профессиональных групп. Жаргон используется ими для сокрытия своих намерений и действий от посторонних, избежания чужого вмешательства в их дела. Возможно, и митДНК, благодаря использованию видоизмененного кода — жаргона, — изолируется от белок-синтезирующиего аппарата клетки, специализируясь на выполнении одной, но очень важной для клетки функции — производстве энергии.
Замечено, что митохондриальный геном более раним, чем ядерный геном. В результате в нем часто происходят различного рода мутации (точковые мутации, небольшие потери ДНК — делеции и, наоборот, вставки — инсерции). Сейчас уже установлены многочисленные болезни человека, связанные с изменениями в митДНК. Патологические мутации обнаружены почти во всех митохондриальных генах. При этом отмечают огромное разнообразие клинических признаков, обусловленных одним и тем же молекулярным повреждением. Обнаружена взаимосвязь некоторых мутаций и изменений в экспрессии генов митДНК с возникновением рака. В частности, неоднократно отмечалось при раке груди и лимфомах усиление транскрипции гена, кодирующего одну из цепей белкого комплекса, участвующего в снабжении клеток энергией (субъединицы II цитохром-с–оксидазы). Некоторые, к счастью, редкие, тяжелые наследственные болезни человека также обусловлены мутациями в отдельных генах митДНК. В России сейчас существует специальная программа диагностики и профилактики митохондриальных болезней.
Еще один удивительный факт, связанный с митДНК, касается ее наследования. Оказалось, что митДНК передается из поколения в поколение принципиально иначе, чем хромосомная ДНК. Организм человека развивается из оплодотворенной яйцеклетки, которая содержит хромосомы обоих родителей. При оплодотворении в яйцо проникает сперматозоид с набором отцовских хромосом, но практически без отцовских митохондрий и, следовательно, без какой-либо отцовской митДНК. Только яйцеклетка предоставляет зародышу свою митДНК. Это ведет к важным последствиям: митДНК передается только по женской линии. Мы все получаем митДНК только от своей матери, а она еще раньше от своей, и так далее в ряду только женских поколений. Сыновья в отличие от дочерей не передают свою митДНК — цепочка оборвется. Таким путем ДНК образуют клоны — наследственные линии, которые могут только разветвляться (если у женщины родилось несколько дочерей), но в отличие от хромосомной ДНК не могут объединяться в одном организме и создавать новые генетические комбинации. По этой причине было интересно провести сравнение митДНК у представителей различных человеческих этнических популяций, то есть рас и народностей. Такого рода сравнения были начаты еще в конце 80-х годов прошлого века и продолжаются до сих пор. Подробнее мы еще поговорим об этом далее.
Таким образом, такие базовые процессы в клетке, как транскрипция, трансляция, репликация и репарация митДНК, в значительной мере зависят от ядерного генома, но пока не до конца ясно, как эти два генома интегрированы друг с другом. Изучение механизмов межгеномного взаимодействия может стать полезным во многих отношениях, в частности для понимания интегральной картины различных патологий человека, включая и злокачественное перерождение клеток.
ЧАСТЬ II. ФУНКЦИЯ ГЕНОМА ЧЕЛОВЕКА
КОРОЛЕВА УМЕРЛА — ДА ЗДРАВСТВУЕТ КОРОЛЕВА!
То, что мы знаем, — ограниченно,
а то, чего мы не знаем, — бесконечно.
П. Лаплас
Наука всегда оказывается не права.
Она никогда не решит вопроса,
не поставив при этом десятка новых.
Б. Шоу
Итак, грандиознейший проект человечества под названием «Геном человека» успешно завершился, и, как принято считать, Энциклопедия человека вчерне написана. Конечно, трудно переоценить важность этого события. Некоторые сравнивают его с первым полетом на Луну, другие признают одним из наиболее значимых достижений науки в истории прошедшего тысячелетия. И все эти оценки не преувеличены. Но теперь это уже пройденный этап. Определение полной последовательности нуклеотидов ДНК всех хромосом человека дала нам в руки огромную информацию, которой, однако, предстоит пользоваться и расшифровывать долгие годы. Условно говоря, проделана работа по засеву и удобрению поля, на котором вскоре можно ожидать богатый урожай. В руки человека попала гигантская библиотека, которая создавалась долгие годы, и разрозненные тома которой выходили много лет. Торжества по случаю завершения этой работы напоминают забивание «серебряного костыля» на протяженной железной дороге, по многим отдельным участкам которой движение давно уже было налажено, но до полного освоения которой еще потребуются огромные многолетние усилия. Ведь ДНКовый текст генома человека пока лишь только «считан» со сверхминиатюрного природного носителя информации — ДНК — и занесен на обычные электронные — компьютерные базы данных. При этом мы пока еще не владеем полностью «грамотой» генетического языка, скрывающего многочисленные секреты человека. Вот в чем причина, почему нельзя говорить, как это часто делают журналисты (да и мы иногда говорили выше ради красного словца), что геном человека расшифрован. Он не расшифрован, а только прочитан, или выражаясь по-научному, — секвенирован. К самой расшифровке генома ученые-генетики только приступают. Можно привести такую аналогию. Например, специалистам очень давно известно о существовании агванского письма, которое применялось в раннем средневековье на территории Азербайжана и Дагестана. В распоряжении ученых имеются письменные памятники этого письма, рукописный список его алфавита (т. е. текст только списан). Несмотря на все это, тайна агванского письма (секреты, которые он несет) остается до сих пор в значительно мере неразгаданной.
Завершение проекта «Геном человека» открыло новую эру, часто называемую постгеномной. По прошествии 2–3 лет первоначальная эйфория начала спадать, и стало очевидным, что пройден только первый, относительно легкий этап — структурный. Если сравнивать с объемом работы, который еще предстоит проделать мировой науке для того, чтобы наши знания о геноме человека кардинально изменили качество жизни человечества, то можно сказать, что на сегодня сделано крайне мало. Теперь предстоит новый, несомненно более сложный этап, называемый учеными функциональным. Энциклопедия человека напечатана и издана, но прежде чем понять суть жизни, надо научиться читать этот текст целиком, а мы пока можем прочесть только отдельные абзацы, да еще далеко не полностью даже на отдельных страницах. Важно понимать, что геном — хранилище информации, которую нельзя свести к одним генам. Каждый этап развития и функционирования отдельных клеток и организма в целом не запрограммирован автоматически в одном геноме, а зависит также от множества различных внутренних и внешних факторов.
Сегодняшняя ситуация подобна той, о которой говорил Козьма Прутков: «Где начало того конца, которым оканчивается начало?». На повестке дня стоит новый лозунг: «От структуры — к функции», то есть, говоря по-научному, от структурной геномики — к функциональной геномике человека. Уже начался бурный прогресс в изучении механизмов работы как отдельных генов, так и генома в целом. Именно достижения в этом направлении определят в конечном итоге успех всех тех начинаний, ради которых и старались исследователи, когда расшифровывали (извините, секвенировали) геном человека. Королева по имени структурная геномика сделала свое дело, наследственная королева — функциональная геномика — взошла на трон.
ОТ СТРУКТУРЫ К ФУНКЦИИ (функциональная геномика)
Недостаточно знания, необходимо также применение;
недостаточно хотеть, надо и делать.
И. Гёте
Хорошо известно выражение, что от слова «халва» во рту слаще не становится. Так же обстоит дело и с нашим геномом. В нем есть много разных слов и предложений, но клетке от этого ни сладко, ни горько, пока геном не начинает работать (по научному, функционировать). Только когда в клетке образуются белки, тогда она почувствует, «сладко» ей (если ген работает правильно) или «горько» (при наличии, например, в гене «плохой» мутации»).
То, что в природе (да и не только в ней) всякая конкретная структура тесно связана с выполняемой ею определенной функцией, — это аксиома. Но раскрыть и увидеть эту тонкую взаимосвязь порой весьма не просто. Особенно если это касается такой сложнейшей структуры, как геном человека. От относительной статики генома, когда изучалась структура и последовательность нуклеотидов ДНК, теперь ученым предстоит перейти к сверхсложной динамике клеточного метаболизма, зависящего от этой молекулы жизни. Это есть предмет новейших направлений в молекулярной генетике — функциональной геномики и протеомики.
В геноме человека имеются гены, которые функционируют во всех типах клеток. Такие гены, как говорят, заведуют «домашним хозяйством». Считается, что домоуправителей среди генов около 20%. Но вот остальные 80% ведут себя чрезвычайно специфически. Клетка от клетки сильно отличается по своему виду и функции. И это в первую очередь связано с разными наборами работающих в них генов и белков. Многие гены, функционирующие в мозгу, не работают ни в печени, ни в селезенке, ни в каком-либо другом органе или ткани. И, наоборот, в печени или селезенке функционирует ряд генов, которые нигде больше не работают. Одни из них работают только на определенных этапах развития организма, обеспечивая формирование нашего облика (хорошего или плохого — это уже другое дело). Другие гены — специализированные — работают только в очень ограниченном наборе клеток. Хорошо известный пример последних — глобиновые гены. Они функционируют только в клетках крови, поскольку их основная функция — обеспечивать перенос кислорода к другим клеткам и тканям. Другой пример. Наша способность воспринимать запахи связана с обонятельными рецепторами. Всего найдено около тысячи генов, кодирующих такие белки-рецепторы. Но в каждой клетке специализированного органа — обонятельной луковицы — работает только один ген из этой тысячи. Происходит высочайшая специализация. Как это связано с нашим восприятием запаха, пока совсем не ясно. И вдруг обнаружилось (ученых это сильно удивило), что некоторые из этих генов работают кроме обонятельной луковицы еще только в одном типе клеток — в сперматозоидах. Пока появилось лишь одно «объяснение», возникшее в журналистских кругах: может быть, сперматозоидам в темноте женских половых органов надо как-то ориентироваться, и они избрали в ходе эволюции свой путь — двигаться по запаху (это, конечно же, шутка, которая, возможно, немного отвлечет читателя).
Итак, можно сказать, что каждая клетка предпочитает «читать» лишь определенные предложения на избранных страницах Энциклопедии человека, в результате чего в ней появляется строго определенный набор молекул мРНК и белков. Другие страницы этой книги для конкретной клетки неинтересны или, может быть, написаны так, что клетка просто не может их прочесть (условно говоря, текст других предложений и страниц слишком мелок для нее, а у клетки нет необходимого для их прочтения «увеличительного стекла»). Разные возможности для чтения геномного текста существуют в разных типах тканей и на разных этапах развития организма. На этот процесс могут влиять также многочисленные внешние или внутренние факторы, которым постоянно подвержен в природе организм. Но в любом случае клетки нашего мозга, например, не могут вырабатывать желудочный сок ни при каких обстоятельствах. Такая чрезвычайно сложная ситуация существует в миллиардах клеток человека, и все эти ситуации, не поддающиеся пока даже приблизительной оценке в отношении их числа, еще предстоит исследовать. Так что пока наш геном хранит еще много разных тайн!
Путь от обнаружения генов до выяснения их функций весьма непрост. Для полного понимания жизненных процессов, протекающих в клетках и в организме в целом, для выяснения природы различных заболеваний человека необходимо тщательное изучение молекулярных механизмов, осуществляющих тонкую регуляцию работы генов. Пока, увы, и этот вопрос еще далек от своего полного решения. Что проку в самой полной и точной карте генов, если неизвестны их назначение и характер работы в организме?
Теперь перед исследователями в области функциональной геномики встала значительно более серьезная задача: определить механизмы работы генома человека и функции многочисленных вновь выявленных генов и их продуктов. Одни гены будут кодировать белки, которые окажутся специфическими ферментами (катализаторами биохимических реакций), другие будут представлять собой банальный строительный материал, третьи будут идентифицированы как гормоны, факторы роста, рецепторы факторов роста, четвертые — как передатчики нервных импульсов и так далее. И порой у одного и того же белка может оказаться несколько функций. Каждому белку, в конечном итоге, должно быть найдено его истинное место в сложнейшем устройстве и функционировании человеческого организма. То есть, условно говоря, должна быть создана система, подобная таблице Менделеева. А еще нужно выявить все возможные взаимные влияния динамично работающих генов и их продуктов друг на друга. Огромная сложность заключается в том, что функционирование любого гена осуществляется на фоне работы множества других генов, участвующих в выполнении определенной функции организма, то есть в составе так называемой генной сети. Такие генные сети включают в себя обычно от нескольких десятков до многих сотен координированно функционирующих генов. Например, генная сеть системы кроветворения включает в себя не менее 500–600 генов. Даже неполный список генов, входящих в генную сеть, контролирующую цикл клеточного деления, состоит из более чем сотни генов и т.д.
Постепенно становится понятным, что гены, как и люди, могут выполнять в своей жизни порой совершенно разные функции, оставаясь при этом самими собой. То есть, они иногда могут участвовать немножко в одном, в иной раз немножко в другом, а при случае немножко в третьем. И благодаря этому общее количество генов совсем не обязательно должно совпадать с количеством функций, присущих человеку.
Иногда совокупность генов сравнивают с большим музыкальным оркестром. В зависимости от дирижера и исполнителей одна и та же партитура может звучать так, что вызывает у слушателей или восторг, или глубокое разочарование. Каким образом каждый музыкант — отдельный ген — играет в этом «оркестре», как осуществляется слаженное «концертирование» многих тысяч разных исполнителей? Какую роль в основном «дирижировании» играет сложнейшее взаимодействие между различными генами, какое влияние оказывают постоянные воздействия на гены многочисленных факторов внутренней и внешней среды, таких, как радиация, температура, пища, солнечный свет, бактерии, вирусы, лекарственные вещества, внутриклеточные метаболиты? Не менее важен и вопрос о «дирижерских палочках» — сигнальных путях и молекулярных механизмах, контролирующих программы работы генов, так как дисгармония этих процессов сильно отражается на слаженной игре «оркестра» в целом.
Таким образом, когда мы говорим о групповой ответственности генов за те или иные функции, следует помнить, что внутри определенной группы всегда есть такие, кто собственно и выполняет всю работу, другие ее контролируют, а кто-то обеспечивает чисто вспомогательные функции. Речь идет сейчас о том, чтобы определить иерархию внутри таких сложных групп взаимозависимых и взаимосвязанных между собой генов.
Все эти вопросы еще предстоит решить в будущем. И все это, безусловно, гораздо более сложная и трудоемкая задача, чем уже проделанная гигантская работа по секвенированию генома человека.
Однако и на этом сложности предстоящей работы не заканчиваются. В изучении регуляции экспрессии генов сейчас все большее и большее значение придается химическим изменениям, происходящим иногда в определенных участках генома. Наиболее известное из них — уже упоминавшееся метилирование — это присоединение в ДНК к букве Ц специальной химической группы, состоящей из одного атома углерода и трех атомов водорода (метильная группа). Такая модификация существенно сказывается на работе гена, без изменения его текста. Метилирование, а также другие способы, которыми природа изменяет активность генов, меняя лежащие рядом с ними регулировочные участки, стали предметом изучения новой «постгеномной» дисциплины — эпигеномики (от греческого «эпи» — рядом, около). Явление немутационной эпигенетической изменчивости, открытое в конце 50-х годов при изучении генетики простейших и генетики соматических клеток, тогда не вписывалось в хромосомную теорию наследственности, «вызывая тень Ламарка» (последний утверждал, что признаки, приобретенные организмами в процессе своей жизни, могут передаваться по наследству, что отвергается современной генетикой). В наше время, когда понята молекулярная природа этого явления, эпигеномика стала еще одним из важных направлений биологического поиска. Об этом говорит хотя бы тот факт, что еще до завершения проекта «Геном человека» произошло объединение усилий большой группы ведущих европейских научных центров с целью создания Европейского эпигенетического консорциума. Его основная задача — выявление сотен тысяч участков генома, подвергающихся метилированию, и анализ различных вариаций.
Каковы же магистральные пути развития функциональной геномики человека в настоящее время? Разработано огромное множество подходов для решения данной задачи. Обо всех рассказать здесь просто невозможно, поэтому остановимся вкратце лишь на некоторых основных из них.
Микрочипы — новый рубеж в исследовании экспрессии генома
В последние годы появились принципиально новые экспериментальные технологии, позволяющие одновременно следить за динамикой экспрессии сотен, а порой и тысяч генов в ходе функционирования и развития клеток. И здесь в первую очередь следует отметить технологию так называемых микрочипов. В 2000 году, выступая с традиционным обращением к американскому народу, президент США отметил, что биологические чипы станут одним из ведущих направлений в развитии биологии и медицины XXI столетия. В чем же причина проявления столь жгучего интереса к биочипам?
История биочипов началась еще в конце 80-х годов, когда исследователи сразу трех стан (Югославии, США и СССР) опубликовали первые результаты работ по оценкам возможности применения биочипов для анализа ДНК. В нашей стране ведущая роль в разработке данных технологий принадлежит Институту молекулярной биологии им. В. А. Энгельгардта РАН (директор академик А. Д. Мирзабеков). Спустя 10 лет в США было объявлено о начале проекта по выпуску на рынок первых коммерческих продуктов, использующих биочипы. В настоящее время эта технология очень широко используется в самых разных целях большим числом фирм. С ее помощью осуществляется широкомасштабная автоматизация процесса обнаружения множества различных генных мутаций, одновременный анализ работы десятков тысяч генов в здоровых и поврежденных тканях, диагностика генетических заболеваний и многое другое.
Современный биологический микрочип имеет весьма небольшой размер (чаще всего с ноготь) и представляет собой набор нанесенных и закрепленных (иммобилизованных) на предметном стекле специальных проб в количестве от нескольких десятков до 10000 и более. В качестве таких проб могут служить очень короткие нуклеотидные последовательности ДНК (олигонуклеотиды), протяженные фрагменты ДНК, ферменты, антигены, антитела и т.д. В зависимости от поставленной задачи сложность микрочипа (количество иммобилизованных проб и плотность их расположения) может варьировать в широких пределах. Пробы расположены на чипе в определенной последовательности. Чип гибридизуют (о гибридизации мы уже говорили) с изучаемым образцом, содержащим сложную смесь меченых тем или иным способом РНК или ДНК, а далее анализируют полученный результат с помощью специальных приборов — сканеров. По получаемой картине можно судить о том, что именно содержится в анализируемом образце. Таким образом, обеспечивается проверка на соответствие известных и неизвестных образцов ДНК и автоматизируется процесс их идентификации. Иными словами, биочип — это новое изделие, которое выступает в роли биологического эквивалента микрочипа компьютера, за исключением того, что, вместо выполнения миллионов математических действий, использующих электричество, здесь происходит расшифровка работы тысяч генов за счет процесса гибридизации.
В настоящее время исследования генной экспрессии часто проводятся с использованием высокоэффективных микрочипов ряда фирм. У фирмы Affymetrix они представляют собой маленькие пластинки, в микролунки которых нанесены короткие (20–25 нуклеотидов) пробы, комплементарные последовательностям исследуемых генов. При этом каждому гену соответствует несколько (10–20) таких проб. Это существенно повышает точность и воспроизводимость количественного анализа генной экспрессии. Плотность размещения проб, а следовательно количество генов, анализируемых на одном чипе, могут быть столь велики, что один такой чип способен охватить все гены человека. С таким микрочипом проводят гибридизацию меченых копий суммарной РНК клетки (кДНК). Благодаря комплементарности цепей, в каждой лунке гибридизуется отдельная фракция кДНК. Затем автоматически микрометодами определяется спектр генов, изменяющих свою экспрессию в одном типе клеток по сравнению с другим. В результате можно расписать функциональное состояния огромного числа генов на каждый конкретный момент времени в каждом определенном типе клеток.
Приведем лишь один пример. Надо было выяснить, чем отличается картина экспрессии генов в раковых клетках по сравнению с нормальными. Продукты экспрессии раковых клеток метили флуоресцентным красителем с максимумом флуоресценции в красной области спектра. Одновременно также метили продукты нормальных клеток, но красителем, максимум флуоресценции которого лежит в зеленой области спектра. Все это смешивалось и гибридизовалось с микрочипом, на котором содержались пробы для примерно 20 тыс. различных генов. Во флуоресцентном микроскопе получалась замечательная по красоте картинка (см. рис. 31 на цветной вклейке). Но расшифровать ее позволяет только специальный компьютерный анализ. В результате исследователи могут сделать довольно однозначный вывод о поведении в раковой клетке огромного числа генов и сравнить их поведение в нормальной клетке. Отсюда в конечном итоге можно прийти к пониманию молекулярных причин определенного злокачественного перерождения клетки. Результат, получаемый молекулярными генетиками с помощью микрочипа, можно сравнить с теми данными, которые дает астрономам фотография звездного неба, когда по размеру и яркости звезд они определяются происходящие в космосе события. Человеческий организм — это космос для биологов.

Рис. 31. Общая картина гибридизации меченых флюоресцентными красителями зондов с микрочином, изображающая спектры генов, работающих сильнее (красным цветом) или слабее (зеленым цветом) в раковых клетках по сравнению с нормальными клетками.
Моделирование — важный подход к пониманию функции генов
Естественно, что ученые не всегда могут проводить испытания на живом человеческом организме. Но из этого положения есть определенный выход. Сравнения геномов простых и сложных организмов указывает на существенный консерватизм функций генов. Этот консерватизм не только демонстрирует тот факт, что жизнь на земле основана на общих принципах, но и предоставляет экспериментаторам инструмент, позволяющий, исследуя функции генов у простых организмов, делать заключения о функции генов у более сложных, включая человека. По этой причине уже давно в экспериментах стали широко использовать различные животные организмы, говоря в этих случаях о моделировании процессов, происходящих у человека. Для моделирования используются различные животные, начиная от нематоды и кончая обезьянами.
Модель — это конечно же образец, некое подобие оригинала (свирель не может заменить соловья), но она зачастую много говорит ученым о самом оригинале. При этом модель помогает решить главную проблему — понять человека, не затрагивая в экспериментах его самого. Напрашивается такая, хотя и несколько отдаленная, литературная аналогия. Это все равно, как сравнивать достоверную летопись об определенном событии и легенду или сказку, где это также отражено. Хотя сказка несет элемент фантазии, но даже в ней всегда есть намек, который «добрым молодцам урок!»
Одним из наиболее широко используемых для моделирования организмов служит мышь. С ней мы часто боремся в быту, ругаем ее, травим, а вот в науке она остается одним из основных объектов исследования. Дело не только в том, что мышь — весьма доступный и дешевый объект, а главным образом в том (как это, может быть, не совсем приятно читателю), что устройство генома и сами гены у мыши довольно сходны с человеческими. В последние годы ученые научились даже получать мышей с генами человека. Для этой цели в качестве мишени используют обычно ее оплодотворенную яйцеклетку. Чаще всего ген вводят с помощью микропипетки в ядро этой клетки. При удачном стечении обстоятельств (обычно такое стечение происходит в 5–10% случаях) ген встраивается в геном мыши и после этого становится таким же, как и собственные мышиные гены. В результате, когда из прооперированной яйцеклетки вырастает потомство, оно содержит новый, ранее не имевшийся у них ген — трансген. Такие животные получили название трансгенных. Например, когда мышам ввели ген гормона роста человека, они увеличили размер своего тела почти в два раза (рис. 32).

Рис. 32. Фотография нормальной мыши (справа) и трансгенной, содержащей ген гормона роста человека (слева)
Когда же им вводили человеческие «больные» онкогены, то у таких трансгенных мышей часто развивались опухоли того же типа, что и у человека. Подобного рода эксперименты были проведены уже с десятками сотен различных генов. Изучая биологические эффекты разнообразных (порой совершенно не изученных) генов у мышей, ученые довольно уверенно делают выводы об их вероятной функции у человека.
Более того, в последние годы были созданы специальные весьма изощренные и методически сложные генетические приемы, которые позволяют направленно изменять работу определенных, уже имеющихся мышиных генов в тех или других органах и на тех или иных этапах развития. В частности, найдены молекулярные подходы, которые позволяют полностью выключать работу строго определенных генов (это называют нокаутированием генов). Мыши с такими, находящимися «в нокауте» генами, дают возможность как выяснять роль для жизнедеятельности уже известных генов, так и идентифицировать новые гены, важные для различных аспектов жизни человека.
ОТ ГЕНА — К БЕЛКУ (протеомика)
Что посеяно, то и взойдет.
Русская пословица
Сам по себе ген — лишь определенная последовательность нуклеотидов. Его основная задача — обеспечить производство на свет строго определенного белка (в крайнем случае РНК). Существует даже выражение: «гены — поваренная книга, испещренная тысячами рецептов; белки — угощение, выставленное на стол». В постгеномную эру появились новые возможности не только для функциональной геномики, но и для исследования самих белков — основных кирпичиков живого.
Белки (или, как еще их называют, протеины) известны нам уже около 200 лет. В начале XIX столетия химики выбрали имя «протеины» для этих веществ от греческого слова «proteios», означающего «первый» или «важнейший». В русском языке эти вещества чаще называются белками. И вот теперь, на базе геномики возникло новое направление исследований — протеомика. Протеомика — это изучение всей совокупности белков клеток и их взаимодействия в целом организме. Ученые в области протеомики изучают «производство» белков, их структуру и состав, различные модификации после синтеза, функции и метаболизм. Все эти исследования имеют одну общую цель: идентифицировать все белки, работающие в каждом типе клеток в каждый определенный момент их жизненного цикла, и понять в совокупности их сложный метаболизм.
Масштаб предстоящей работы представляется огромным. Ведь во взрослом организме человека в 1014 его различных клеток функционирует несколько десятков тысяч генов. Но гены кодируют лишь белки, а не их сборку в работающую «машину». Белковый «текст» — это трехмерный мир, намного превышающий возможности ДНКового текста. Как пишет американский биолог Роберт Поллак, «гены — это линейный текст, а белки — трехмерная скульптура». В белковом тексте, условно говоря, «буква» — это аминокислота, корень «слова» — последовательность аминокислот в единичном полипептиде. Свертываясь в трехмерную структуру, единичный полипептид формирует по сути дела полное «слово», которое уже может быть и простым «предложением». Вдобавок, в живой клетке форма белков может динамически меняться, что превращает их в подобие более сложной, «кинетической» скульптуры. Далее возникают сложнейшие «предложения» — комплексы, состоящие из десятков и даже сотен белков. Таким образом, разнообразие белковых вариантов у нас значительно больше, нежели генов. По некоторым оценкам, белковых вариантов и их всевозможных комплексов в наших клетках может набраться аж миллион! Связано это с тем, что, как говорилось выше, с одного гена за счет альтернативного сплайсинга возможно получение нескольких разных РНК-копий, которые способны кодировать разные белковые цепи (полипептиды). Последние, в свою очередь, могут по-разному взаимодействовать друг с другом, образуя комплексы, состоящие из 2–4 и более полипептидов. При этом формируются многочисленные белковые комплексы, обладающие порой разными функциями. Например, ген по имени Ikarus за счет альтернативного сплайсинга способен обеспечивать образование 6-ти различных полипептидов. А далее из них в клетке может сформироваться около 20 разнообразных белковых комплексов, состоящих или из одинаковых, или разных полипептидов. Таким образом, наш организм содержит гигантское число вариантов белковых молекул. Все это существенно осложняет на сегодняшний день возможность создания «каталога белков».
Кроме белков, в нашем организме содержится большое количество других молекул: липидов, углеводов, разнообразных низкомолекулярных органических соединений. Но все-таки основу основ составляют именно белки. Они выполняют в клетках весьма разнообразные функции: одни служат строительными материалами клетки (структурные белки), другие выполняют функции ферментов, катализируя многочисленные клеточные химические реакции, третьи являются регуляторами процессов репликации, транскрипции и трансляции. Существуют еще транспортные белки, участвующие в транспортировке метаболитов в клетке, белки-гормоны, хранилищные белки, рецепторные, сократительные и др. Белки в клетке постоянно синтезируются и постоянно разрушаются (деградируют). Кроме того, в клетке они распределены между разными, относительно изолированными областями, окруженными мембранами, которые называются органеллами.
Важно также отметить, что в настоящий момент анализировать белки существенно труднее, чем гены. Если процесс севенирования ДНК уже автоматизирован так, что «с ней справилась бы любая обезьяна», как едко заметил нобелевский лауреат Джеймс Уотсон, то методы анализа белков оказались гораздо более сложными. В далеком 1962 г. вместе с Уотсоном и Криком в Стокгольм были приглашены из Кембриджа Джон Кэндрью и Макс Перутц. Они были тогда удостоены Нобелевской премии по химии за впервые осуществленную расшифровку трехмерной структуры двух белков — миоглобина и гемоглобина, — ответственных за перенос кислорода в мышцах и эритроцитах соответственно. Даже в начале 1990-х годов расшифровка структуры каждого нового белка представляла значительные трудности. Каждый анализ занимал порой до десятка лет. Сейчас методы анализа белков значительно усовершенствованы. Однако все еще перспективы создания «каталога протеинов» намного более отдаленны, чем перспективы создания упомянутых выше каталогов генов, снипсов или вариаций метилирования ДНК.
Хотя и от самого по себе синтеза белка еще далеко до создания целого организма, но без белков этот процесс никогда не пойдет. Белки не только составляют большую часть клетки как структурные элементы, они осуществляют также постоянный тонкий контроль за всеми химическими процессами, происходящими внутри клетки, избирательно включая и выключая их в строго определенные сроки и в строго определенных местах. Это теперь понятно. Но не понятно до конца другое: как именно происходит в конечном итоге развитие целого организма из одной единственной клетки — зиготы. Белки, конечно же, активно участвуют в этом процессе как основные компоненты.
Работа белков, как и работа генов, тоже зависит от многих факторов, прежде всего влияющих на их пространственную структуру. Более того, многие белки со временем могут меняться (модифицироваться), и здесь уже гены не оказывают никакого влияния. Происходит это путем присоединения к белковым молекулам особых побочных групп — фосфатидов, сахаридов или ненасыщенных углеродных цепочек. Все эти события — как и образование пространственной структуры белка — никак не отмечены в генах. Гены содержат лишь общий план активной жизни клеток, а сама жизнь определяется в конечном итоге белками.
Гены во всех клетках всегда одни и те же, но вот белки, наоборот, постоянно меняются в зависимости от стадии развития клетки, возраста организма, состояния клетки и множества других обстоятельств. Иными словами, как пишет акад. Л. Л. Киселев, «протеом — понятие динамическое, а геном, напротив, статическое».
Белки позволяют себе импровизацию типа джазовой, т.е. коллективной, когда вместо одних белков их функцию выполняют другие. Это очень важно, поскольку все ситуации, с которыми сталкивается организм в процессе своей жизни, заранее предусмотреть нельзя. Известно и другое — один и тот же белок может иметь отличающийся эффект в разных типах клеток и на разных стадиях развития. Все это имеет аналогии с обычным литературным текстом. В лингвистике для описания подобных случаев имееются специальные термины. Так, термин синонимия обозначает предложения, несущие один слысл, но состоящие из разных слов (например, «Мамонтов погубило внезапное похолодание» и «Резкое понижение температуры на планете привело к гибели мамонтов»). Под термином омонимия подразумевают смысловое различие внешне совпадающих предложений (например, предложение «Мы проехали остановку» может обозначать две разные ситуации: мы проехали расстояние, равное перегону между двумя остановками, или мы миновали то место, где должны были выйти).
Одна из важнейших целей, стоящих перед учеными, занятыми анализом протеома, заключается в поиске характерных изменений в белках, присущих различным видам заболеваний. Действительно, нередко удается проследить взаимосвязь между изменениями белков и разными болезненными состояниями. Секвенирование генома человека дало в руки исследователей важную информацию для борьбы с наследственными недугами. Однако не все болезни передаются нам по наследству. Многие никак не связаны с «родовым проклятием». Выявить эти болезни можно, лишь узнав, как изменился состав белков внутри патологической клетки. По этой перемене можно заранее заметить и патологические процессы, начавшиеся в организме.
Чтобы увидеть белковый состав клетки, ученые прибегают к так называемому двумерному электрофорезу. Сначала белки сортируют по их заряду, а затем они попадают в гель, выполняющий роль сита, в котором белки разделяют по их размерам. Таким образом, удается разделить до десяти тысяч белков и маркировать их. На этой основе можно составить что-то вроде паспорта данной клетки, где примерно указан состав белков. Если человек заболевает, «паспорт» изменится. Сравнивая наборы белков больной и здоровой клеток, удается оценить течение болезни и процессы, ей сопутствующие. Все это позволяет значительно ускорить поиск белков-мишеней и осуществлять разработку лекарственных средств, чтобы как можно быстрее обеспечить больных новыми эффективными лекарствами. Сегодня более 95% всех фармакологических средств на рынке нацелены на воздействие на белки-мишени. Протеомика порой может помочь идентифицировать и оценить новые целевые белки гораздо эффективнее, чем геномика. Это позволяет резко ускорить разработку новых диагностик и терапевтических средств.
Можно привести такой пример. Известно, что к повышению артериального давления прямое отношение имеет так называемый ангиотензин-конвертирующий фермент (ACE). Антиотензин, образующийся под действием ACE, воздействует на стенки артерии, что и ведет к гипертонии. Уже относительно давно были найдены блокаторы АСЕ, которые стали продаваться в качестве лекарств от повышенного давления. Однако все эти лекарственные средства оказались малоэффективными. В результате анализа генома человека был выявлен наиболее распространенный и эффективный вариант фермента. Затем была определена структура белкового продукта, после чего подобраны химические вещества, активно связывающиеся с ним. В результате был найден новый эффекивный препарат против артериального давления, причем за вдвое меньшее время и всего лишь за 200 млн долларов вместо 500 млн!
Окончательных результатов этого нового грандиозного исследования, которое можно назвать «Протеом человека», конечно же, в ближайшие месяцы ожидать не приходится. Понадобится, видимо, много десятков лет, если не все новое столетие. Лишь после того, как человечество получит в свое распоряжение всю эту информацию, можно будет говорить об окончательном завершении программы «Геном человека».
Но и это еще не конец предстоящих исследований. Не завершение процесса создания Энциклопедии человека. Не вызывает сомнения, что гены и кодируемые ими белки — продукт эволюции. Вместе с тем очевидно, что когда гены еще вообще не существовали, в неорганическом мире, у кристаллов и минералов, имелись определенные формы, подобные тем, что есть сейчас у вирусов, белков и даже клеток. До сих пор мы еще мало знаем о тех механизмах, которые побуждают группы молекул объединяться вместе, формируя те или иные клетки и ткани. Тем не менее, следует отметить, что в последние годы возникло некое новое представление о процессе самосборки молекул, которое может оказаться важным для нашего понимания процессов формирования и вообще функционирования человека. Возможно, во всем многообразии природных систем существует некий единый фундаментальный способ построения разнообразных структур. Его иногда назвывают «тенсегрити» (при переводе слова «tensegrity» с английского, получится что-то вроде «напряженности стойкости», что довольно коряво и малопонятно звучит по-русски). Термин «тенсегрити» означает, что система стабильна за счет баланса в ее структуре сил сжатия-растяжения. Это общий принцип, который, вероятно, работает и в организме человека. Считается, что все 206 костей человека противостоят силе тяжести, что дополнительно к мышцам, сухожилиям и связкам позволяет ему удерживаться в вертикальном положении. Таким образом, по тенсегрити, основные структуры внутри нас — кости, которые служат прочными распорками, а также мускулы, сухожилия и связки, являющиеся упругими элементами. Согласно этому представлению, законы тенсегрити действуют как на молекулярном уровне (им подчиняются наши белки и другие важные для клетки молекулы), так и на клеточном и даже организменном уровнях (при формировании тканей и органов, при морфогенезе). И все эти «сопроматные» механизмы, действующие in vivo наряду с генетическими, нам еще предстоит изучить.
ОТ ГЕНА И БЕЛКА — К ЛЕЧЕНИЮ (медицинская геномика)
Медицина поистине есть самое благородное из всех искусств.
Гиппократ
Самые худшие болезни — не смертельные, а неизлечимые.
Эбнер-Эшенбах
Известный русский биолог Н. Тимофеев-Ресовский писал: «В удивительном по своей стройности и сложности индивидуальном развитии многоклеточных организмов, к каковым относится и организм человека, с высокой точностью в должное время в должном месте происходит должное». Это верно для здорового человека, однако медицине приходится иметь дело главным образом с исключениями из этого правила, безусловно верного для здорового организма.
Многие годы важную роль в решении всех этих «исключений из правила» играло специальное направление в медицине — молекулярная генетика. Основоположниками медицинской генетики в России были С. Н. Давиденков, занимавшийся изучением роли наследственности в болезнях нервной системы, и С. Г. Левит, организовавший в Москве и возглавивший первый в России (и один из первых в мире) Медико-генетический институт. Это направление сыграло важную роль на начальных этапах, когда мало что было известно о структуре генома человека.
Первоначально в медицине было принято считать, что любое заболевание представляет собой результат дисбаланса биохимических реакций, возникающих в результате тех или иных молекулярных поломок. В связи с этим на первом этапе нужно всего лишь определить «молекулярную мишень», а затем с помощью лекарства исправить существующее нарушение. Такой подход в целом оправдал себя при разработке лекарственной терапии инфекционных заболеваний, где в качестве мишени выступали различные бактерии и вирусы. Но при других типах заболеваний, таких, как, например, атеросклероз, рак, преждевременное старение, заболевания нервной и сердечно-сосудистой систем, старая идеология «забуксовала», потому что у этих заболеваний оказалось слишком много разных причин, включая и генетические. Стало понятным, что надежда на одну единственную «волшебную пулю», направленную на одиночную мишень, здесь не может помочь — во многих случаях «мишеней» в клетках очень много, к тому же они еще и подвижны.
Только революция, которая произошла в медицине в последние годы — как результат развития молекулярной генетики и полного секвенирования генома человека, позволила перейти от в известной мере иррационального знания к рациональному. Сегодня на основе геномики возникли такие направления, как медицинская геномика и биомедицина, которые тесно переплетаются с функциональной геномикой человека.
Опытные врачи говорят, что нет двух одинаковых болезней и двух одинаковых пациентов. И не менее чем на 50% эти различия связаны с особенностями структуры генома. Если в будущем удастся проводить сравнение генов больных людей с генами идеального, «чистого» гомо сапиенс, это существенно поможет поиску пути к эффективному лечению.
Геном — это в первую очередь реальный текст, опечатка в котором, допущенная Природой, может сделать человека или уродом, или инвалидом, или даже не позволит ему родиться вообще. В результате реализации проекта «Геном человека» появилась твердая уверенность, что уже в недалеком будущем большинство болезней можно будет лечить на генетическом уровне. А потому медицинскую геномику считают чуть ли не самым перспективным направлением в развитии современной медицины. В конце прошлого столетия с этим согласились даже политики, когда правительства Америки, Англии, России и ряда других стран стали инциаторами грандиозного научного проекта под названием «Геном человека».
Полное секвенирование генома человека стало важнейшим этапом для всей мировой медицины. На основе успехов в молекулярной генетике и определения полной последовательности генома человека произошла «генетизация» медицины, что привело к возникновению медицинской геномики, или молекулярной медицины. Если раньше считали, что генетика имеет отношение только к наследственным заболеваниям (а они составляют всего около 2% от общего числа заболеваний человека), то сейчас стало совершенно очевидным, что все болезни в той или иной мере от генов (а не от нервов, как это широко было принято считать, хотя и они, конечно, тоже играют свою роль). Один из руководителей геномного проекта Френсис Коллинз высказался на этот счет весьма категорично: «Нет болезней, за исключением некоторых случаев травм, которые не имели бы наследственного вклада. Я не знаю ни одного примера».
При наследственных болезнях наблюдаются опечатки в ДНКовом тексте, которые приводят к дефекту гена. В случае других заболеваний нарушения обычно затрагивают не структуру гена, а скорее регуляцию его экспрессии.
Что же дало для медицины полное секвенирование генома человека? Как теперь ясно — очень многое. В первую очередь то, что теперь стало возможным диагностировать большинство (а в перспективе практически все) известных наследственных заболеваний на любой стадии развития человека, в том числе и до рождения (пренатальная диагностика). ДНКовый текст позволяет обнаружить предрасположенность индивидуума к тем или иным заболеваниям, включая и заболевания, обусловленные внешними причинами (химическими факторами среды, вирусами, питанием и др.). ДНК стала базой для генотипирования, идентификации личности. Далее, детальные данные об индивидуальных особенностях генома пациента служат основой для фармакогеномики — новой науки, изучающей, как генетика влияет на вариабельность ответа пациентов на лекарства. Рассмотрим теперь все эти вопросы по порядку.
Любая болезнь, для которой не существует эффективной терапии, представляет собой тайну, которую не так легко раскрыть. Ученым-медикам, прежде чем изготовить эффективное лекарство или найти иной способ лечения пациента, нужно узнать первопричину заболевания, а не его внешнее проявление. Ключ к этому — ген или гены, так или иначе вовлеченные в патологию. Не так давно в науке появилась новая профессия — «охотник за генами». По аналогии с популярными в конце прошлого века «охотниками за микробами» — микробиологами — век спустя «охотниками за генами» называют молекулярных биологов, которые выслеживают, находят и секвенируют (расшифровывают) человеческие гены, и в первую очередь гены серьезных наследственных болезней. Как же осуществляется «охота»? Один из наиболее многообещающих способов сделать это — проведение тщательного сравнения ДНКовых текстов у людей, связанных родственными узами, одна часть которых подвержена какому-то характерному заболеванию, а другая — нет. Конечная цель такого поиска — определить у носителей болезни ответственный за нее ген с нарушенным генетическим кодом.
Уже говорилось, что геномы всех нас с вами очень похожи друг на друга. Если и имеются различия, то они весьма незначительные. Однако в них-то и заключается проблема. По этой причине медицинская геномика существенное внимание уделяет генетическому полиморфизму. Ранее уже шла речь о полиморфизме генома человека и об использовании этого явления для решения различного рода теоретических проблем. Но для медиков полиморфизм нашего генома имеет не столько теоретическое, сколько сугубо практическое значение.
Достоверно установлено, что многочисленные наследственные заболевания связаны с мутациями в генах, то есть с изменениями в самой структуре белков. Иногда достаточно мутации лишь в одном гене (такие патологии называют моногенными наследственными болезнями), иногда заболевание связано с наличием мутаций одновременно в нескольких генах (мультигенные наследственные болезнями). Медикам, конечно же, проще иметь дело с первыми, хотя и здесь могут быть проблемы с лечением. Наряду с эти, выяснилось, например, что белки содержат специальные сигнальные последовательности, которые можно сравнить с адресами на почтовых отправлениях или с ярлычками на багаже, где написано место, куда предполагается его доставить. Фактически такие сигнальные последовательности представляют из себя цепочки аминокислот, которые или прикреплены к белковой молекуле в виде хвоста, или, иногда, лежат непосредственно внутри нее самой. Очень важно, что множество наследственных заболеваний человека вызывается нарушениями именно в этих сигналах и в транспортных механизмах, с ними связанных. Таким образом, человеческие патологии связаны не только с нарушением структуры генов и кодируемых ими белков, но и с транспортом (перемещением) функционально активных белков в клетке.
Полиморфизм генома чаще всего для человеческого организма нейтрален. Тем не менее, изменения в целом ряде генов (и в их регуляторных участках) при определенных условиях могут способствовать, а иногда, наоборот, препятствовать проявлению отдельных заболеваний. Если обнаруживают гены, определенный полиморфизм в которых ассоциируется с тем или иным заболеванием, то их называют «генами предрасположенности» и они становятся объектом пристального внимания медиков. Первоначально определяют, к какому классу относятся эти гены. Принято считать, что среди генов предрасположенности к заболеваниям есть «гены детоксикации», которые реагируют на факторы внешней среды, и «гены-триггеры», связанные с запуском патологического процесса под действием внутренних факторов организма.
В поиске «больных» генов весьма полезными оказались уже упоминавшиеся снипсы. На них сейчас возлагают большие надежды. Изучение «снипсов» показало, что иногда замена одного-единственного нуклеотида может вызвать у данного человека повышенную склонность к развитию того или иного заболевания. Это происходит в тех случаях, когда, например, точковая мутация возникает вблизи гена, на участке ДНК, регулирующем его работу. Изучение «точечных» различий между индивидуумами может открыть путь к «индивидуализированной» медицине. Большая роль здесь отводится новому направлению — фармакогеномике, о котором подробнее мы поговорим в следующем разделе.
Расскажем о том, как секвенирование генома человека и анализ снипсов существенно изменили стратегию обнаружения и клонирования генов, ответственных за наследственные заболевания. Итак, имеется некая наследственная патология. Понятно, что за нее отвечает какой-то ген или группа генов. Что требуется, чтобы обнаружить такой ген? Сначала надо грубо определить локализацию этого неизвестного гена (его называют геном-кандидатом) на одной из 23 хромосом. Начинается масштабный поиск каких-либо изменений в ДНК разных больных с этой патологией. Обычно сперва в результате такого анализа на определенной хромосоме выявляется довольно большой район, в котором могут располагаться десятки или даже сотни разных генов. Для поиска конкретного гена-кандидата заболевания необходимо сузить исследуемый участок ДНК. На это уходило раньше несколько лет. Однако после расшифровки генома ситуация упростилась. Теперь почти вся нуклеотидная последовательность генома человека известна и помещена в базы данных, с которыми можно связаться в любой момент по Интернету. Если известна хромосомная локализация какого-либо заболевания, достаточно запросить информацию о нуклеотидной последовательности этого района, провести компьютерный поиск генов, содержащихся в нем, а затем выбрать один или несколько наиболее подходящих и протестировать их на мутации у ряда пациентов с данной патологией. Ген, в котором таковые будут обнаружены у большинства больных и не обнаружатся у здоровых людей, и есть искомый ген заболевания.
Подробные генетические и физические карты генома человека и особенно последовавшее за этим полное секвенирование ДНК позволили в последние годы успешно клонировать многие гены, ответственные за различные наследственные заболевания. Как уже говорилось, важная роль в этих достижениях принадлежит и сравнительному анализу геномов разных индивидуумов, принадлежащих к одному семейству, а также геномов нормальных и «больных» клеток.
Важными материалами для медицинской геномики служат относительно изолированные популяции людей и наличие подробных данных об их родственных связях. Так, в отличие от многих других стран, Исландия уникальна не только своим климатом, но и своими жителями. В течение многих веков здесь строго документировали все формировавшиеся брачные отношения, и, что очень важно, эти сведения сохранили в целости и сохранности до наших дней. Это дало в руки исследователей огромный материал, охватывающий около 270 тыс. ныне живущих людей и 330 тыс. их ранее живших предков. В результате появилась возможность создавать родословную для каждого из исландцев на глубину до 10 веков. Сейчас там проводят массовый анализ геномов жителей и исследуют взаимосвязь наиболее распространенных заболеваний с различными генетическими маркерами. И это уже начинает приносить первые плоды. Во-первых, удалось обнаружить связь между развитием панических расстройств психики и аномалиями строения хромосомы 9. Во-вторых, исследователи выявили ген, мутация в котором резко увеличивает вероятность развития ишемического инсульта (эта мутация получила название STRK 1 от англ. «stroke» — инсульт).
В принципе существует два основных подхода к поиску гена-кандидата, отвечающего за патологию: от белка к гену и от генома к гену. Последний путь оказался наиболее эффективным. Часто для поиска «больного» гена используют полиморфизм микросателлитных маркеров, расположение которых на хромосомах хорошо известно. Сначала выявляют «сцепление» между заболеванием и определенной формой того или иного микросателлита, затем по расположению микросателлита определяют область, которая может иметь отношение к развитию заболевания. В этой области и ищут ген-кандидат болезни. Новая стратегия получила название «позиционного клонирования гена-кандидата».
Так, в частности, поступил российский генетик Е. И. Рогаев совместно со своими зарубежными коллегами для обнаружения одного из генов, ответственного за болезнь Альцгеймера, который определяет прогрессирующее старческое слабоумие. Это заболевание начинается с незначительных на первый взгляд нарушений памяти (на имена и близкие по времени события), но уже в течение двух—трех лет приводит к полной деградации личности и мучительной смерти. Болезнь Альцгеймера как причина смертности стоит на четвертом месте в развитых странах. Еще несколько лет назад врачи не могли предвидеть развитие болезни Альцгеймера у своих пациентов, а порой даже неправильно ее диагностировали. И вот к этой проблеме подключились «охотники за генами». Они проанализировали ДНК, выделенные из крови больных и их здоровых родственников, и определили, что у всех больных есть некий особый общий участок хромосомы 14. Схема дальнейшего поиска гена-кандидата изображена на рис. 33. На следующем этапе определили, с какими маркерами (микросателлитами) сцеплен искомый ген (на рисунке указано 8 таких микросателлитов). На следующем этапе в библиотеке генов человека были найдены большие (около 1 млн. п. н.) фрагменты хромосомы 14, соответствующие исследуемому участку ДНК. С их помощью был более точно установлен участок хромосомы, несущий «больной» ген (на рисунке он обозначен двунаправленной стрелкой). Половина дела была сделана. Далее определили, какие гены здесь имеются. Их оказалось несколько десятков (отмечены светло-серыми прямоугольниками). И вот конечный результат: лишь в одном из множества генов были найдены мутации, которые встречаются только при болезни Альцгеймера (отмечен темным прямоугольником).
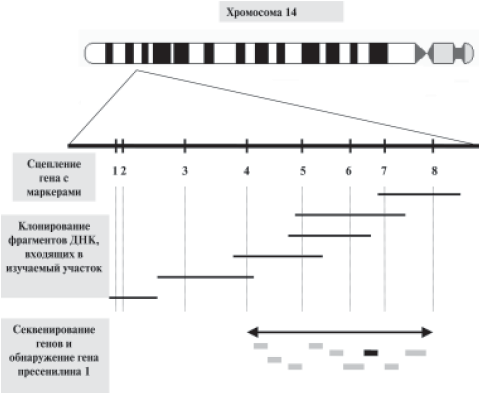
Рис. 33. Схема процедуры поиска гена-кандидата, ответственного за болезнь Альцгеймера. Фрагмент с геном пресенилина указан внизу темным цветом
Так был найден ген, ответственный за изучаемую патологию, который назвали пресенилин 1. Позднее еще один похожий ген (ген пресенилина 2) был найден на хромосоме 1. Люди с мутациями генов пресенилинов заболевают к 30–60 годам. При этом никакие условия среды, к сожалению, не могут предотвратить или остановить развитие болезни, ведущей в конечном итоге к летальному исходу.
А первый успех на пути использования полиморфизма для определения гена, ответственного за такое заболевание человека, как болезнь Хантингтона, пришел еще в 1983 году. Тогда был локализован на коротком плече хромосомы 4 ген, ответственный за это заболевание. Затем последовали другие успешные работы. В частности, геномный скрининг аллелей предрасположенности в семьях с накоплением диабета типа 1 позволил выявить в хромосоме 6 полиморфный вариант гена, тесно связанного с развитием этого заболевания.
В настоящее время более-менее детально картировано около 1000 генов, связанных с различными болезнями человека. А всего в Энциклопедии человека описано свыше 7,5 тыс. участков, существенные изменения в которых потенциально являются причинами тех или иных наших болезней. Но со всем этим придется еще долго разбираться. Сейчас установлено, что продукты большинства (около 30%) из хорошо изученных генов, вовлеченных в патогенез, обладают энзиматической активностью. Еще примерно 14% составляют гены, продукты которых модулируют функции различных белков. Функции продуктов остальных генов многочисленны: факторы транскрипции и их рецепторы, белки, входящие в матрикс, трансмембранные транспортеры и др.
Уже известны гены, мутантные формы которых приводят к сердечно-сосудистым заболеваниям, атеросклерозу, раку и другим заболеваниям. Удалось уже выделить группу генов, которые отвечают за предрасположенность к наркомании и алкоголизму, за различные психические заболевания человека. В частности, обнаружены молекулярные механизмы свыше десятка неврологических заболеваний, получивших общее название болезней триплетных повторов. Суть генетических изменений в этих случаях заключается в размножении (это называют экспансией, захватом) микросателлитов — повторяющихся триплетов — внутри или на концах отдельных генов. Так, давно был известен синдром ломкости X-хромосомы, который проявляется в виде разрывов в длинном плече этой хромосомы. Результат этого — нарушение нормального функционирования центральной нервной системы. «Охотники за генами» обнаружили «больной» ген, который определяет эту патологию (ген FMR1). Оказалось, что в первом экзоне гена FMR1 имется участок, состоящий из повторяющихся тринуклеотидов ЦГГ. У здоровых людей число таких повторов варьирует от 6 до 20, а вот у больных число копий резко увеличено (до 230), в результате чего этот ген перестает работать. Другие заболевания, связанные с увеличением (экспансией) тринуклеотидного повтора, — болезнь Хантингтона (здесь триплет в «больном» гене другой — ЦАГ), миотоническая дистрофия (триплет ЦТГ), болезнь Кеннеди (снова триплет ЦАГ). В сумме умеренная экспансия триплетов ЦАГ (они кодируют аминокислоту глутамин) обнаружена при 8 нейродегенеративных заболеваниях. В этом случае экспансия глутамина вызывает, по-видимому, приобретение белком токсических свойств.
Анализ «больных» генов показал, что часто разные мутации в одном гене приводят к одному и тому же типу патологии. Например, в уже упоминавшемся гене пресенилина обнаружено множество различных мутаций, и все они ассоциированы с болезнью Альцгеймера. Синдром Холта—Орама, характеризующийся скелетными и сердечными аномалиями, обусловлен мутациями в так называемом гомеобоксном гене, расположенном на 12-ой хромосоме. Продукт этого гена скорее всего функционирует как фактор транскрипции в сердце и конечностях. В гене обнаружено 8 мутаций, большая часть которых связана с возникновением преждевременного стоп-кодона. При муковисцидозе — болезни одного гена — проявление патологии весьма разнообразно. Выяснилось, что разные формы этого заболевания связаны чуть ли не с 600 различными мутациями в одном гене.
С другой стороны, в отдельных случаях разные мутации в одном и том же гене могут приводить к развитию разных патологий. Например, четыре вида заболеваний связывают с мутациями в одном гене тирозинкиназы (RET). Одно из них — болезнь Гиршспрунга — представляет собой сложное наследственное заболевание. Кроме того, с другими мутациями в гене RET связаны такие болезни, как множественные эндокринные неоплазии двух разных типов.
Кроме болезнетворных генов обнаружены еще некоторые гены, имеющие прямое отношение к здоровью человека. Выяснилось, что существуют гены, обуславливающие предрасположенность к развитию профессиональных заболеваний на вредных производствах. Так, на асбестовых производствах одни люди болеют и умирают от асбестоза, а другие устойчивы к нему. В будущем возможно создание специальной генетической службы, которая будет давать рекомендации по поводу возможной профессиональной деятельности с точки зрения предрасположенности к определенным профессиональным заболеваниям.
Оказалось, что предрасположенность к алкоголизму или наркомании тоже может иметь генетическую основу. Открыто уже семь генов, повреждения которых связаны с возникновением зависимости от химических веществ. Из тканей больных алкоголизмом был выделен мутантный ген, который приводит к дефектам клеточных рецепторов дофамина — вещества, играющего ключевую роль в работе центров удовольствия мозга. Недостаток дофамина или дефекты его рецепторов напрямую связаны с развитием алкоголизма. В хромосоме 4 обнаружен ген, мутации которого приводят к развитию раннего алкоголизма. Уже в раннем детстве это отражается на поведении ребенка в виде повышенной подвижности и заметного дефицита внимания. Например, недавно выяснилось, что более двух третей всех полинезийцев наделены особой аллелью гена алкогольдегидрогеназы 2, которая оберегает их от алкогольной зависимости. Большинство людей с таким геном признают, что попытки выпить пива, водки или вина неизбежно оставляют после себя очень неприятное чувство и стойкое отвращение к спиртным напиткам.
В настоящее время также интенсивно изучается проблема зависимости психики человека, его способностей и талантов от его генов. Главная задача будущих исследований — это изучение однонуклеотидных вариаций (снипсов) в ДНК и выявление различий между людьми на генетическом уровне. Это позволит создавать генные портреты людей и, как следствие, эффективнее лечить болезни, оценивать способности и возможности каждого человека, выявлять различия между популяциями, оценивать степень приспособленности конкретного человека к той или иной экологической обстановке и т. д. Подробнее об этом мы расскажем далее в специальной главе.
Сейчас уже выявлено свыше двух сотен генов детоксикации, полиморфизм которых тесно взаимосвязан с существенно измененной функциональной активностью и отражается в результате в предрасположенности индивидуума к различным заболеваниям под действием ксенобиотиков — чужеродных для организма веществ, таких, как пестициды, препараты бытовой химии, лекарственные средства и т. п. Рассмотрим несколько характерных примеров. Функционально неполноценный вариант гена детоксикации, называемого геном N-ацетилтрансферазы 2, влияет на возникновение рака молочной железы, и этот эффект напрямую связывают с курением. У женщины с данным вариантом гена курение, особенно в молодые годы, повышает риск заболевания раком почти в 20 раз! С определенным видом полиморфизма другого гена (ген GSTM1), участвующего в детоксикациии ароматических углеводородов, связан у курильщиков повышенный риск развития такого злокачественного заболевания, как карцинома.
Интересно, что мутации генов не всегда приводят к негативным последствиям — они иногда могут быть даже полезными для конкретного индивидуума. Приведем один пример. Некоторые спортсмены используют в качестве допинга гормон эритропоэтин, который стимулирует размножение клеток крови. За это их строго наказывают. А вот у двухкратного призера зимних Олимпийских игр 1964 года в Иннсбруке финна Еро Мянтиранта имелась редкая мутация в гене-рецепторе этого гормона (выяснилось это значительно позже). Эта мутация, доставшаяся спортсмену от деда, и внесла существенный вклад в его победы. Дело в том, что благодаря мутации у него образовывалось в крови красных кровяных клеток на 50% больше, чем в норме, что приводило к существенному повышению обмена кислорода и сильно увеличивало выносливость организма к перегрузкам.
Конечно, золотые медали — это хорошо, но, скажем, устойчивость к вирусу иммунодефицита не менее важна для человека. Ведь в период до 2020 года от СПИДа в мире может погибнуть до 70 миллионов человек! Эти пугающие цифры приводятся в отчете, представленном в 2002 году на ежегодном заседании Экономической и социальной комиссии ООН.
В Уганде и Танзании инфицированность вирусом иммунодефицита среди проституток доходит до 60–80%, однако некоторые из них не только не умирают от СПИДа, но и рожают здоровых детей. Было предположено, что имеется мутация (или мутации), защищающая человека от СПИДа. Люди с такой мутацией могут быть инфицированы вирусом иммунодефицита, но не заболевают СПИДом. В конечном итоге был идентифицирован ген, получивший имя CCR–5, с которым все это связано. За этой непонятной для непросвещенного читателя аббревиатурой скрывается ген, определенное изменение в котором (выпадение небольшого участка ДНК) придает человеку невосприимчивость к вирусу иммунодефицита человека. Большинство людей подвержено этой страшной вирусной инфекции, а вот индивидуумам с такой мутацией она не страшна. В настоящее время создана карта, примерно отражающая распределение этой мутации в гене CCR–5 в Европе. Особенно часто (до 15% населения) она встречается среди финно-угорской группы населения. Обнаружение такого мутантного гена может привести в конечном итоге к созданию надежного способа борьбы с одним из самых страшных заболеваний нашего века.
Полиморфизм в генах-триггерах (генах-переключателях) часто связан с тяжелыми мультифакторными заболеваниями. В частности, отдельные варианты гена ApoE ассоциированы с развитием таких патологий, как атеросклероз и болезнь Альцгеймера. В качестве генов-триггеров рассматривают также многочисленные онкогены и антионкогены, мутации в которых изменяют метаболизм клетки в целом и приводят к ее злокачественному перерождению.
Зная все это, молекулярная медицина имеет возможность предсказать развитие тех или других патологий у конкретного человека. За этим следует ряд превентивных мер, а в отдельных случаях и направленное лекарственное воздействие. Уже в ближайшем будущем вполне реален такой сюжет. После проведения анализа медики говорят пациентке так: курение вредно для организма, но многие, зная об этом с детства, тем не менее курят. Однако предупреждаем — у вас лично в геноме присутствует «вредный» вариант гена N-ацетилтрансферазы 2. Если другим женщинам курение еще может и сойти с рук, то вам почти на 100% гарантирован рак молочной железы. Вряд ли после этого пациентка будет курить.
Важной особенностью человека служит способность говорить, общаться с себе подобными. Но у некоторых людей эта способность нарушена. Изучение причины такой патологии в одной довольно многочисленной семье, где все ее члены не могли членораздельно выражать свои мысли, привело к обнаружению «гена речи», дефект в котором и вызывал эту аномалию.
Многочисленные важные для медицины результаты получают на животных как на моделях. Для этого работу мутантного гена изучают с использованием специально полученных культур клеток и трансгенных животных. Смоделировав на животных болезнь человека, их можно затем использовать для подбора лекарств, влияющих на разрушительное действие мутантных генов, например препаратов, которые останавливают гибель клеток.
Иногда идут другим путем. У лабораторных животных с помощью «генного нокаута» полностью выключают тот или иной ген-кандидат, чтобы лучше понять его функцию. Так, итальянские ученые обнаружили ген, играющий ключевую роль в развитии кокаиновой наркотической зависимости. У мышей без гена mGluR5 (этот ген был выключен — нокаутирован), в отличие от нормальных мышей, пристрастие к кокаину не возникало. Нормальные же мыши быстро привыкали к наркотику. С помощью специального приспособления они вводили себе дозу кокаина по 25 раз за два часа. Эти эксперименты открывают новое направление в изучении причин наркомании у людей и поиска путей борьбы с этим тяжелым недугом.
Когда установлена связь заболевания с одним из генов, можно начинать поиск методов лечения. Выяснение механизмов развития того или иного заболевания помогает разрабатывать новые препараты, которые действуют на причину болезни, а не на симптомы. В конечном итоге должны быть разработаны способы и средства лечения большинства болезней человека. На это, скорее всего, потребуются десятилетия, может быть, даже сменится нынешнее поколение людей, однако любой успех на этом пути, без сомнений, стоит затраченных средств, усилий и времени. Благодаря молекулярной медицине в будущем, вероятно, будут созданы новые лекарства, гораздо более избирательные и эффективные, чем ныне существующие, поскольку они будут целенаправленно действовать на строго определенные генные и белковые мишени.
По мнению главы американской программы исследований генома человека Френсиса Коллинза, уже в первой половине XXI века лечение самых разных недугов будет основано на использовании синтетических генных продуктов, которые станут изменять работу заболевших клеток и органов в нужном направлении.
Теперь, когда молекулярная природа многих наследственных патологий установлена, их можно обнаружить даже на внутриутробной стадии. Это позволяет прерывать беременность или заблаговременно начать лечение ребенка. Например, в результате таких мер в некоторых странах за последние годы доля детей, больных талассемией (болезнь крови), снизилась более чем в 20 раз. Моногенные наследственные заболевания легче определяются, часто первые клинические симптомы проявляются на сравнительно поздних стадиях. Это дает возможность диагностировать их до появления первых признаков патологии. Речь идет о таких заболеваниях, как рак молочной железы, хорея Хантингтона, рак толстой кишки, миотоническая дистрофия и др.
Прогресс в секвенировании генома человека ускорил понимание и молекулярной природы сложных генетических заболеваний. Со строго определенными генами связано относительно немного заболеваний. Подавляющее же их большинство, в том числе такие «главные убийцы», как сердечные, возникает при участии многих генов и белков, с одной стороны, и под влиянием окружающей среды — с другой. Все это сильно усложняет ситуацию. Для выхода из этого положения используют несколько методов. Один из них, весьма трудоемкий, заключается в изучении большого числа семей с определенным типом заболевания. Так, американец Р. Лифтон провел со своими коллегами обширное исследование многочисленных семей с синдромом повышенного давления. Это позволило обнаружить у них специфические мутации примерно в десятке разных генов. Многие из этих генов кодируют почечные белки, которые участвуют в транспорте солей и других метаболитов.
Другой путь — изучение соответствующих мутаций у больных мышей, которые имеют значительное генетическое родство с человеком. Однако и здесь пока не все так просто.
Весьма полезной базой для решения этих вопросов может служить большая клиническая информация, разбросанная сейчас по разным институтам и медицинским центрам. Для формирования такой информационной системы сейчас уже создаются огромные международные базы данных по сложным генетическим заболеваниям. Например, программа LURIC (The Luwigshafen Risk and Cardiovascular Health Study) поставила своей целью идентифицировать новые факторы риска генетической природы и окружающей среды для болезней сердечно-сосудистой системы. Далее с помощью функциональной геномики будет осуществляться поиск новых маркеров и генов, вовлеченных в эти сложные заболевания.
К сожалению, наши новые знания пока еще слабо отражаются в медицинской практике на процессе лечения. И это понятно — мы находимся только на первом этапе пути к полному пониманию функций человеческого генома. Тем не менее, в самое ближайшее время наиболее важный практический выход наших знаний о геноме человека ожидается в генной диагностике болезней, лечении и профилактике наследственных и врожденных заболеваний и пороков.
Уже давно бытует хорошо известное мнение, что все болезни от нервов. Это утверждение, как и многие другие категоричные заявления, конечно же, однобоко. Из вышеизложенного очевидно, что в основе большинства патологий лежат не нервы, а человеческий геном. Большая часть заболеваний человека имеет генетический компонент. Роль генетических нарушений может быть ведущей или второстепенной, но она есть почти всегда. «Психологический фактор» действительно играет порой существенную роль как в развитии заболевания, так и при его лечении. Но это уже проблема не генетиков, а психологов.
На фоне современных достижений медицинской геномики довольно архаичным звучит заявление Ватикана, сделанное в начале 2002 года, что ему удалось найти источник всех человеческих болезней. По мнению иерархов католической церкви, все заболевания становятся результатом тех или иных грехов каждого конкретного человека, поэтому все люди могут, в принципе, быть абсолютно здоровыми и хорошо выглядеть. Вот так! И ничего делать не надо. Зачем только ученые тратили и продолжают тратить баснословные денежные средства на изучение структуры и функции генома человека?
РАК — ПРОБЛЕМА ПРОБЛЕМ (онкогеномика)
Чего не понимают, тем не владеют.
И. Гёте
Одно из важнейших направлений в медицинской геномике — онкогеномика — направление науки, изучающее молекулярно-генетические механизмы злокачественного перерождения клеток. Раковая (злокачественная) опухоль как правило представляет собой группу клеток организма, которая приобрела способность к неограниченному делению, имеющая свою систему снабжения всеми необходимыми веществами, независимая от систем регуляции, действующих в нормальном организме, и способная распространяться в другие органы и ткани.
Проблема рака всегда чрезвычайно остро стояла перед человечеством. Признаки опухолей неоднократно обнаруживали на сохранившихся костных останках с времен палеолита. Рак был известен медицине еще в глубокой древности, однако даже в 18 веке (до открытия микроскопа) его нередко смешивали с другими заболеваниями — проказой, сифилисом и туберкулезом. В различных летописях можно найти клинические описания далеко зашедших форм этого заболевания. Так, например, неизвестный летописец очень подробно описал в 1160 году «зловонную язву» на лице князя Владимира, которая уничтожила ему нос и верхнюю губу. Поскольку часто опухоли (припухлости) имели «пальцевидные» отростки (клешни), которые проникали в окружающие ткани, они и получили образное название «рак».
В настоящее время эта проблема не только не потеряла свою актуальность, но даже приобрела еще большую остроту. Согласно официальной статистике, от онкологических заболеваний в России ежегодно умирают более трехсот тысяч человек. В США в 2002 году по оценке ученых от рака погибло около 550 тысяч человек. При этом наибольший процент смертности составят рак легких и бронхов. У женщин на втором месте — рак груди, а у мужчин — рак простаты. В цивилизованных странах каждый пятый человек умирает от рака; только сердечно-сосудистые заболевания по смертности опережают или разделяют эту трагическую «пальму первенства». В развивающихся странах частота раковых больных была всегда ниже. Но сейчас, в связи с увеличением продолжительности жизни и проникновением в эти страны «цивилизации», и здесь отмечают повышение онкологической заболеваемости.
Однако медики не виноваты в том, что они до сих пор не могут найти радикальных средств для лечения этого страшного недуга. Многое определяется биологией человека, а биология человека упирается главным образом в его геном. А рак — это прежде всего болезнь генома. Поэтому только детальное его исследование может решить проблему рака.
Еще в 1910 году выдающийся российский ученый И. И. Мечников печатает в газете «Русское слово» статью, в которой пишет буквально следующее: «Одна причина рака, безусловно, находится в самом организме, но другая попадает в него в виде экзогенного начала, скорее всего — вируса». И вскоре ветеринарный врач П. Раус представляет доказательства вирусной природы плотной (иначе, солидной) опухоли кур, теперь называемой саркомы Рауса. Это открытие было сделано в 1911 году, а Нобелевская премия за него была присуждена Раусу только через полвека. Наконец, в 40-х годах прошлого столетия советским ученым Л. Зильбером была сформулирована вирусно-генетическая гипотеза происхождения рака. В известной мере она остается в силе и сейчас.
Однако теперь мы понимаем, что большинство раковых заболеваний не связано напрямую с вирусами, не являются они и наследственными патологиями. Свыше 90% злокачественных заболеваний возникает как результат нарушений структуры генома (мутаций, причем, как правило, множественных), происходящих в соматических клетках отдельных органов и тканей уже во время жизни человека. Такие мутации часто происходят спонтанно, в них активное участие принимают и различные факторы окружающей среды (условия проживания, радиация, диета, курение и др.). Станислав Лем пишет: «Вирусную гипотезу рака можно примирить с мутационной, поскольку биохимическое родство вирусов и генов весьма значительно. «Ген рака» может быть в известном смысле «вирусом рака». Вирусом мы называем, однако, систему, чуждую организму, врывающуюся в него извне. В этом, собственно, единственная разница».
Любая ли мутация в геноме приводит к раку? Конечно, нет. Постепенно был выявлен определенный спектр генов, мутации в которых имеют прямое отношение к злокачественному перерождению клеток. Теперь такие гены называют протоонкогенами, а мутировавшие протоонкогены — онкогенами (прошу не путать с канцерогенами). Кроме того, имеются и антионкогены, которые препятствуют развитию рака. Но если в них произойдет мутация, то они уже не способны выполнять свою функцию, что в конечном итоге также способствует злокачественному перерождению клеток.
Первой реакцией ученых на обнаружение онкогенов было удивление. Но, как писал В. Я. Александров, «удивление — лучший повод для исследования». Получалось, что в геноме человека изначально имеются гены, которые только и ждут момента, чтобы нас с вами уничтожить. По этой причине первоначалоно стали говорить о существовании «внутреннего врага», «генов смерти», которыми человека снабдила эволюция для своевременного освобождения человеческой популяции от неполноценных стареющих организмов. Но, конечно же, дело не в этом. Даже само название «онкоген» довольно условное. В норме большинство из этих «онкогенов» кодирует ключевые белки, участвующие в процессах нормального развития человеческого организма, дифференцировки и размножения его клеток. Естественно, что поломка в них приводит к аномалиям данных процессов и, как результат, вызывает неконтролируемое размножение клеток — а, следовательно, рак. Известно уже много примеров, когда в результате всего лишь единичной замены нуклеотида в гене функция белка искажается до неузнаваемости.
Сегодня, благодаря усилиям молекулярных генетиков, мы знаем уже о многих генах, ответственных за возникновение рака. «Классическими» стали онкогены, получившие название MYC, RAS, BCL. Сейчас всего их известно более сотни. Определены спектры злокачественных перерождений, связанных с каждым конкретным онкогеном. Как правило, к злокачественному перерождению клеток приводит не единичная мутация, а некий каскад событий за ней следующих. Это напоминает путешествие героя известного рассказа Борхеса по «саду расходящихся тропок» — по такому пространственно-временному континууму, где каждая причина влечет за собой не один-единственный неизбежный и предопределенный результат, а длинную цепочку событий.
Кроме классических онкогенов в настоящее время изучено уже около трех десятков генов человека, которые осуществляют торможение деления клетки на различных этапах этого процесса и в разных тканях. Эти гены называют «хранителями клеточного цикла» или антионкогенами. Повреждение каждого из таких генов также приводит к развитию определенных разновидностей рака. Так, при анализе большого числа пациентов было установлено, что ген CABLES, расположенный на хромосоме 18, часто перестает работать (почему — это другой вопрос) при болезнях кишечника, панкреатитах и некоторых формах раковых образований. Белок Cables при этом, естественно, отсутствует в раковых клетках. Так и было установлено, что ген CABLES выступает как один из «глушителей» опухоли. В его отсутствие клетки начинают неудержимо делиться, и, в конечном итоге, они становятся злокачественными, если имеют преимущество роста по сравнению с соседними клетками.
Другой пример — хорошо изученное онкологическое заболевание ретинобластома — детская опухоль, развивающаяся на глазной сетчатке. Это заболевание возникает в результате одновременной мутации двух копий антионкогена по имени RB1 (от англ. retinoblastoma). В клетках существуют белки, отвечающие за переход клетки от покоя к делению. А белок, кодируемый геном RB1, служит строгим «сторожем» над ними. Ситуация похожа на пружину механических часов, прижатую стопором — белком, кодируемым геном RB1. Как только стопор отпущен (в гене произошла мутация и он не может выполнять свою функцию), пружина начинает раскручиваться. Результат этого понятен. Ничем не сдерживаемые белки, включающие деление клеток, разгонят клетку на постоянное и быстрое размножение, масса «сумасшедших» клеток будет расти, и в результате образуется злокачественная опухоль.
Кроме перечисленных выше генов, в геноме человека обнаружены также гены, снижающие скорость появления мутаций в ДНК (их называют «генами общего контроля» или «генами-сторожами»). Свою работу они осуществляют по-разному: одни исправляют уже возникшие ошибки, ремонтируя поврежденные участки ДНК, другие участвуют в организации контрольной проверки последовательностей в ДНК перед каждым новым делением. Если ДНК клетки повреждена, эти гены выполняют функцию «санитаров леса», выбраковывая клетку, несущую мутантные гены. Когда ДНК клетки повреждена столь сильно, что надежды на качественную починку уже не осталось, белки, кодируемые специальными геном (наиболее известный из них имеет название р53), запускают внутриклеточный каскад реакций, приводящий к запрограммированной клеточной смерти (этот процесс получил название апоптоз). Термин «апоптоз» или «самоубийство» предложил еще древнеримский врач Гален, будучи заинтригован процессом массового сбрасывания листвы деревьями по осени. В наше время так стали называть запрограммированную клеточную смерть — один из механизмов, регулирующих существование всего живого на Земле. Раковые клетки по сути наделены бессмертием и в лабораторных пробирках могут жить, в отличие от нормальных клеток, много десятков лет. За счет действия антионкогенов происходит то, что мы называем апоптозом — самоубийством. Этим самым организм защищается от возможного развития опухоли, состоящей из потомков «заболевшей» клетки. Влияние на процесс апоптоза — один из путей борьбы с раковыми клетками — клеточными Кощеями Бессмертными. Работы генетиков уже сегодня позволяют искать лекарства, которые могли бы усилить в них апоптоз.
Информация о все новых и новых генах, ассоциированных с раком, появляется и дополняется постоянно. И в значительной мере в этом помогают опыты на животных. Так, выяснилось, что удаление двух генов у мышей, названных ID–1 и ID–3, предотвращает образование рака у таких генетически модифицированных животных. В норме эти гены используются лишь на эмбриональной стадии развития, а у взрослого организма находятся в «спящем» состоянии. Но беда, если они проснутся у повзрослевшей мыши! Пробудившись ото сна, эти гены запускают механизм неконтролируемого роста определенных типов клеток, то есть процесс развития раковой опухоли. Если же этот механизм вовремя выключить, перевести гены снова в спящее состояние, то опухоль тут же перестает снабжаться кислородом, перестает расти и постепенно вообще исчезает.
«Спячка» и «пробуждение» онкогенов нередко связаны с таким уже упоминавшимся процессом, как их избыточное метилирование. Причем в некоторых случаях этот механизм даже более важен, чем возникновение мутации в гене! Фармакология давно уже располагают средствами, которые блокируют специфические ферменты, осуществляющие процесс метилирования. Таков, например, препарат деситабин, который подавляет активность всех трех ферментов метилирования ДНК. Однако пока эти средства не применяются в силу их повышенной токсичности.
А что же с вирусами, с их участием в развитии у нас рака? Постепенно мы начинаем понимать и это. Х. М. Темин (лауреат Нобелевской премии) и ряд других ученых (в России это предположение выдвинул А. Д. Альтштейн) обосновали идею о том, что некоторые вирусы несут онкогены, вызывающие рак у людей, которые привнесены в вирусный геном из нашего же с вами генома (когда-то вирус «прихватил» их из генома человека и теперь это использует в своих корыстных целях). Активные онкогены, попав к нам вместе с вирусом, делают здесь свое «черное» дело. Это, конечно, не единственная причина, почему вирусная инфекция может привести к раку. Например, если вирус внедряется в наш геном (а место его «новой прописки» в молекуле ДНК обычно довольно случайно), это может привести к изменению работы окружающих его генов. Результат этого события непредсказуем, но в ряде случаев оно приводит к злокачественному перерождению клетки.
Безусловно, значительные успехи в изучении рака связаны в основном с исследованиями самих раковых больных. Но для достижения конечной цели необходим огромный клинический материал, тысячи больных с правильно поставленным диагнозом. Чтобы решить столь сложную задачу, в Америке в 1999 году был создан крупный проект по анатомии ракового генома — Cancer Genome Anatomy Project (CGAP). Цель проекта «Геном рака», пришедшего на смену проекту «Геном человека», заключается в использовании данных, полученных в результате расшифровки наследственной информации человека, для поиска причин опухолей. GCAP призван создать платформу, обеспечивающую «интерфейс» раковых исследований и геномики. Для этого участники проекта занимаются составлением каталога генов, экспрессирующихся при развитии рака, поиском полиморфизма этих генов, молекулярным анализом различных нарушений хромосом, ассоциированных со злокачественным перерождением. И вся эта огромная по объему информация доступна любому пользователю на соответствующем сайте Интернета (http://cgap.nci.nih.gov).
Хотя старые подходы к поиску раковых генов позволили найти немало участков ДНК, связанных с развитием таких злокачественных заболеваний, как лимфомы, лейкозы и саркомы, однако они не смогли помочь при поиске генов, которые «виноваты» в развитии других, даже очень распространенных раковых заболеваний. Для облегчения их поиска участники проекта решили изучать по очереди все экзоны (т. е. кодирующие участки) всех генов, обнаруженных после полного секвенирования генома человека, и сравнивать их строение в здоровых и раковых клетках. В планы ученых на первом этапе включено около 50 различных типов опухолей, которые и предстоит исследовать в ближайшие 2–3 года. Учитывая, что в каждом гене в среднем насчитывается до десяти экзонов, а каждый ген необходимо изучить в здоровой и больной ткани для 48 типов рака, предстоит выполнить до 32 миллионов исследований. Это гигантская работа, но она уже начинает приносить свои плоды. Таким путем были, например, недавно обнаружены гены, ответственные за развитие широко распространенного рака простаты. В результате обследования тысяч больных с этой патологией было установлено, что у людей с измененным геном (онкогеном) GSTP1 риск развития рака предстательной железы в молодом возрасте возрастает вдвое. Скорость роста опухоли и вероятность ее рецидива зависят также от одного из вариантов другого гена, называемого hAR
Невозможно описать здесь все эксперименты и успехи, достигнутые в последние годы онкогеномикой. Важно другое. Проблема, хотя и медленно, но постепенно решается. Выявление и систематизация генных мутаций, связанных с разными формами рака, — огромная и весьма трудная задача. Дело в первую очередь в том, что имеется большое разнообразия типов рака. Но и это еще не все. В одном типе опухоли у разных пациентов могут мутировать совершенно разные гены. Более того, даже у одного пациента при развитии опухоли могут происходить какие-то дополнительные мутации, которые и являются определяющими в конечном счете. Ученые полагают, что использование информации, получаемой с помощью крупномасштабных технологий структурной и функциональной геномики, должно привести к экспоненциальному росту числа генов, которые имеют отношение (прямое или косвенное) к раковому перерождению, и разработке новых средств экспресс-диагностики этих заболеваний. В последнем случае большие надежды связывают с такими уже упоминавшимися выше технологиями, как микрочипы и полимеразная цепная реакция (ПЦР). Но сложность заключается в том, что рак — явление чаще всего спорадическое. Семейные случаи заболевания раком составляют лишь около одного процента от всех пациентов онкологических клиник. А постоянно бегать и анализировать свой геном на возможные мутации в сотне разных генов — малореальная перспектива.
Тем не менее, поиск причин возникновения той или иной разновидности рака молекулярные генетики осуществляют вовсе не в погоне за некой интересной для них теоретической информацией. Знание особенностей работы генов опухолевого роста позволяет искать пути восстановления или подавления функции этих генов в опухолевой ткани, а значит, и создать эффективные методы лечения злокачественных заболеваний. Обнадеживающие результаты в этой области уже получены. О некоторых из них мы поговорим далее в разделе «Ремонт генов (генная терапия)». Другой важный результат проведенных исследований уже получил реальное воплощение в медицинскую практику. При хирургическом подходе к лечению рака (а он пока, к сожалению, один из главных) твердую гарантию положительного результата обеспечивает лишь полное удаление всех злокачественных клеток. Но зачастую хирургу во время операции не так-то легко определить, затронут ли опухолью данный участок органа или нет. Вероятность визуальной ошибки велика, а цена ее — жизнь человека. В то же время многие органы нельзя удалять целиком, если мы не хотим нарушить нормальное функционирование организма. И тут на выручку приходит обнаруженная ранее мутация, испортившая ген. Она служит для медиков прекрасным маркером присутствия или отсутствия опухолевых клеток в организме пациента после операции. На западе уже существует множество клиник, где проводятся операции «под молекулярным контролем». Видимая невооруженным глазом опухолевая ткань удаляется хирургом полностью, и сразу после операции вокруг неё через каждые несколько миллиметров берутся микроскопические пробы, которые анализируются с помощью молекулярно-генетических экспресс-методов. Если какие-то опухолевые отростки сохранились после хирургического вмешательства, их удаляют уже через два-три часа после проведенного анализа. Статистика показывает, что средняя продолжительность жизни пациентов после «контролируемой» операции значительно выше, чем у оперированных традиционным образом. Некоторые другие подходы, используемые сегодня для лечения рака, будут описаны далее в разделе «Ремонт генов».
Роль генов в злокачественном перерождении неоспорима. Вместе с тем, как пишет академик Е. Д. Свердлов, мы сегодня неизбежно приходим к осознанию того, что эта проблема — не только проблема генов. Ни одни мутации отдельных «плохих» генов, ни даже те или иные звенья регуляции экспрессии генома, а определенные интегральные процессы в клетках и тканях вовлечены в развитие рака. И это все еще предстоит «распутать» ученым, прежде, чем мы можем сказать: рак побежден!
На сегодняшний день неким утешением, хотя и довольно слабым, для нас может служить то обстоятельство, что рак не является какой-то фатальной неизбежностью, поскольку многие люди, достигшие весьма преклонного возраста, им не заболевают. Но трудно объяснить заболеваемость раком и одними лишь вероятностными причинами. В подавляющем большинстве случаев, для возникновения опухоли одной генетической предрасположенности недостаточно. Всегда необходим какой-то толчок, который заставит онкогены проявить себя. Считается, что 90% всех форм рака у человека спровоцированы действием факторов окружающей среды, таких, например, как вирусы, радиация и различные канцерогены (от cancer — рак, genos — рождение), которых существует огромное множество в окружающей нас природе. Чаще всего именно последние и помогают «нехорошим» генам активизироваться или, наоборот, замолкать.
Считается, что с питанием и курением связано свыше 60% раковых заболеваний, а вот с употреблением алкоголя всего 5%.
Нам же пока остается только надеяться, что онкогеномика сможет решить многие из этих вопросов в ближайшее время, до того как мы с вами лично не столкнемся с этой проблемой.
ГЕНЫ И ПОВЕДЕНИЕ (психогеномика)
Не всяк умен, кто с головою.
Русская пословица
Как уже многократно говорилось выше, геном всех людей, живущих на нашей планете, почти одинаков, но вот поведение разных людей, их умственные способности, психика порой кардинально отличаются. Сталин, Гитлер, академик Сахаров, физик Ландау, театральный деятель Станиславский, певец Лемешев, космонавт Гагарин, адмирал Ушаков, ударник труда Стаханов — это все представители одного вида гомо сапиенс, но какие они разные по своей психике, таланту и поведению! В чем же причина?
До недавнего времени ведущую роль в решении подобного рода вопросов играли психиаторы и психологи, а также ученые, которые занимались поведенческой генетикой — наукой, изучающей наследование характера, темперамента и особенностей поведения человека. Использование ими многочисленных тестов говорило о том, что интеллект все-таки зависит от внешних воздействий, в первую очередь от характера социальной среды, в которой оказался ребенок. Коэффициент интеллекта (хорошо известный как IQ) у детей, которых много и хорошо обучают, можно повысить буквально за год. Эти данные позволили некоторым ученым утверждать и настраивать на это общественность, что интеллект человека определяется только социальной средой и обучением и практически никак не зависит от наследственности.
Параллельно с этим проводились исследования на идентичных, или, как принято их называть, однояйцовых, близнецах, которые наследуют совершенно одинаковые гены (в следующем разделе мы поговорим об этом подробнее).
В результате анализа близнецов, проведенного канадскими психологами, изучающими генетику лидерства и стремления к лидерству, было доказано наследственное происхождение этих качеств. Как характерную иллюстрацию к данному положению психологи приводят судьбу династии Кеннеди, члены которой из поколения в поколение передают своим потомкам этот самый «ген лидерства». Было установлено, что и за такие черты человека, как тревожность и склонность к депресиии, также в определенной мере отвечает наследственность. Однако сам механизм наследования, гены, ответственные за темперамент, наклонности и пристрастия, остаются пока неизвестными. В отличие от генов, определяющих группу крови, формирование конечностей или цвет глаз, выделить «ген лидерства» или, скажем, «ген гомосексуализма» оказалось значительно сложнее.
Но в последнее время, благодаря гигантским успехам геномики, наметился существенный прогресс в этом вопросе. Науку, возникшую относительно недавно на пересечении генетики и психологии можно назвать психогеномикой по аналогии с фрейдовским психоанализом. Основная задача психогеномики заключается в «охоте за генами», формирующими личность, психику и поведение человека.
Однако решение этой задачи оказалось весьма трудоемким занятием. Данные одних ученых зачастую не подтверждаются другими «охотниками за генами». Дело в том, что поведение человека, его психика, зависят, как правило, от большого числа генов и гораздо больше подвержены влиянию внешней среды, чем морфологические или биохимические признаки.
Одним из первых ярких успехов психогеномики можно, по-видимому, считать обнаружение американцем Д. Хэмером и его коллегами определенной взаимосвязи между мужской гомосексуальностью и строением небольшого участка ДНК, расположенного на самом кончике X-хромосомы (эту хромосому мужчины наследуют от своих матерей).
Внимание специалистов разных стран привлекли к себе гены, которые кодируют белки, участвующие в передаче сигналов от нейрона к нейрону в разных отделах нервной системы. Один из таких передатчиков — белок серотонин. Для того, чтобы передать сигнал на другой нейрон, ему необходим еще один белок — рецептор. И, наконец, в клетках имеется третий белок, называемый транспортером серотонина, который разрушает молекулы серотонина в нервных клетках. Так вот оказалось, что с генами, кодирующими эти три белка, тесно связаны некоторые особенности поведения человека, в частности, тревожность и склонность к депрессии.
Первым был найден «ген самоубийства». Таковым оказался ген, кодирующий рецептор серотонина. У людей-носителей определенной мутаций в этом гене часто возникают суицидальные настроения. Так был сделан вывод, что суицид имеет определенную генетическую основу.
Затем ученые США, Германии и России обнаружили и изучили участок в геноме, который управляет работой гена транспортера серотонина. Оказалось, что он существует у разных людей в нескольких формах (аллелях). У людей с повышенным уровнем тревожности и склонностью к отрицательным эмоциям этот участок был длиннее, чем у спокойных и более оптимистичных. Увеличение размера регулирующего участка не проходило бесследно: в клетках увеличивалось количество белка-транспортера, то есть его ген работал более активно, чем в норме. Так было показана генетическая взаимосвязь между работой гена транспортера серотонина и определенным поведением человека. Человеку от родителей «в наследство» досталась длинная аллель гена, и он будет мучаться всю свою жизнь сам и быть в сложных отношениях с окружающими людми! Но дает ли нам что-то то знание, которое получили молекулярные генетики? В данном конкретном случае можно положительно ответить на этот вопрос. Для лечения у людей депрессии было создано несколько лекарств, и среди них наиболее известен медицинский препарат Прозак. Механизм действия Прозака основан на подавлении активности белка-транспортера, в результате чего уровень серотонина в нервных клетках увеличивается. Средство оказалось весьма эффективным.
Другой хорошо известный передатчик сигналов в нерной системе — дофамин. Он также действует на нервные клетки через специфический белок-рецептор. Одна из групп нейронов, производящих дофамин, связана с так называемым центром эмоций и удовольствий. Ранее на мышах было показано, что избыток дофамина вызывает у них исследовательскую гиперактивность. Теперь появились и результаты на человеке. Было обнаружено, что один из генов, кодирующих белки-рецепторы дофамина, может существовать в разных аллельных формах (длинная и короткая). У людей-носителей длинной аллели чувствительность к дофамину понижена, а у индивидуумов с короткой аллелью — повышена. И это сильно сказывается на поведении человека. Люди с длинной аллелью больше склонны к поиску новых впечатлений, и это стремление к новизне проявляется во всех сферах жизни. Обнаруженный ген так и назвали «геном поиска новизны». Видимо неслучайно у американцев длинная аллель гена рецептора дофамина встречается в 25 раз чаще, чем, скажем, у жителей Южной и Восточной Азии. Из истории мы знаем, как заселялась Америка европейцами. Кто ехал тогда в неизвестность в поисках денег и слав? Конечно же, в первую очередь, это были энергичные люди, склонные к авантюризму, любопытные и импульсивные. Вот они то и внесли длинную аллель «гена поиска новизны» в современную американскую популяцию.
Недавно обнаружены два гена, которые отвечают за материнские инстинкты (эти гены — MEST и PEG3 — так и были названы генами «материнского инстинкта»). При этом, ко всеобщему удивлению, выяснилось, что вовсе не женщины, а мужчины определяют такое тонкое чувство, как материнский инстинкт, поскольку оба гена дочки получают от отцов. Опыты на мышах полностью подтвердили эти результаты. Животные, у которых гены «материнского инстинкта» отсутствовали, не заботились о новорожденных, в результате чего только 8% их детенышей оставались в живых. У нормальных же мышей-матерей выживало более 80% потомства. Поэтому, дорогие женщины, ни один мужчина не смеет упрекнуть вас в том, что вы плохо воспитали дочь. Если с дочерью проблема, то вся причина в «некачественном» отце.
Генетики давно подметили, что преступные наклонности, связанные с физическим насилием, присущи некоторым людям от природы. Исследование одной датской семьи, несколько поколений мужчин которой были склонны к немотивированной физической агрессии, позволило обнаружить «ген агрессивности». Им оказался ген моноаминооксидазы — фермента, участвующего в проведении нервных импульсов.
Перечисленные успехи психогеномики имеют и обратную сторону. Не исключено, что в будущем суды при вынесении приговора будут принимать во внимание результаты генетического анализа. Например, не так давно адвокаты убийцы в американском суде помогли своему клиенту избежать смертного приговора, использовав результаты генетической экспертизы, подтвердившей наследственную склонность судимого к убийствам. И что в этой ситуации делать пострадавшим?
Необходимо подчеркнуть, что, в отличие от генов, ответственных за развитие организма и его физические параметры, наличие «больных» генов, формирующих психику и поведение, еще не означает стопроцентную обреченность человека на определенные отрицательные проявления. Во-первых, как правило, не один, а совокупность генов отвечает за наши душевные характеристики. Между ними существует очень сложное и порой весьма неоднозначное взаимодействие, эффект которого зависит от множества различных факторов. Во-вторых, как считает большинство ученых, психика и поведение человека лишь процентов на 50 определяются генами. Не меньшую, если иногда не большую, роль в этом играют общество, окружение, воспитание, иными словами, окружающая среда. С точки зрения ученых, считавших, что интеллект определяется средой и обучением на все 100 процентов, это очень мало. Но не вполне правы оказались и психологи начала прошлого века — наследственность тоже не определяет интеллект целиком и полностью. В результате в споре «наследственность — среда» оказались в какой-то степени правы как одни, так и другие. Похоже, что в генах нет строгой программы, которую неукоснительно выполняет организм. Содержащийся в них текст напоминает скорее всего некий набросанный в общих словах план, коему человек порой следует, а порой заметно отступает от него.
О взаимодействии генов и окружающей среды вообще, а не только применительно к человеческой психике, и поговорим далее.
ВСЕ ЛИ В НАС ЗАВИСИТ ОТ ГЕНОМА? (геном и окружающая среда)
Законам природы люди повинуются, даже когда борются против них.
И. Гёте
Как великий художник, природа умеет и с небольшими средствами достигать великих эффектов.
Г. Гейне
Конечно же, надо понимать, что секвенированный геном человека не есть полный ключ к раскрытию всех тайн возникновения, развития и формирования современного человека. Мы живем не в безвоздушном пространстве, а в постоянном ежедневном тесном контакте с окружающей нас средой, с тысячами физических, химических и биологических факторов, которые действуют на нас на протяжении всей нашей жизни. Уже говорилось, что геном — это корень жизни. Поэтому мы и зрим в него. Однако ясно, что многочисленные внешние воздействия также могут влиять на организм, на его функциональное состояние и развитие. Но какова значимость этого влияния? Вопрос очень непростой, особенно если вспомнить трагическую историю развития генетики в нашей стране. Был тяжелый период, когда генетика была отброшена назад на многие годы, когда окружающая среда официально провозглашалась главным фактором развития всего живого.
Одним из важных подходов, который был использован для ответа на поставленный в этой главе вопрос, явилось наблюдение за так называемыми однояйцовыми (монозиготными) близнецами. Такой подход в генетике существует уже давно, он получил и специальное название «близнецовый метод». Этот метод основан на изучении однояйцовых близнецов (то есть людей, имеющих полностью идентичный генетический аппарат) для разделения ролей между участием наследственности и окружающей среды в формировании отдельных признаков и свойств человека. Высокий коэффициент корреляции, близкий к единице, в паре монозиготных близнецов свидетельствует о генетическом происхождении признака, а в паре дизиготных (происходящих из двух разных зигот) близнецов — о формировании признака под влиянием среды.
Однояйцовые близнецы образуются в результате деления одной и той же зиготы и, следовательно, содержат идентичные геномы. Важно, что это не искусственный материал, а материал, поставляемый в руки исследователей самой природой. Хотя появление близнецов — довольно редкое явление (считается, что у человека одна двойня приходится на 80–85 родов; значительно более редки случаи рождения трех, четырех и более близнецов), тем не менее, и имеющихся случаев достаточно для проведения соответствующих исследований.
Близнецы, как необычное явление, привлекли к себе внимание задолго до возникновения естественных наук, в том числе и генетики. Это нашло отражение в многочисленных мифах, легендах, сказках, в изобразительном искусстве. В древности близнецы служили одновременно и предметом страха, и предметом восхищения. В мифах о братьях-близнецах, характерных для индейцев Северной и Южной Америки, один из братьев часто представляется хорошим во всех отношениях, тогда как другой — плохой во всем. Согласно греческой мифологии близнецы Диоскуры (сыновья Зевса) — Кастор и Полидевк — отличались тем, что один из них был смертным, а другой бессмертным. Из легендарных близнецов древнего Рима хорошо известны его основатели Ромул и Рем, вскормленные волчицей. Обращались к этому вопросу и древние философы, и многочисленные ученые в последующие столетия. Однако лишь во второй половине XIX века (1875 год), то есть после трудов Менделя, двоюродный брат Ч. Дарвина антрополог Френсис Гальтон осознал, какое важное методологическое значение имеют однояйцовые близнецы, и понял, что их исследование может быть одним из подходов для понимания взаимодействия наследственности и среды в процессе формирования признаков и свойств организмов.
Близнецовый метод подразумевает сравнение тех или иных свойств, признаков или характеристик между разными однояйцовыми близнецами, а также сопоставление полученных данных с разнояйцовыми близнецами (они происходят из разных зигот и генетически разнятся) и с человеческой популяцией вообще. Насколько генетически подобные близнецы подобны друг другу по фенотипу? Как влияет на их различия окружающая среда? Многолетние исследования позволяют пока лишь частично ответить на все эти вопросы.
Так, еще в XIX веке уже упомнянутый Ф. Гальтон начал изучать папиллярные узоры на крайних фалангах пальцев человека и основал дисциплину под названием дактилоскопия, которая до сих пор с успехом используется в криминалистике (об этом мы поговорим подробнее далее). Отпечатки пальцев являются одним из наиболее признанных способов идентификации человека. Характерные «узоры» закладываются у зародыша уже на третьем месяце развития и сохраняются без изменения в течение всей жизни. При сравнении кожных «узоров» у близнецов было выявлено, что они очень похожи (это очень важно), но, что удивительно, эти «узоры» не всегда полностью идентичны. При исследовании ряда других признаков также наблюдали их небольшие вариации у близнецов: цвет глаз и волос, форма губ, носа, уха. Выявлены и различия в физиологии высшей нервной деятельности. В то же время анализ групп и факторов крови показал полную идентичность близнецов по этому показателю. Таким образом, последние признаки полностью генетически детерминированы. Сложнее обстоит дело в отношении многих других признаков. Использование близнецового метода позволяет говорить лишь о неодинаковой изменчивости разных наследственных свойств человека: группа крови не меняется всю жизнь, цвет глаз и волос меняются относительно мало, а вес тела может значительно варьировать. Вместе с тем исследование близнецов дает ценные данные о роли генетических факторов и факторов среды в аномалиях и болезнях человека. Так, при анализе однояйцовых близнецов и их родителей было обнаружено, что наличие шестого пальца (шестипалость) в некоторой степени определяется генетически, а не есть только результат патологии развития. Крупномасштабное сравнение однояйцовых близнецов друг с другом и с разнояйцовыми близнецами показало, что возникновение таких инфекционных заболеваний, как корь, коклюш, ветряная оспа практически полностью зависит от возбудителя заболевания, а вот полиомиелит и туберкулез определяются кроме того (хотя и в не большой мере) наследственными свойствами человека. В частности, заболеваемость туберкулезом обоих однояйцовых близнецов более чем в 3 раза выше, чем у двух разнояйцовых близнецов. Исследование близнецов, проведенное в Каролинском институте в Стокгольме, убедительно показало существенное воздействие факторов окружающей среды (курения, загрязнений, питания, образа жизни) на развитие некоторых форм злокачественных заболеваний. Вместе с тем отмечено и определенное влияние генетических факторов на возникновение рака простаты, рака прямой кишки и рака груди.
При анализе близнецов удалось выяснить, что умственное развитие, различия в привычках людей также могут объясняться генетически. Так, выяснилось, что однояйцовые близнецы значительно более сходны между собой в отношении умственных способностей, чем двуяйцовые. Если один из пары однояйцовых близнецов слабоумен, то второй оказывается таким же почти всегда. В то же время у двуяйцовых близнецов такое совпадение отмечено лишь в 25%.
Корреляция коэффициента интеллектуального развития (всем хорошо известного IQ) для воспитанных совместно однояйцовых близнецов почти столь же высока, как, например, корреляция веса тела. Но в то же время корреляция IQ между однояйцовыми близнецами, воспитанными порознь, не выше, чем у разнояйцовых близнецов одного пола, воспитанных совместно. Из этого следует, что одинаковые внешние условия способны в той же мере дать вклад в достижение сходных показателей интеллекта, что и генетические различия между разнояйцовыми и однояйцовыми близнецами.
Или другой пример. У детей известна такая патология, как дислексия — неспособность к чтению. Анализ показал, что у однояйцовых близнецов оба ребенка страдают дислексией в 84% случаев.
Канадскими учеными было проведено исследование 336 пар близнецов (как однояйцовых, так и разнояйцовых) на тягу к различным пристрастиям. Оказалось, что из 30 проанализированных пристрастий тяга к 26 из них в той или иной степени объясняется генами. По мнению ученых, наиболее тесно от генов зависят такие пристрастия, как тяга к чтению, занятие групповыми видами спорта, катание на водном мотоцикле. Более того, генетически обусловлены оказались и некоторые мировоззренческие установки — отношение к смертной казни за убийство и проблема запрещения абортов. На интересы близнецов оказывали воздействие многие характеристики личности, в высокой степени передаваемые потомкам. Тем не менее, ученые отмечают, что ненаследуемые характеристики (такие, как индивидуальный жизненный опыт) также чрезвычайно важны в формировании предпочтений.
Российскими учеными было проведено исследование детей-близнецов в возрасте от 7 до 12 месяцев на предмет того, в какой мере генетика и среда влияют на формирование пяти интегральных черт темперамента: агрессивности, раздражительности, активности, чувствительности к наказанию и общительности. Оказалось, что первые три черты темперамента находятся под жестким генетическим контролем: агрессивность поведения младенца во втором полугодии жизни на 94 процента определяется его генотипом, активность — на 89 процентов, раздражительность — на 85 процентов. Но вот чувствительность к наказанию, зависимость от матери и страх перед незнакомыми почти в равной мере зависят от генотипических особенностей и факторов среды. То есть родительское воспитание и влияние семейной среды могут изменить эти биологически обусловленные черты. Наконец, общительность почти на 90% формируется под влиянием среды, которую создают родители.
Интересно, что гены вмешиваются даже в такой интимный процесс, как продолжительность и прочность брака между людьми. Чтобы установить этот факт, исследователи изучили данные о 800 мужчинах-близнецах, как однояйцовых, так и разнояйцовых. Как и ожидалось, состояние дел в семейной жизни у генетически идентичных однояйцовых близнецов было чрезвычайно схожим, а для генетически неидентичных различалось, и часто весьма значительно. Исходя из этого и был сделан вывод о существовании генетической предрасположенности к разводу. По мнению исследователей, зависимость устойчивости брака от генов может быть связана с такими факторами, как склонность к алкоголизму, наркотикам или депрессии, наследственная природа которых известна достаточно давно. Результаты опроса позволили также сделать вывод о том, что на отношение к первому браку в большей мере влияет окружение человека, в частности, устойчивость брака родителей. Генетические же факторы вступают в дело уже в процессе семейной жизни.
Такие тонкие чувства, как ощущение благополучия и удовлетворенности жизнью («счастливость»), значительно сильнее коррелируют у идентичных близнецов по сравнению с разнояйцовыми близнецами, независимо от материального положения, возраста и образования. Проводившие это исследование ученые утверждают, что у нас чувство благополучия на 50% зависит от генетики, а другие 50% — «от сожалений и удовольствий последних часов, дней и недель», то есть от внешних факторов.
Благодаря методу близнецового анализа на генетический уровень вышла и широко обсуждаемая проблема гомосексуализма. Уже имеются достоверные данные, что около 57% однояйцовых близнецов, 24% разнояйцовых близнецов и 13% братьев мужчин-гомосексуалов также являются гомосексуалами. По данным для женщин-лесбиянок, приблизительно 50% однояйцовых близнецов, 16% разнояйцовых близнецов и 13% родных сестер этих женщин также являются лесбиянками. Более того, недавно ученые вышли на гены, коротые во всем этом «виноваты». Таким образом, при определенных обстоятельствах люди становятся гомосексуалистами в силу генетических причин, то есть по сути они — больные люди. Осознание этого поможет решить, хотя бы частично, две проблемы: проблему гомофобии (плохо ненавидеть больных людей) и проблему наметившегося во всем мире агрессивного гомосексуализма (эти люди требуют признания их здоровыми и полноценными, порой даже гордятся своей особенностью). Однако, если рассматривать гомосексуализм как болезнь, как патологию, ситуация кардинально меняется. Трудно представить себе человека, гордо стоящего с плакатом: «Я страдаю импотенцией, поэтому требую к себе уважения, как к полноценному члену общества!». А ведь гомосексуалисты именно так и утверждают себя.
Согласно современным оценкам, такие показатели, как продолжительность жизни, здоровье человека, также в первую очередь связаны с генетическими факторами, роль которых оценивается на уровне 65–70%. Для каждого из нас важно, что при этом все-таки не меньше 30% шансов отводится окружающей среде, нашему образу жизни и особенно нашему питанию.
Многочисленные и разнообразные данные, приведенные выше, позволяют дать ответ на вопрос, поставленный в заголовке этой главы: геном определяет многое в нас, но и окружающая среда не бездействует, а иногда и весьма заметно вмешивается в нашу сущность. Взаимосвязь между генами и окружающей средой ученые иногда сравнивают с заряженным пистолетом и курком. Пистолет не выстрелит, пока не будет нажат курок. Также обстоит ситуация и в клетке, где в качестве заряженного пистолета служит весьма чувствительный ген или комбинация генов, а функцию курка выполняют всевозможные факторы окружающей среды. Имеется и другое сравнение — с карточной игрой: хороший игрок может выиграть и с плохими картами.
Чтобы разобраться в тех многочисленных взаимосвязях, которые существуют между проявлением отдельных вариантов генов и влиянием на этот процесс различных факторов окружающей среды, был создан специальный международный проект — The Environmental Genome Project. Среди множества задач данного проекта главной является, конечно же, изучение влияния окружающей среды на продолжительность жизни, а также на возникновение и развитие различных заболеваний человека. В конечном итоге этот проект может оказаться не менее важным и сложным, чем знаменитый и очень дорогостоящий проект по секвенированию генома человека. А в том, что он будет продолжаться по времени значительно дольше, чем геномный проект, нет никакого сомнения.
ПРАВИЛЬНЫЙ ДИАГНОЗ — ПОЛОВИНА ЛЕЧЕНИЯ (генная диагностика)
Надежда выздороветь — половина выздоровления.
Вольтер
Знание структуры генома человека дает сегодня медикам дополнительные возможности ставить уверенно и безошибочно диагноз многих тяжелых болезней. Важно, что при этом врачу совершенно не обязательно видеть самого пациента. Достаточно лишь «прочитать» небольшой определенный участок его ДНК, выделенной из нескольких клеточек человеческого тела (например, из капли крови или даже из волосяной луковицы).
Если известно, какие именно генные мутации приводят к заболеванию, то их можно тестировать еще до появления первых признаков заболевания. Особо актуальна разработка точных ранних (предклинических и пренатальных) методов диагностики наследственных болезней, в связи с большим многообразием их форм (уже известно более 4 тыс. таких заболеваний), изменчивостью клинических проявлений и отсутствием в большинстве случаев радикальных приемов лечения.
Согласно имеющейся статистике, сейчас в России каждый год на 1,2–1,3 млн. родов появляется около 60 тыс. детей с врожденными пороками развития и наследственными болезнями, в том числе около 15 тыс. младенцев с очень тяжелыми патологиями. В настоящее время в России живет около 1,5 млн. инвалидов по причинам генетической природы. Это не только большие проблемы самого больного и его семьи, но и огромный моральный и материальный груз для всего общества. Имеющиеся средства лечения большинства этих болезней пока малоэффективны. По некоторым расчетам, из бюджета в нашей стране на медицинское и социальное обеспечение таких больных выделяются средства, превышающие расходы на среднее образование всех здоровых детей.
Этот груз для общества мог бы быть в значительной мере скомпенсирован благодаря использованию эффективной дородовой диагностики наследственных заболеваний. Возможность ранней диагностики позволяет провести профилактическое лечение и не дать болезни проявиться во взрослом возрасте. Например, при заболеваниях обмена веществ (фенилкетонурия, болезнь Вильсона—Коновалова) в качестве средства профилактики медики используют специальные диеты. В случае смертельной и неизлечимой болезни (например, миодистрофия Дюшенна) дородовая ДНК-диагностика позволяет врачам дать рекомендацию о прекращении беременности на ранних сроках.
Современная генная диагностика целиком связана со знанием структуры генома человека. Пока, к сожалению, эти знания еще далеко не полные. Из нескольких тысяч известных наследственных болезней реально лишь для двух сотен из них найдены гены, мутации в которых приводят к развитию заболевания. Выше уже говорилось об обнаружении генов-носителей болезни Альцгеймера, выявлены «больные» гены болезни Тея—Сакса (вызывает слабоумие, прогрессирующую слепоту и мышечное истощение), синдрома Хантингтона, рака толстой кишки и молочной железы и многих других. Но даже эти скромные успехи уже приносят ощутимые результаты. На сегодняшний день в Японии все новорожденные проходят тест на 11 генетических заболеваний, в Америке — на 7, в России — на два: фенилкетонурию и гипотиреоз. Генетический анализ помогает распознать заболевания даже когда плод еще находится в утробе матери. Сегодня многие супружеские пары, ожидающие рождения ребенка, могут пройти такое тестирование — молекулярный анализ ДНК, полученной из небольшого количества эмбрионального материала. Этот анализ позволяет с высокой точностью предсказать, будет ли плод страдать той или иной из нескольких сотен тяжелых наследственных болезней.
Первые примеры этому уже имеются. Так, недавно появилось сообщение об использовании сверхранней диагностики с целью рождения полноценного ребенка в семье, где ее члены поражены болезнью Альцгеймера. В искусственных условиях оплодотворили яйцеклетку матери сперматозоидами отца. Потом провели анализ 15 зигот на наличие мутаций в гене, ответственном за болезнь Альцгеймера. В большинстве случаев была обнаружена смертельная комбинация генов, а в одном все было в порядке. Использовав эту единственную «полноценную» зиготу, приемная мать родила здорового ребенка. В ином случае ребенок, рожденный матерью, с большой вероятностью (15 : 1) содержал бы «больной» ген. В ближайшем будущем подобные процедуры станут вполне привычными, так как техника предупредительного генетического анализа стремительно развивается.
Первым практическим результатом реализации программы «Геном человека» стало появление принципиально новых подходов к диагностике и лечению наследственных моногенных заболеваний, то есть заболеваний, связанных с нарушениями одного единственного гена. Теперь на очереди стоит генная диагностика ненаследственных заболеваний, в частности, злокачественных новообразований, возникающих спорадически. Выше уже говорилось о большом спектре генных мутаций в разных типах рака у разных пациентов. Ситуация в целом сильно запутана. Но уже сейчас в ряде случаев достигнут значительный прогресс. Например, выявлено свыше десятка генов (называемых прогностическими молекулярными или генетическими маркерами), экспрессия или гиперэкспрессия которых служит неблагоприятным признаком развития рака молочной железы. И здесь должны помочь уже упоминавшиеся выше микрочипы. Возможно, в будущем каждый человек будет носить при себе прибор размером не больше наручных часов, который способен определять само преддверие опухоли. Тогда, возможно, рак станет для нас не страшнее гриппа. И, похоже, наши ожидания этого чуда небеспочвенны. Так, уже появилось любопытное сообщение об использовании микрочипов для «маркировки» животных (началось, естественно, с наших ближайших друзей — собак и кошек). Специальные пятимиллиметровые пуговички, введенные под кожу животным, содержат сведения об их кличках и особо важных приметах, информацию о вакцинации, сведения о владельце и др. Они помогают в поиске наших пропавших братьев меньших. Конечно, пока еще это экзотика. Однако нет сомнения, что в ближайшем будущем все это коснется и человека или в виде микрочипов, или в виде специального генетического паспорта, сходного с гражданским, который мы будем носить в кармане.
Для целей диагностики ученые используют любые зацепки, которые им предоставляет геном. В частности, уже многократно упоминавшийся полиморфизм ДНК, который связан с изменениями не самих генов, а прилежащих к генам участков, вовлеченных тем или иным образом в патологический процесс. Например, установлено, что всего лишь точечная замена (Т–Ц) в области, расположенной за геном CYP1A1, в 2,5 раза повышает риск развития плоскоклеточного рака.
Еще одно интересное применение генной диагностики связано с исследованиями по выявлению генетической предрасположенности человека к выполнению мышечной деятельности различного характера и длительности. Это имеет большое значение для людей, занятых тяжелым физическим трудом, спортсменов. Основным генетическим маркером здесь оказался ген ангиотензин-конвертирующего фермента (ACP), который служит в качестве ключевого фермента системы, регулирующей артериальное давление. Под действием ACP происходит образование активного сосудосуживающего вещества, которое кроме того выполняет функцию фактора роста, усиливающего процессы синтеза структурных белков в клетках миокарда, что приводит к гипертрофии сердечной мышцы. Изучение гена ACP показало наличие в нем полиморфизма, который заключается в присутствии или отсутствии фрагмента длиной 287 п. н. в 16-м интроне. При этом физическая активность человека находится в прямой зависимости от присутствующего в его геноме варианта гена ACP.
Ограничимся этими примерами, поскольку нашей задачей не является описание всех существующих видов геномной диагностики. А их число в настоящее время огромно. Отметим лишь, что подобного рода диагностические анализы медики осуществляют на основе ДНК, используя ряд современных подходов, разработанных первоначально как раз для научного анализа ДНК, а совсем не в практических целях. Теперь же эти подходы стали важным инструментом практической медицины. В первую очередь это уже упоминавшаяся полимеразная цепная реакция (ПЦР). В последние годы для определения вариаций или полиморфизмов ДНК человека стали использовать и микрочипы. С их помощью возможно оценить одновременно тысячи потенциально опасных мутаций и полиморфизмов генома у конкретного пациента. С помощью биочипов можно выявлять генетические ошибки почти так же быстро, как сканер определяет цены на упаковках продуктов в магазине.
В самом ближайшем будущем генная диагностика позволит определять весь спектр генов предрасположенности к заболеваниям у каждого человека. Создание «генетического паспорта» гражданина становится реальностью. Такой «паспорт» должен содержать информацию о наличии мутаций в генах, вызывающих развитие наследственных болезней, и, что особенно важно, вариантов генов предрасположенности к мультифакториальным заболеваниям. Уже сегодня в Западной Европе, США и Канаде в неполном варианте проводится «генетическая паспортизация» по различным медицинским показаниям и просто по индивидуальному желанию. Формируются индивидуальные и семейные базы генетических данных. Таким образом, стихийный процесс «паспортизации» уже начался. Хотя этот вопрос не так прост, как кажется на первый взгляд (подробнее смотрите об этом в главе «Этические проблемы»), очевидно, что «генетическая паспортизация» станет основой профилактической индивидуализированной медицины будущего. Ведь гораздо проще вовремя помочь себе — соблюдать определенную диету, не злоупотреблять солнечными ваннами, не курить, чем заболеть тяжелым заболеванием, не поддающимся никакому лечению.
ДНКовый ТЕКСТ ВМЕСТО ОТПЕЧАТКОВ ПАЛЬЦЕВ (генная дактилоскопия)
Каждый человек отличается от другого и с каждым днем отличается сам от себя.
А. Поп
Многие годы для идентификации личности использовали лишь один эффективный подход — анализ отпечатков пальцев (по-научному — дактилоскопия). В переводе с греческого daktylos — палец + skopeo — смотрю. Считается, что впервые этот термин использовал в 1877 году никому не известный английский служащий Вильям Гершель. Он обнаружил, что папиллярные узоры на руках людей отличаются между собой по особенностям строения и не меняются на протяжении всей жизни. То есть каждый человек как бы промаркирован сторого определенным ярлыком. Первая система классификации отпечатков была создана Фрэнсисом Гальтоном, британским антропологом и кузеном Чарлза Дарвина. В 1892 году аргентинский полисмен Ян Вучетич впервые использовал на практике эту систему и на основе оставленного убийцей на месте преступления окровавленного отпечатка идентифицировал его. В начале XX века в ряде стран был начат систематический сбор отпечатков пальцев для криминалистической идентификации. Стандартом для признания отпечатков идентичными было совпадение 12 деталей узоров на пальцах. В дальнейшем это открытие с успехом использовалось и продолжает использоваться в криминалистике на протяжении уже свыше 100 лет.
Однако не всегда в распоряжении криминалистов имеются интересующие их отпечатки пальцев. Кроме того, некоторые проблемы вообще не могут быть решены с помощью этого подхода. Например, вопрос об отцовстве и материнстве. Странно было бы для решения этого вопроса искать на ребенке отпечатки пальцев родителей, что бы установить степень родства. И вот наступило время, когда для решения этой проблемы на помощь криминалистам пришел геном человека, а вернее, его ДНК. Сейчас широко стали использоваться на практике геномные методы идентификации личности, созданные на базе достижений молекулярной генетики человека.
А начало всему этому было положено англичанином А. Джеффрисом, разработавшим «дактилоскопирование» на основе молекулярного анализа ДНК (сейчас это называют ДНК-фингерпринтированием — от англ. слова finger — палец). Метод геномной дактилоскопии или ДНК-фингерпринтирования дал криминалистам абсолютно надежный тест на идентификацию личности. «Генные отпечатки» позволяют идентифицировать того или иного человека по небольшому количеству практически любого биологического материала (капли крови, одного волоса, слюны, кусочка ногтя, следов пота, спермы). Сообщалось, что разработаны методы, позволяющие проводить идентификацию личности по одной лишь клетке. Так, шотландцу Финдли с коллегами удалось идентифицировать человека по всего одной клетке кожи, оставленной на документе, который был написан 30 лет назад.
Уже тысячи людей осуждены или оправданы только на основании геномного анализа. Ярким примером этому может служить событие, о котором сообщило агентство Associated Press в конце 2002 года. В США был досрочно освобожден человек, отсидевший 15 лет в тюрьме по обвинению в изнасиловании 8-летней девочки. Его осудили на 40 лет. Но теперь, благодаря использованию метода ДНК–фингерпринтирования (напомним, что сам метод появился спустя много лет после суда), была постфактум доказана полная невиновность этого человека в преступлении.
Важен этот тест и для идентификации родственных связей людей (тут и проблемы отцовства и материнства, и проблемы наследования прав и имущества, и многие другие). В старину, чтобы узнать истину в последней инстанции, люди обращались к Дельфийскому оракулу. Теперь они стали «вопрошать» ДНК.
Суть метода геномной дактилоскопии заключается в следующем. За основу молекулярные генетики взяли не гены, а повторяющиеся участки генома человека. Были созданы специальные тест-системы, которые назвали зондами. Зонды — это короткие нуклеотидные последовательности ДНК, позволяющие определять устройство и распределение в геноме тех или иных повторяющихся элементов генома человека. Число отдельных повторов в определенных местах (чаще всего это микросателлиты) для каждого человека строго индивидуально. Например, если в определенном месте нашей молекулы ДНК последовательность ТЦА повторена три раза подряд: ТЦАТЦАТЦА, то вероятность встретить на Земле второго человека, у которого в том же месте ДНК те же три буквы повторяются тоже три раза, практически исключена. После подсчета числа повторов в определенном районе ДНК можно без сомнения утверждать, что он принадлежит или не принадлежит конкретному человеку. Процедура установления личности (типирования) состоит в следующем. Первоначально выделяют ДНК из любого биологического материала (кровь, сперма, кусочек кожи, волосяная луковица). Затем ДНК «нарезают» рестриктазами на фрагменты и с помощью электрического поля выстраивают эти фрагменты в ряд строго по размеру. Далее проводят гибридизацию с радиоактивным зондом и расположение связывающихся с зондом (гибридизующихся) фрагментов определяют методом радиоавтографии, т. е. на рентгеновской пленке. При засвечивании рентгеновской пленки выявляются располагающиеся друг под другом черные полоски, так что радиоавтограф ДНК внешне чем-то напоминает штриховые коды на упаковках товаров в магазинах (рис. 34).

Рис. 34. Молекулярный документ (ДНК-фингерпринт), отражающий длины микросателлита, однозначно свидетельствующий о родственных отношениях отца и матери с их детьми. Слева — строение кластеров одного из микросателлитов (ГГСАГГАГ) у родителей и детей, справа внизу — результат анализа длин микросателлитов, осуществленный с помощью электрофореза и гибридизации: все дети рождены этими родителями
Ярким примером использования ДНК-фингерпринтирования на практике может служить история с идентификацией останков царской семьи. Об этом много писалось в прессе. В 1991 году в болотистом местечке Коптяки под Екатеринбургом были найдены останки (кости) девяти человек. Сразу же было предположено, что это останки последнего российского императора Николая II и членов его семьи, а также людей, застреленных вместе с ними в июле 1918 года в подвале Ипатьевского дома. Чтобы сделать окончательный вывод, к работе приступили генетические детективы. Первые анализы, основанные на генетических маркерах, показали, что кости принадлежат четырем мужчинам и пяти женщинам, в том числе семье, состоявшей из отца, матери и трех дочерей. Далее для идентификации личностей был проведен сравнительный анализ полиморфных участков ДНК, выделенной из костей останков, и ДНК ближайших родственников Романовых, которые были найдены в разных уголках мира. В первую очередь это был внучатый племянник императрицы Александры Федоровны, Филипп, герцог Эдинбургский, супруг королевы Англии. Его генетический материал оказался одинаковым с ДНК обнаруженных под Екатиринбургом женщины и ее трех дочерей. После этого молекулярными генетиками был сделан окончательный вывод: останки принадлежат императрице и трем ее дочерям. Сложнее обстояло дело с самим царем. Поиск был продолжен, и, наконец, нашли еще двух родственников Николая II: графиню Ксению Сфирис (урожденную Шереметьеву) и Джеймса Карнеги, третьего герцога Файфского. Генетический материал митДНК греческой графини и шотландского герцога полностью совпали, а вот митДНК царя чуть-чуть от них отличалась (в ней был один снипс, которого не было у предполагаемых родственников). Но последние сомнения отпали, когда проанализировали митДНК из останков великого князя Георгия, младшего брата последнего русского царя.
В ней обнаружилась та же самая мутация, как и у царя! После этого на 100% было установлено, что в Коптяках под Екатеринбургом найдены останки Николая II и его семьи.
Ради справедливости следует отметить, что, несмотря на все эти весьма убедительные генетические данные, в обществе еще существуют сомнения относительно принадлежности обнаруженных под Екатеринбургом останков царской семье. Но они высказываются в основном не профессиональными молекулярными генетиками, а людьми, зачастую весьма далекими от этой науки. Будущее еще рассудит тех и других, хотя трудно отрицать очевидное.
В любом случае, «мусор» или «эгоистичная ДНК» оказались весьма полезными для криминалистов. Их теперь стали активно эксплуатировать для идентификации личности. И пусть с точки зрения эволюции это прозвучит несколько примитивно, но на практике выходит, что природа вроде бы сотворила «эгоистичную» ДНК специально для прокуроров.
РЕМОНТ ГЕНОВ (генная терапия)
Человеческая природа составлена таким образом и допускает такие бесконечно многочисленные модификации, что ее формирование от дьявола до ангела позволяет ожидать появления всех ступеней совершенства.
К. Фрелих
Итак, генная диагностика «навела на след», показала врачу, с каким конкретным геном связана патология у обследуемого пациента. Хотя этот этап очень важный, но он только первый. Дальше надо приступать к лечению. И если для этого нет соответствующих средств, то правильному диагнозу грош цена. Время, когда болезнь лечили народными средствами, безвозвратно ушло в прошлое (ренессанс всевозможных целителей в России в последние годы говорит лишь об общей смутной экономической и психологической обстановке в стране). Традиционные методы фармакотерапии уже тоже вчерашний день. Современное лекарство — это молекулярная «пуля», которая бьет точно в «мишень», исправляя первопричину нарушений на молекулярном уровне. Такими «пулями» могут служить «здоровые» гены, выделенные из здоровых организмов. В последние годы на базе использования генов в практической медицине появилась совершенно новая технология, сравнимая с процессом ремонта генов, — генная терапия.
Когда клетки потеряли нормальную функцию того или иного гена, для их излечения нужно эту функцию восстановить. Тогда в клетку организма, которая страдает от потери функции, нужно доставить ген, способный компенсировать эту недостающую функцию. Ситуация здесь подобна той, которая возникает при работе компьютеров. Существуют специальные программы, которые позволяют обнаруживать грамматические ошибки в набранном тексте и исправлять их. Суть генной терапии и заключается в исправлении ошибок — искусственном создании необходимых количеств продуктов того или иного плохо работающего гена в организме больного, за счет введения в организм нормального гена, полученного от здоровых пациентов. Но это лишь одно из направлений генной терапии. Другое, не менее важное, связано с тем, что часто болезнь вызывается избыточной функцией некоторых генов, несвойственных нормальной клетке. Это происходит, например, при инфекциях или опухолевых трансформациях. Тогда генному терапевту следует озаботиться тем, чтобы эту излишнюю функцию подавить. Вот эти две стратегии можно считать истинно генно-терапевтическими. Обе они нацелены на коррекцию дефекта клетки генными модификациями этой же клетки. При этом основной ДНКовый текст генома продолжает содержать ошибки, но появляется дополнительный текст (приложение), который указывает читателю (в данном случае клетке) на существование таких ошибок. Это напоминает список типографических опечаток, который иногда встречается в конце книг.
Теоретически мишенью для генной терапии могут быть как клетки тела (соматические клетки), так и зародышевые клетки (яйцеклетки, сперма). Принципиально, что изменения, вызываемые с помощью генной терапии соматических клеток, не передаются следущему поколению. В случае наследственных заболеваний более подходящими для генной терапии могли бы быть зародышевые клетки, изменения в которых должны сохраняться и у потомства. Однако в практическом плане сейчас интерес представляет соматическая терапия, а генная терапия зародышевых клеток — это проблема будущего. Дело в том, что в действительности наследственные болезни можно было бы вылечить раз и навсегда, воздействуя именно на половые клетки или клетки эмбрионов на ранних стадиях развития. Введенный ген, попадая в результате искусственного переноса во множество интенсивно делящихся клеток, способен предотвратить развитие заболевания. Но этот вид генной терапии связан с целым рядом проблем как технических, так и, главным образом, этических. В частности, высказываются опасения, что такой подход можно будет использовать для производства нового поколения «детей на заказ». Теоретически существует опасность «засорения» генофонда человека в результате внедрения искусственных генных конструкций в половые клетки. По всем этим причинам пока используют лишь раннюю диагностику для предотвращения рождения «больных» детей (об этом речь шла выше), а не вмешательство в сам человеческий эмбрион. Реальностью в настоящее время представляется только генная терапия, направленная на соматические клетки взрослого организма.
«Днем рождения» генной терапии считают 14 сентября 1990 года. В этот день группа ученых из Независимого института здоровья США под руководством В. Андерсона начала лечение четырехлетней девочки по имени Ашанси ДеСильва, родившейся с редкой болезнью — наследственным иммунодефицитом — связанной с нарушением работы гена фермента аденозиндезаминазы (ADA). В чем заключалось процедура, использованная учеными? У больной девочки взяли определенные клетки иммунной системы. Эти клетки подвергли генетической модификации вне организма (такой прием получил название ex vivo) — в них добавили инактивированный вирус, содержащий нормальный человеческий ген ADA. Затем «исправленные» клетки вновь перенесли в организм маленькой пациентки. Клетки с новой генетической программой оказались «здоровыми» и обеспечивали синтез нормального белка-фермента ADA. Это привело к значительному улучшению состояния пациентки. Но процедуру пришлось повторять многократно, и окончательное излечение больной так и не произошло. Хотя поначалу успех был ограниченный, тем не менее он вдохновил ученых и медиков на дальнейшие поиски в этом направлении.
Общая схема генной терапии в большинстве случаев одинакова. Сначала клонируют (выделяют в чистом виде) тот ген, который нарушен у пациента, используя для этого клетки здорового человека. Затем этот «нормальный» ген в «голом» виде или в составе специального вектора-носителя вводят прямо в тот или иной орган, который содержат дефектный ген (или его вводят в «больные» клетки, выделенные из пациента). При этом решающую роль играет эффективность доставки гена в клетки и его длительная сохранность в них. Генотерапия сейчас ориентирована в первую очередь на получение генов и векторов, обеспечивающих перенос этих генов в клетки взрослого организма. Для этого используют несколько приемов. Один из них — простая инъекция в пораженный орган раствора, содержащего ген, с помощью шприца. Разработан также прием, называемый баллистической трансфекцией, который осуществляется с помощью «генного ружья» — специального устройства, обстреливающего орган или ткань микрочастицами тяжелых металлов (золото, вольфрам), покрытых генами. Наконец, иногда используют процедуру, называемую электропорацией — воздействуют на клетки электрическими импульсами, которые способствуют раскрытию пор на поверхности клетки и, следовательно, проникновению гена извне в клетки. Для лечения заболеваний легких применяют также аэрозольную генную терапию — больные вдыхают аэрозоль, в которой содержится необходимый «здоровый» ген.
Для повышения эффективности переноса генов широко используют природные свойства некоторых вирусов проникать в клетки. Конечно, вводя в клетки «лечебный» ген, нужно думать о возможных вредных последствиях одновременного переноса с ним вирусных генов. По этой причине для генной терапии берут вирусы, которые должны быть безвредны для человека; кроме того, для дополнительной подстраховки их структуру предварительно существенно изменяют. В результате такие видоизмененные вирусы не способны размножаться в клетках человека и тем самым вызвать в них какую-то дополнительную патологию. Например, для этих целей часто используют различные аденовирусы. В них встраивают «лечебный» ген, а потом такой вирус вводится непосредственно больному. Не обошлось здесь и без трагедии. В сентябре 1999 года в Аризоне умер восемнадцатилетний юноша, которого с помощью генной терапии лечили от недостаточности фермента орнитинтранскарбомилазы. Но этот по сути дела единичный трагический случай не остановил работы по генной терапии. Он всего лишь послужил предупреждением ученым о необходимости быть предельно осторожными при использовании этого подхода.
Из общего числа известных заболеваний человека (примерно 10 тысяч) около 40% составляют генетические или наследственные болезни. Генная терапия применима в первую очередь для так называемых моногенных наследственных заболеваний, т. е. таких болезней, которые связаны с нарушениями всего в одном гене. Дело в том, что в тех случаях, когда лишь единичный ген отвечает за то или иное заболевание, процесс лечения сильно облегчается. В настоящее время, используя информацию о структуре генома человека и его отдельных генов, ученые осуществляют широкомасштабный поиск средств лечения многих традиционно считавшихся фатальными для человека наследственых и приобретенных болезней, для которых известен причинный ген и/или его продукт. В первую очередь это такие заболевания, как гемофилия, муковисцидоз, дефицит аденозиндезаминазы, миодистрофия Дюшенна, некоторые кардио-васкулярные патологии и др. Сейчас уже существуют данные о проведении предклинических и клинических испытаний на базе разных подходов генной терапии для более 30 моногенных, в первую очередь наследственных (т. е. генетических) заболеваний человека. И здесь уже достигнуты определенные успехи.
Ярким примером моногенного наследственного заболевания, которое сейчас активно пытаются лечить с помощью генной терапии, может служить миодистрофия Дюшенна. За этим медицинским термином скрывается смертельное заболевание, связанное с повреждением одного гена под именем дистрофин, который расположен на женской X-хромосоме. Поскольку у мужчин эта хромосома представлена всего одной копией, то они-то и страдают в основном от этого заболевания. Без продукта гена дистрофина мышцы не сокращаются. В результате наступает мышечное бессилие: не поднимается грудная клетка и больной не может дышать, плохо сокращается сердце, не работают ноги. Была получена модель этого заболевания — мыши, лишенные гена дистрофина. Когда таким животным разными способами переносили нормальный ген дистрофина, в результате в ряде случаев у них восстанавливалась нормальная функция значительной массы мышечных волокон (до 25%). Однако при генной терапии миодистрофии у человека необходима генетическая модификация большинства (до 50%) мышечных волокон, разбросанных по всему организму, что требует узконаправленного и высокоэффективного метода переноса генов, который пока еще не найден учеными.
С X-хромосомой человека связано и другое хорошо известное заболевание, так называемая царская болезнь или гемофилия. Этот неизлечимый недуг (кровотечение, которое нельзя остановить) знаком большинству людей в связи с болезнью царевича Алексея. Но и задолго до этого гемофилия была известна как «царская болезнь», поражающая, как правило, высокородных, высокопоставленных особ. Гемофилия обусловлена нарушениями в генах, продукты которых ответственны за свертывание крови. Гемофилия передавалась в царской семье по наследству по женской линии, но страдали ей только мужчины. Дело все в том, что отвечающий за свертываемость крови ген находится только в X-хромосоме, а у женщин их две (в отличие от мужчин): в результате у женщин одна хромосома способна как бы дублировать другую и болезнь не развивается. Подходы для лечения гемофилии первоначально отрабатывались на модельных объектах — мышах и собаках, которым вводили нормальные гены факторов свертывания крови, вставленные в состав вирусов как природных переносчиков генетического материала. Эксперименты на животных прошли успешно, и сейчас уже начаты клинические испытания по лечению гемофилии у человека.
Большое внимание уделялось за последние годы лечению муковисцедоза. Эта болезнь, поражающая примерно одного из 2500 новорожденных в Центральной Европе, вызывается наследственным дефектом гена, ответственного за перенос ионов через клеточную мембрану. При наличии «больного» гена на обеих хромосомах развивается хроническая легочная инфекция и нарушается процесс всасывания питательных веществ из пищеварительного тракта. Когда была найдена причина заболевания, сразу же приступили к разработке способов его лечения с помощью генной терапии. Сейчас пытаются вводить нормальный ген в составе вирусных векторов в легкие путем вдыхания пациентами водно-эмульсионного препарата рекомбинантной ДНК.
Сложнее обстоит дело с заболеваниями, обусловленными неправильной работой нескольких генов (мультигенные заболевания). Большой пробел в наших знаниях о генах, ответственных за такие патологии, пока не позволяет направленно применять генную терапию для эффективного лечения многих из этих заболеваний. При таких заболеваниях, как, например, рак или атеросклероз, недостаточно восстановить одну из нарушенных реакций в клетке с помощью определенного гена, а необходимо понять в целом всю сложную картину заболевания, выявить все гены, участвующие в этом, чтобы привести физиологическое состояние пациента к норме. В таких случаях исходят из того, что введенный в организм «лечебный ген» приводит к синтезу белка, который или сам по себе может оказать терапевтический эффект, или же он изменяет чувствительность больных клеток к действию определенных лекарственных препаратов. Так, среди наиболее распространенных приобретенных (ненаследственных) заболеваний в первую очередь внимание исследователей в области генной терапии приковано к такому заболеванию, как рак (наследственные формы рака по современным оценкам составляют всего около 1% всех раковых патологий). На фоне весьма опасных для организма противораковых средств, используемых в настоящее время, таких, как сильное радиоактивное облучение, введение больших доз чрезвычайно токсичных химических веществ или хирургическое удаление жизненно важных органов, генная терапия представляется весьма «мягким» подходом. Сейчас в борьбе со злокачественными заболеваниями с помощью генной терапии наметилось несколько стратегических направлений. Это, в первую очередь, генетическая модификация клеток иммунной системы для усиления их противоопухолевой активности и подавление работы онкогенов. Но это далеко не все. В частности, один из эффективных подходов в генной терапии опухолей — повышение чувствительности опухолевых клеток к химиотерапевтическим препаратам. Часто для этой цели используют ген, кодирующий фермент тимидинкиназу вируса простого герпеса. Этот ген часто называют геном-самоубийцей или суицидным геном. Дело в том, что присутствие продукта этого гена в клетках приводит к их строго избирательной гибели при введении извне специфического химического агента, называемого ганцикловиром. Клетки, в которых синтезируется вирусная тимидинкиназа, превращают этот препарат в токсический продукт и в результате этого погибают. Отсюда и появилось название у гена тимидинкиназы вируса герпеса — суицидный. Этот и некоторые другие «суицидные» гены пытаются сейчас использовать для уничтожения раковых клеток. Данный метод генной терапии опухолей интенсивно развивается, проводятся широкие клинические испытания на пациентах, в частности, на больных с раком яичников и опухолью мозга глиобластомой. Сообщается, что уже получил одобрение протокол с использованием гена тимидинкиназы вируса герпеса для лечения рака предстательной железы. При этом в железу инъецируется генная конструкция, содержащая вирусный ген, а затем в кровь больного вводится ганцикловир. В результате происходит избирательная гибель раковых клеток, а нормальные клетки остаются неизменными.
Уже прошли успешные испытания на крысах генные аэрозоли, при вдыхании которых осуществляется перенос генов, способных предупреждать рак легких у курильщиков. Ученые использовали для этого в качестве вектора простудный вирус, который способствовал искусственному внедрению в опухолевые клетки мышей гена FHIT, нарушения в котором служат одной из основных причин рака легких. В результате появления в клетках нормального продукта этого гена у животных происходила гибель опухолевых клеток.
Заметные успехи в лечении рака были достигнуты российскими учеными под руководством академика Г. П. Георгиева. Ими обнаружен ген Tag7, продукт которого резко снижает развитие опухоли. В настоящее время рекомбинантные плазмиды с этим геном проходят клинические испытания.
Важным направлением генной терапии выступает и защита нормальных тканей от токсического эффекта химиотерапии и облучения. В этом направлении генная терапия использует, например, такой прием, как введение в стволовые клетки костного мозга гена, обеспечивающего множественную лекарственную устойчивость. Повышение устойчивости к радиоактивному облучению клеток нормальных тканей, находящихся рядом с опухолью, пытаются осуществить за счет сверхэкспрессии в них генов антиоксидантов (например, таких, как гены глутатион-синтетазы или трансферами).
Кроме рака, следует отметить определенные успехи генной терапии при лечении некоторых патологий сердечно-сосудистой системы. В частности, описаны попытки использования генной терапии для предотвращения тромбообразования. Здесь идут по пути генетической модификации клеток кровеносных сосудов, вводя в них гены, продукты которых могут предотвращать формирование тромбов. Активно проводятся работы по усилению процесса роста кровеносных сосудов, требующемуся, например, после инфаркта миокарда и при ишемии нижних конечностей. Для этих целей используется перенос целого ряда генов, продукты которых обладают способностью инициировать процесс сосудообразования (в первую очередь различные факторы роста). И уже появились сообщения о первых успехах на этом пути.
На хомяках уже получены впечатляющие результаты, которые позволяют думать, что в недалеком будущем генная терапия сможет заменить собой пересадку сердца. Эксперимент основывался на факте взаимосвязи между ослаблением сократительной функции сердца, ведущей к сердечной недостаточности, и повышенной экспрессией гена PLN, продукт которого блокирует работу канала для ионов кальция (последние чрезвычайно важны для сокращения сердечной мышцы). Различные факторы, которые считают причинами сердечной недостаточности, могут нарушать регуляцию экспрессии гена PLN, что и приводит зачастую к ослаблению работы сердца. Хомякам вводили вирусный вектор, содержащий мутантный ген PLN, продукт которого (в нем заменена одна аминокислота) имел эффект, обратный нормальному белку. В результате этого у животных, получавших экспериментальное лечение, удалось остановить дальнейшее развитие болезни сердца, в то время как у контрольных, которым ген не вводился, сердечная недостаточность прогрессировала до поздних стадий жизни.
Интерес представляют и исследования, проводимые по генной терапии заболеваний кожи (вернее, кожного эпителия). Прямое втирание раствора ДНК с рекомбинантным геном в волосяные фолликулы открывает эффективный и нетравматический путь для доставки в организм нужных для лечения генетических конструкций.
Ожидается, что в скором времени с помощью генной терапии можно будет даже вернуть зрение слепым. Эта надежда связана с недавними удачно проведенными экспериментами на собаках. Трое щенков, на которых проводился эксперимент, страдали врожденной слепотой Лебера (дегенерация сетчатки). Заболевание связано с отсутствием в клетках одного из ключевых белков. При этом заболевании животные или рождаются слепыми, или слепота наступает практически сразу же после их рождения. Введение больным животным с помощью рекомбинантного вируса нормального гена привело к появлению у них зрения. Ученые надеются, что вскоре начнутся подобные работы и на человеке, глаз которого по устройству похож на собачий.
С помощью генной терапии в экспериментах на крысах удалось добиться устранения у них алкогольной зависимости. Было известно, что важную роль в возникновении чувства удовольствия и алкогольной зависимости играет пептид дофамин. В определенную область мозга крыс, с которой связывают пристрастие к алкоголю, вводили ген, кодирующий рецептор к дофамину (DRD2), с которым дофамин связывается. В результате этого через три дня после введения гена у животных повысилось число рецепторов к дофамину, а содержание самого дофамина и, как следствие, доля спирта в общем объеме выпиваемой жидкости резко снизились.
В последнее время большое внимание в генной терапии привлек к себе ген, кодирующий уже упоминавшийся выше фермент теломеразу. Этот фермент осуществляет удлиннение концевых участков хромосом (теломер), которые в норме укорачиваются при каждом делении клеток. За счет постепенного укорочения хромосом клетки в конечном итоге погибают. Однако при наличии активного фермента теломеразы ситуация меняется. По крайней мере, некоторые типы клеток, в которые вводился ген теломеразы, приобретали способность делиться бесконечно долго. И вот появились сообщения об использовании гена теломеразы в генной терапии. В частности, ген теломеразы вводили мышам с экспериментальным циррозом печени. После этого у животных обнаруживалась теломеразная активность в клетках печени, хотя в норме ее там не было. По мнению авторов, «теломеризация» клеток печени может способствовать восстановлению нормального содержания гепатоцитов, а, следовательно, лечению цирроза. Еще один пример. Мышам с удаленными надпочечниками вводились «теломеризованные» клетки этого органа, что приводило к восстановлению их функции. Существует предположение, что использование «обессмерченных» клеток может быть полезным для создания искусственных органов, выращенных из клеток пациента и поэтому не отторгающихся при трансплантации.
Большое внимание уделяется сейчас использованию генной терапии для борьбы с всевозможными вирусными инфекциями. И здесь активно разрабатывают новую стратегию генотерапии, основанную на «выключении» вирусных генов, работа которых связана с развитием различных патологий. В частности, перед человечеством остро стоит проблема СПИДа. На ее решение направлены усилия огромного числа ученых и медиков. В литературе описано множество различных подходов борьбы с этим пока, к сожалению, полностью не излечимым заболеванием, вызываемым вирусом иммунодефицита человека (ВИЧ). Подключились к этой проблеме и генные терапевты. И уже можно говорить о первых, хотя пока еще скромных, успехах. В частности, на модельных системах показан терапевтический эффект ряда генных конструкций. Поскольку все эти варианты трудно перечислить, остановимся на одном из них. Так, было известно, что в геноме ВИЧ содержится некая последовательность (названная TAR), которая узнает специальный вирусный регуляторный белок. Только после взаимодействия этого белка с TAR-элементом вирус начинает размножаться. Для того, чтобы предотвратить этот процесс, было предложено вводить искусственно синтезированную TAR-последовательность в инфицированные клетки. Регуляторному белку все равно, с чем взаимодействовать — с вирусной последовательностью или с такой же точно последовательностью, искусственно внесенной в клетки. Добавленная в клетки ДНК обеспечивает в данном случае роль «ловушки»: когда в инфицированной клетке на ней синтезируется много РНК, регуляторный белок вируса связывается преимущественно с ними, а не с РНК вируса, и в результате этого вирус перестает размножаться.
Гены, вызывающие многочисленные тяжелые недуги и позволяющие вирусу размножаться, могут быть целенаправленно нейтрализованы с помощью механизма РНК-интерференции (мы уже упоминали о нем). В последнее время на модельных объектах установлено, что интерферирующая микроРНК (т. е. РНК, которая «выключает» действие строго определенного гена) может быть полезной при лечении ряда вирусных инфекций (например, при СПИДе и при полиомиелите), а также нейродегенеративных заболеваний, в частности, болезни Хангтингтона. Так, в результате использования специальных двунитевых микроРНК в экспериментах на мышах у них существенно замедлилось развитие заболевания, аналогичного болезни Хантингтона, а в ряде случаев наблюдалось даже полное восстановление нормального функционирования мозга.
С помощью генной терапии теперь осуществляют и иммунизацию (вакцинацию) организмов, что получило специальное название — ДНК-иммунизация. Процедура иммунизации против вирусных заболеваний с помощью их же собственных «нейтрализованных» белков (они называются антигенами) известна давно. При ДНК-иммунизации вместо белков-антигенов вводят определенные гены. Эти гены, работая в клетках, производят строго определенные белки-антигены, на которые в организме и вырабатывается иммунитет, т. е. образуются соответствующие антитела. Если после ДНК-иммунизации в организм попадет вирус, то имеющиеся антитела будут бороться с ним и уничтожать его. Метод ДНК-иммунизации был тщательно отработан опять же на животных и показал свою высокую эффективность, особенно в отношении таких вирусных инфекций, как клещевой энцефалит, ВИЧ, малярийный плазмодий. Констатируем лишь, что у ДНК-иммунизации имеется ряд существенных преимуществ по сравнению с традиционно используемыми приемами (однако детальное обсуждение этого вопроса есть назначение совсем другой книги).
В печати широко рекламируются первые успехи генной терапии в лечении людей. Отдельные успехи действительно позволяют с оптимизмом смотреть в будущее этого направления. В качестве примера приведем такой случай. У одного американца после операции шунтирования на сердце через некоторое время состояние снова ухудшилось. Новая операция шунтирования была уже бесполезна. И он решил рискнуть: принял участие в новом клиническом испытании на сердце. Прямо в сердце ему сделали укол раствора с геном, который вызывает рост кровеносных сосудов. Уже через 3 недели пациент почувствовал себя почти здоровым. Такой же эффект испытали на себе и 16 других больных, участвовавших в эксперименте. Это был успех!
Приведем другой пример. В 2000 году в США была предложена процедура введения гена, который кодирует образование одного из факторов свертывания крови. Внутримышечное введение такого гена больным гемофилией препятствовало возникновению кровотечений у пациентов. Результаты первых клинических исследований свидетельствуют о том, что после такого лечения пациенты с гемофилией более года не испытывают необходимости в дополнительных инъекциях фактора.
Сейчас уже ясно, что генная терапия может быть использована для лечения не только наследственных, но и для значительно более распространенных приобретенных болезней, таких как диабет, остеопороз, ревматоидный артрит, рак и вирусные инфекции (включая даже СПИД). В частности, нет сомнения, что генная терапия вирусных заболеваний позволит значительно сократить расходы на широко используемое в настоящее время противовирусное лечение, которое далеко не всегда эффективно и, кроме того, нередко сопровождается серьезными осложнениями.
Ученым и медикам предстоит еще решить массу непростых проблем, в частности, проблем, связанных с устойчивым переносом генов, со взаимодействием генетических препаратов с клетками, с опасностью аллергических реакций и т. д. В связи с этим, перспективным методом генотерапии сейчас считается уже упоминавшаяся технология ex vivo. Клеточный материал, взятый от пациента, подвергают in vitro, т. е. в пробирке, генетическим изменениям, а затем ретрансплантируют его снова в организм донора (рис. 35). И уже есть пример успешного лечения семейной формы гиперхолестеринемии с использованием такого подхода. Разработан генно-терапевтический подход, основанный на подсадке в кожу трансформированных in vitro клеток кожного эпителия (кератиноцитов).
Имеются хорошие заделы в плане использования технологии ex vivo для лечения заболеваний суставов (ревматоидных артритов). Ученые из Гарвардского университета в Бостоне предложили лечить пораженные суставы путем прямого введения в них генетически измененных клеток, способных вырабатывать белок, оказывающий противовоспалительное действие. Из пораженных суставов брали клетки и вносили в них ген, кодирующий антагонист рецепторов к белку интерлейкину–1. После нескольких недель выращивания in vitro клетки вводили в суставы. В результате у большей части испытуемых наблюдали значительное улучшение состояния.

Рис. 35. Две основные стратегии, используемые при генной терапии: in vivo и ex vivo
Другой пример, но опять же пока на животных как на моделях. У мышей удаляли надпочечники и затем им вводили не ген, а генетически измененные ex vivo клетки надпочечника с активно работающим геном теломеразы. Это привело к тому, что функции надпочечников были полностью восстановлены.
Однако для широкого читателя очень важно отметить, что на современном этапе еще существует множество нерешенных проблем и поэтому генная терапия пока не получила широкого распространения. Несмотря на очевидные преимущества перед другими способами лечения, это направление пока не стало ведущим. Хотя большая армия ученых работает в области генной терапии свыше 10 лет, реальные успехи этого направления еще не столь велики, как этого хотелось бы. Причин тому несколько. В первую очередь — это отторжение чужеродных генов, вызванное иммунной реакцией организма и быстрым разрушением вводимых генов в клетках. В новой для него клетке ген чувствует себя чужаком. И клетка, не понимая своей выгоды, всячески старается от него избавиться. В результате перенесенный ген существует там, как правило, очень короткий интервал времени, порой не успевая наработать необходимое количество лекарственного продукта. По этим причинам чаще всего излечение получается временное и только у части клеток. Второе — невысокая эффективность современных методов переноса генов в клетки больных. Весьма трудно искусственно внести тот или иной ген во все клетки. Лучше всего было бы встраивать нормальные гены вместо «больных» генов в геном пациентов еще на стадии половых клеток. Такие подходы сегодня разработаны на животных, но для человека по ряду причин это сейчас практически невозможно применять.
Потребуется еще время и большие усилия ученых, чтобы сделать гены лекарствами. Сейчас еще нельзя посоветовать ни одному человеку пойти в аптеку и купить рекомбинантную плазмиду с геном, который его спасет, например, от диабета. Но уже созданы солидные теоретические и методические предпосылки для этого, достигнуты заметные успехи в экспериментах на животных, начаты предклинические и клинические испытания многих новых разработок на человеке. Так что в недалекой перспективе все эти проблемы, без сомнения, будут решены.
На конец 2001 года в мире существовало около пятисот протоколов процедур генной терапии, ряд из которых уже был испытан на 3500 больных (в основном в США). Десятки процедур находятся сейчас на последних стадиях клинических испытаний. Огромный масштаб работ свидетельствует о том, что генная терапия приближается к своему совершеннолетию. По оценкам специалистов, уже через двадцать лет генная терапия совершенно изменит облик практической медицины. На базе генной терапии можно в скором времени ожидать появления новых способов защиты человеческого организма от старения. Вот цитата из интервью с директором Института молекулярной генетики РАН академиком Е. Д. Свердловым (газета «Доктор Фом» за февраль 1999 г.): «Генная инженерия уже сейчас умеет исправлять «испорченные» гены. За считанные годы это умение вырастет тысячекратно. Для биологов уже нет сомнений, что в XXI веке генный аппарат каждого новорожденного будет тщательно проверяться, чтобы избавить человека от многих неприятностей, скажем, от самых страшных заболеваний — генных. И есть немалая вероятность, что одновременно можно будет убирать многие негативные черты характера, которые тоже определяются генами, — такие, как трусость, жадность, эгоизм. И усилить задатки других черт — той же гениальности, ген которой был открыт в прошлом году. А может быть, удастся пойти еще дальше: определив уже в родильном доме поведенческие реакции человека, дать ему и соответствующее воспитание, подготовив его к той нише бытия, в которой ему будет наиболее комфортно. И тогда, возможно, не станет людей, считающих, что их жизнь не удалась, а на Землю придет тот самый Золотой век, о котором человечество мечтает с самого начала своей истории». Хочется надеятся, что после всего вышесказанного читатель вместе с автором разделит оптимизм этих строк.
СМЕРТЬ И БЕССМЕРТИЕ — В НАШИХ ГЕНАХ (проблема долголетия)
Всех, кто стар и кто молод, что ныне живут, В темноту одного за другим уведут. Жизнь дана не навек. Как до нас уходили, Мы уйдем; и за нами — придут и уйдут.
Омар Хайям
Самое страшное из зол — смерть не имеет к нам никакого отношения, так как, пока мы существуем, смерть еще отсутствует; когда же она приходит, мы уже не существуем.
Эпикур
В начале жизни мы юны и здоровы, а потом неизбежно стареем и умираем. Почему же так происходит? Можно ли это преодолеть? К большому для всех нас сожалению, окончательного ответа на эти вопросы пока еще нет. Ни об одном бессмертном человеке ныне ничего не известно. Несерьезно же считать таковыми Дункана Маклауда и его многочисленных соперников из известного телесериала «Горец».
Тем не менее, существует множество легенд, литературных данных и документов о долгожителях. Об одном из них, некоем англичанине Пирсе, большом любителе молочных продуктов, прожившем вроде бы полных 154 года, нам с вами все время напоминают изготовители молока на упаковках своей продукции. Имеются и отдельные более впечатляющие, но менее достоверные сведения. Так, согласно легенде, греческому поэту Эпимениду удалось прожить до 300 лет. Если верить муниципальным записям, китаец Ли Цуньюн жил 246 лет, похоронив за это время 23 жены. Римлянин Плиний Старший в своей «Естественной истории» написал о некоем иллирийце, дожившем вроде бы до 500-летнего юбилея. По библейскому сказанию, отец рода человеческого Адам прожил 930 лет, оставив нам многочисленных потомков. Наконец, в Ветхом Завете повествуется о том. что пророк Мафусаил прожил дольше всех когда-либо живших людей, достигнув возраста 969 лет.
Однако книга рекордов Гиннеса утверждает, что нет ни одного достоверного случая празднования 121-го дня рождения. Сведения о продолжительности жизни некоторых прославленных долгожителей прошлых веков, по мнению специалистов, объясняются тем, что за одного человека принимали отца и сына либо других родственников, носивших одно и то же имя или титул. Самую долгую документально подтвержденную жизнь в 120 лет 137 дней прожил японец Сигечийо Идзуми. Однако в конце концов дело не в том, сумеем ли мы найти или не найти подтверждения мифов о долгожителях. Важно другое. Для того чтобы получить «элексир» продления человеческой жизни, нужно познать истинные причины старения организма.
С древних времен люди искали средства для продления жизни. Выдающиеся умы человечества, среди них Аристотель, Гиппократ, Бекон и другие, посвятили разработке их многие годы. Известно множество всевозможных описаний различных средств, омолаживающих организм, к которым порой неплохо относятся даже некоторые современные врачи. Например, появилось сообщение, что в Тибете в одном из буддийских храмов обнаружены якобы глиняные таблички с рецептом, который монахи используют уже много тысяч лет: натереть 200 г чеснока, поместить в глиняный сосуд, затем налить 200 г спирта и плотно закрыть. Настойку выдержать в темном месте 10 суток, процедить и принимать по 5 г три раза в день за 20 минут до еды, добавляя в холодное молоко. Сходный древний рецепт существует вроде бы в Абхазии: 400 г тертого чеснока смешать с соком 24 лимонов, вылить в банку, завязав горлышко марлей. Принимать две недели подряд в день по 1 чайной ложке, разведенной в стакане кипяченой воды. Французы же считают, что истина — в красном вине. Когда-то пытались омолаживать организм с помощью подсадок в старый организм молодых половых желёз. Считалось, что активная сексуальная жизнь снижает уровень половых гормонов в крови. Однако вскоре выяснилось, что после кратковременного эффекта наступало более быстрое увядание.
Одну из первых, достаточно обоснованных экспериментально научных теорий выдвинул на рубеже XIX и XX веков выдающийся российский ученый И. И. Мечников. Одной из основных причин старения он считал отравление организма особыми ядами — токсинами, продуктами гнилостного распада пищи, происходящего в нашем кишечнике. Он разработал даже специальную диету, которой придерживался долгие годы. Желающим следовать его диете И. И. Мечников советовал в день съедать 120–150 г мяса, не менее 0,5 литра простокваши и побольше растительных продуктов — овощей и фруктов, в числе которых особенно выделял морковь, свеклу, финики и капусту, которые по его мнению, содержат вещества, предотвращающие развитие гнилостных бактерий в толстом кишечнике.
Другая теория старения разработана известным русским физиологом академиком И. П. Павловым и его учениками. Согласно этой теории, нервная система регулирует все процессы в человеческом организме, оказывая тем самым решающее воздействие на обмен веществ, синтез белка, окислительные и энергетические процессы в клетках. Выдвинув свою теорию старения, ученый поставил под контроль прежде всего себя. Основу его образа долгой жизни составлял строгий режим, заключавшийся в чередовании труда и отдыха.
Итак, существует множество разных идей и конкретных советов, как продлить свою жизнь. Порой они сильно противоречат друг другу. Занимайтесь спортом, не курите, не употребляйте алкоголь — говорят одни. А другие, наоборот, утверждают, что повышенные спортивные нагрузки могут принести не меньше вреда, чем лежание на диване. Такие нагрузки увеличивают количество вредных свободных радикалов в организме. А вот стаканчик вина или другого алкогольного напитка в умеренных количествах будет успешно бороться с ними. Например, поможет уменьшить риск сердечно-сосудистых заболеваний. А в пиве содержатся сильные антиоксиданты, которые препятствуют помутнению хрусталика глаза (канадские медики считают, что даже одна кружка этого напитка в день значительно снижает риск развития катаракты). Так что сколько людей, столько мнений.
Возможно, что-то из всего вышеперечисленного действительно полезно, но насколько — еще вопрос. Невозможно экспериментально проверить на себе все имеющиеся рецепты. В любом случае все это практически никак не решает проблему долголетия.
А эта проблема весьма серьезная, особенно для России. По данным Госкомстата на конец 2002 года наши мужчины живут в среднем 58 лет, 11 месяцев и 16 дней. А женщины — 72 года, 4 месяца и 4 дня. Если сравнить с Древним Римом, самым процветающим по тем временам государством, где средняя продолжительность жизни составляла 20–25 лет, то все вроде бы и не плохо. В конце XIX века долгожителями являлись шведки, жившие в среднем по 45 лет. Но вот в современной Европе, США и Японии продолжительность жизни далеко за 70 лет у мужчин (например, в Японии и Швеции — 77 лет) и за 80 — у женщин. В результате по оценкам специалистов к 2010 году население России может сократиться до 136 млн. человек (в 1999 году россиян было 146,3 млн.). Причем по этим прогнозам русских будет всего 107 млн., по сравнению со 118 млн. в 1999 году.
Чтобы решить проблему долголетия, в первую очередь нужно знать как факторы, так и причины, его определяющие. И вот секвенировали геном человека. В связи с этим вновь возродились различные мечты, самая острая из которых если не бессмертие, то существенное продление средней человеческой жизни и, главное, ее активной, творческой части. Очень хочется верить, что теперь эта мечта не совсем беспочвенна.
Сегодня молекулярным генетикам стало ясно, что многие болезни старости закодированы в геноме человека. И ученые занялись активным поиском «гена долголетия», который продлевал бы жизнь, не оказывая при этом никаких других нежелательных эффектов. В своих поисках они исходили, естественно, в первую очередь из существующих теорий, пытающихся объяснить старение организма. Согласно теории англичанина Эддингтона, число гипотез и теорий, объясняющих какое-либо явление, обратно пропорционально объему знаний о нем. Как бы в подтверждение этой теории, таких гипотез по проблеме старения сейчас накопилось целое море (их насчитывают свыше 300).
Поскольку манипуляции с геномом человека пока невозможны, то для решения человеческих проблем часто используют наших «братьев меньших» — различных лабораторных животных. Как уже говорилось, сходство между нами и ими на геномном уровне позволяет изучать работу какого-либо гена у более простых организмов — так проще, дешевле и быстрее, — а затем использовать эти результаты применительно к человеку. И такие манипуляции уже начинают приносить первые, весьма обнадеживающие результаты. Вот некоторые примеры.
Уже давно обсуждалась возможная связь между старением и процессами, происходящими в таких структурах клетки, как митохондрии. Митохондрии — это «электростанции» клетки, которые вырабатывают энергию за счет происходящих в них процессов окисления. 98% кислорода, потребляемого митохондриями при дыхании, превращается в воду, в то время как оставшиеся 2% за счет паразитных химических реакций дают побочные продукты — агрессивные частицы, называемые свободными радикалами. Эти частицы весьма токсичны для клеток, они вмешиваются в нормальную работу многих клеточных механизмов, вызывают повреждения разных клеточных структур. И с возрастом такие дефекты накапливаются. В результате митохондрии начинают вырабатывать все меньше и меньше энергии и человек слабеет. Надо было проверить эту гипотезу.
Давно уже известно, что предотвратить «окисление» клеток можно и с помощью химических препаратов, так называемых антиоксидантов. Лауреат двух Нобелевских премий Лайнус Полинг не зря считал, что для продления жизни важнейшим служит особый режим питания и использование определенных витаминов и антиоксидантов. Если верить очевидцам, сам он в течение многих лет каждый день употреблял по 1 г витамина С и умер на 93-м году жизни.
Эксперименты итальянских исследователей на мышах подсказали другое решение проблемы. В результате выключения работы одного из генов (его имя p66SHC) мыши становились более устойчивыми к действию факторов, вызывающих окислительный стресс, и их продолжительность жизни увеличивалась на 35%. Ген p66SHC представляет собой своеобразный «винтик», регулирующий сопротивляемость клеток окислению. Таким образом, ученые научились подкручивать этот «винтик», регулируя тем самым процесс старения. Сами авторы утверждают: «Теперь мы точно знаем, что продолжительность жизни поддается управлению. Нам удалось на треть продлить жизнь подопытным животным, хотя они выросли менее активными и отличались меньшими размерами по сравнению с нормальными особями. Однако животные, будучи изолированы от естественной среды обитания, выросли вполне здоровыми, и других побочных явлений замечено не было». Конечно, вывод авторов кажется чересчур оптимистичным, хотя в целом и не лишен некоторых оснований. Такой же ген с такими же функциями имеется и в геноме человека. Из всего этого следует вывод: поиск средств, изменяющих работу гена p66SHC, может быть весьма важным подходом для предотвращения процессов старения у человека.
И еще пример, как исследования на других организмах помогают понять проблемы человека. В геноме одного из излюбленных генетиками простого объекта — червя с трудным родовым именем и простым видовым Caenoharbditis elegans — обнаружено несколько генов, мутации по которым увеличивают продолжительность его жизни. Как показали канадские исследователи, одновременное выключение двух из этих генов продлевает жизнь червя более чем в пять раз. Позднее в геноме человека был также обнаружен ген, весьма сходный с одним из двух генов червя. Анализ продукта данных генов у червя показал, что он участвует в переключении с бескислородного метаболизма клеток на кислородный. Так появилась еще одна «подсказка» для поиска путей продления жизни человека. Если считать человеческий век равным 100 годам, то человек, подвергшийся той же операции, что и червь, теоретически способен прожить лет пятьсот. Однако надо иметь в виду, что эффекты, наблюдаемые от применения разных продлевающих средств, испытанных на животных, на людях, как правило, оказываются значительно скромнее.
В последние годы объектом пристального внимания исследователей, занимающихся проблемой старения, стали концы хромосом. Здесь имеются структуры-наконечники, о которых выше уже шла речь, называемые теломерами. Они служат как «защитники» хромосомы, но в обычных нормальных клетках, как правило, при каждом делении эти структуры становятся все короче и короче. Именно в этом, по мнению ряда ученых, и заключается одна из причин старения. При отсутствии специального фермента теломеразы в нормальных соматических клетках происходит укорачивание хромосомы, сопровождающееся потерей важных генов. Наоборот, бессмертие ряда клеток в культуре вне организма, свойственное, как правило, клеткам из опухолей, объясняется реактивацией фермента теломеразы.
Какова причина этого? У бактерий ДНК имеет форму кольца. Когда нужно сделать копию, определенный белок-фермент садится на нее, затем ползет по ДНК и наращивает ее копию. Естественно, при этом всегда и справа, и слева есть молекула ДНК, ведь она же кольцевая. В результате этого бактерии, вероятно, и являются бессмертными (есть такая точка зрения). Но вот у высших организмов, включая человека, молекулы ДНК расположены в хромосомах и линейны. При этом «копирующий» механизм остался прежним. Он по-прежнему работает в полной мере только тогда, когда у него с двух сторон есть генетический материал. Соответственно, самый кончик молекулы ДНК высших организмов в такой ситуации не может копироваться. Как результат, у таких организмов каждая новая копия ДНК оказывается короче предыдущей. Выяснилось, что в результате такого процесса теломера может уменьшиться до определенной величины, после которой клетка перестает делиться: она старится и умирает. Мысль о том, что длина теломеры хромосом может служить в качестве «часов», отсчитывающих время жизни клетки, была высказана нашим соотечественником А. М. Оловниковым еще в 1973 году. Лишь позднее выяснилось, что в геноме человека есть ген, кодирующий белок теломеразу. Этот белок-фермент способен удлинять теломеры, но в основном он работает в раковых клетках, что, вероятно, и является одной из причин их «бессмертности». В экспериментах на нормальных клетках уже показано, что искусственное увеличение количества теломеразы делает клетки более долгоживущими. Возможно, уже через несколько лет на основе теломеразы будет создано лекарство, которое если и не решит проблему старения окончательно, то сможет существенно продлевать жизнь человека.
Примеры того, как исследования на животных указывают на генетические основы долголетия, можно было бы продолжить и приводить долго. Так, в эксперименте на мухах-дрозофилах удалось обнаружить ген, ответственный за продолжительность жизни. Ген продления жизни ученые назвали «Я еще не умер» («I'm not dead yet») или сокращенно Инди (Indy). Однако пока остается непонятным, имеет ли он отношение к долголетию человека.
В 2001 году американским ученым вроде бы удалось заметно сузить область поиска генов человека, которые отвечают за долголетие. Такие гены, по их мнению, находятся в определенном участке хромосомы 4. Хотя большинство исследователей считает, что продолжительность жизни определяется большим, порядка тысячи, числом разных генов, авторы последнего исследования не согласны с этой точкой зрения. Они изучили гены близких родственников тех людей, которых можно назвать долгожителями, и искали у них общие участки хромосом. С вероятностью 95 процентов был выявлен участок хромосомы, который содержит всего от 100 до 500 генов, среди которых должен быть и ген долголетия. Именно он был общим у участвовавших в исследовании людей. По мнению авторов исследования, после определения гена или нескольких генов, ответственных за долголетие, удастся создать лекарства для продления жизни.
Исследуя один из генов дрожжей, ученые обнаружили, что он снижает уровень поглощения калорий и замедляет скорость метаболизма в клетке, что должно приводить к замедлению процесса старения. Так возникло представление еще об одном ключе к механизму управления старением.
Другой кандидат на роль гена жизни был выявлен американскими учеными из Университета имени Джона Хопкинса. Этот ген авторы назвали в честь греческой богини судьбы Клото, одной из трех мойр, которая, согласно легендам, прядет жизненную нить человека, определяя срок его жизни. Стратегия поиска данного гена была таковой. Был проанализирован генетический материал около двух тысяч новорожденных и пожилых людей, относящихся к разным этническим группам. Наличие определенных форм гена Клото у пожилых людей сравнивали с таковым у детей. Оказалось, что среди детей две копии измененной версии гена Клото встречались в два раза чаще, чем у людей старше 65 лет. По мнению ученых, это означает, что люди, имеющие две копии дефектного гена, в среднем умирают раньше, чем те, кто имеет лишь одну копию или не имеет ни одной. Таким образом, обнаружена четкая корреляция между наличием нормального гена Клото и продолжительностью времени жизни человека.
Согласно одной из наиболее распространенных гипотез, одряхление организма представляет собой накопление гибельных ошибок и других повреждений генов, возникающих в течение жизни индивидуума в процессе деления клеток и репликации ДНК. Этот вопрос сейчас интенсивно исследуется. И вот первый результат. В геноме человека и животных найдены специальные, очень строгие гены — «сторожа». Подобно корректорам, работающим над книгой, они выискивают опечатки в тексте и исправляют их. Результат нарушения нормальной «охранной» работы этих генов в организме — быстрое старение. Уже составлен определенный список таких генов, охраняющих наш генетический аппарат от всевозможных повреждений, которые могут появиться в течение жизни. И этот список постоянно увеличивается. Ученые считают, что управление работой таких генов может способствовать продлению полноценной жизни человека. Один из примеров этого — гены, кодирующие ферменты по имени геликазы. Эти ферменты участвуют в нашем организме в таких процессах, как репликация ДНК и рекомбинации в ней. Стоит только некоторым из них ухудшить свою работу, как сразу же начинают появляться приметы старения. У человека известен синдром Вернера (молодые люди выглядят как старики), который в значительной мере связан с нарушением работы одного из генов, кодирующих геликазу.
В подтверждение тому, что повреждения ДНК ответственны за процессы, ведущие к неотвратимому старению, можно привести данные голландских ученых, которые недавно изучали мышей с дефектом одного из генов, участвующих в репарации (восстановлении) поврежденной цепи ДНК. Такие мыши характеризовались рядом различных черт раннего старения (хрупкостью костей, седой шерстью, стерильностью). Все эти явления оказались вызванными лишь мутациями в гене XPD, который у человека вызывает болезнь трихотиодистрофию (она проявляется в развитии хрупкости волос, замедленном росте и повышенной чувствительности к свету) и который ответственен в норме за регуляцию экспрессии генов, вовлеченных в репарацию ДНК. Мыши с дефектом в гене XPD развивались нормально, но старели слишком быстро при достижении взрослого состояния. Дополнительная мутация в этом же гене увеличивала чувствительность животных к свободным радикалам кислорода. Таким образом, эти исследования со всей очевидностью показали, что причиной нашего старения может быть последовательное накопление мутаций в геноме.
Недавно была показана вовлеченность гена, известного под именем р21, в происхождение многих болезней, традиционно ассоциируемых с преклонным возрастом. Оказалось, что белковый продукт данного гена способен влиять на активность работы около сотни других генов, многие из которых отвечают в организме за патологические изменения в кровеносных сосудах, суставах, нервных, эпителиальных и других тканях человека. В частности, мутации в гене p21 ускоряют развитие атеросклероза, способствуют злокачественному перерождению клеток. Вот вам и путь еще к одному элексиру молодости: управление активностью таких генов, как ген p21 или ген геликазы, вполне способно существенно увеличить среднюю продолжительность жизни человека, а главное — улучшить ее качество.
Еще одно направление поиска ученых связано с изучением присущего нашим клеткам естественного механизма самоликвидации. Еще 120 лет назад немецкий ученый Август Вейсман писал: «Недееспособные индивидуумы не только бесполезны для вида, но даже вредны, так как занимают место дееспособных. Я рассматриваю смерть не как первичную необходимость, а как нечто возникшее вторично. Я полагаю, что продолжительность жизни ограничена не потому, что неограниченность противоречит природе жизни, а потому, что неограниченная жизнь была бы роскошью, не дающей никаких преимуществ».
Сейчас генетики установили, что в организме действуют программы не только на жизнь, но и на смерть. Считается установленным запрограммированность клеток на смерть. В частности, описан так называемый «лимит Хейфлика», согласно которому клетка не может делиться более 50 раз. Считается, что клетка умирает не потому, что состарилась, а потому, что сама кончает счеты с жизнью, если возникает подозрение, что она может стать потенциально опасной или просто ненужной для окружающих тканей. И такое «самоубийство» клеток (этот процесс, как уже говорилось, назван красивым словом апоптоз) запрограммировано в нашем геноме.
Когда же и за счет чего апоптоз происходит? В норме он нужен человеку с самого начала его существования для нормального формирования человека из единичной клетки — зиготы. Без апоптоза мы с вами имели бы хвосты, жабры и перепонки между пальцами. Но в результате этого процесса все рудиментарные органы безболезненно «исчезают». Кроме того, во взрослом организме благодаря апоптозу ежедневно самоуничтожаются миллиарды старых клеток, а также клеток, зараженных вирусом. Ради своих соседей, ради всего организма, чтобы не нанести ему вред, зараженная клетка самоликвидируется. Апоптоз происходит и в нормальных клетках после определенного времени их жизни в организме. Клетка по сигналу из генома умирает, и новая клетка приходит ей на смену. Например, клетки крови, потрудившись определенное время на благо человека, отмирают, а на их место поступают новые «молодые» труженики. Самоубийство клетки происходит только тогда, когда она получает специальный приказ на самоуничтожение. А отдают этот приказ особые белки, которые начинают вырабатываться в нужном месте и в нужный момент. Вся эта сложная программа строго контролируется большим числом генов: одни стоят на страже полноценных клеток, другие дают команду на уничтожение исчерпавших свой срок или подвергшихся мутациям — все старое и отжившее организму только мешает. И вот наступил момент, когда многие гены-убийцы были разоблачены. За это открытие в 2002 году трем ученым (С. Бреннеру, Дж. Сулстону и Р. Хорвицу) была присуждена Нобелевская премия.
Новые данные породили идею, которую высказал российский академик В. Скулачев: возможно, и у целого организма, как у единичных клеток, существует генетически запрограммированный механизм самоуничтожения. Однако пока обо всем этом мы мало знаем. И, тем не менее, уже начата атака на гены-убийцы клеток в надежде вмешаться в процессы старения организма. Исходя из вышесказанного, можно заключить, что один из основных принципов клетки — лучше умереть, чем ошибиться. Это напоминает самурайский кодекс чести. Не зря, видимо, один из генов, участвующих в апоптозе, получил имя HARAKIRI (харакири).
Ведя разговор о генах и старении, нужно помнить, что в сложнейшей картине тысяч различных биохимических процессов, происходящих в клетках, каждый генный продукт может участвовать во множестве метаболических цепей. Да, изменение работы того или иного гена может действительно сказаться на продолжительности жизни человека, но при этом возможны и другие, порой непредсказуемые, последствия. Например, тот же ген р21, о котором речь шла выше, отвечает в нашем организме за то, чтобы у нас не образовывались опухоли. Заблокировав его, мы, может быть, сможем прожить на несколько десятков лет больше, но только если не умрем раньше от рака. Так что надо детально учитывать все моменты, связанные с каждым из генов, прежде чем начинать практическое вмешательство в нашу жизнь. В противном случае это будет напоминать анекдот об одном «ученом», который определял местонахождение органов слуха у таракана. Он последовательно отрывал ноги таракану и давал команду «бежать». Пока у таракана оставалась хотя бы пара ног, он пытался убежать от «ученого». Но когда у таракана ног не осталось и он, естественно, бежать не мог, «ученый» сделал вывод, что органы слуха у таракана находятся на ногах.
Все, о чем говорилось выше — пока лишь отдельные вехи на пути медицинской геномики к коррекции процессов старения. Ученые пока не претендуют на открытие источника вечной молодости, но имеют веские основания надеяться замедлить старение людей в ближайшем будущем. Сейчас очевидно, что старение, как и любая другая важная биологическая функция, обусловлено параллельным действием множества довольно сложных и пока еще плохо изученных молекулярных механизмов. Кроме того, не следует забывать, что старение нашего организма зависит не только лишь от генов. Существенную роль в определении продолжительности времени старения и наступления смерти играют многие внешние факторы, в первую очередь условия жизни, питание и образ жизни человека. Все эти факторы, так или иначе, влияют на работу различных наших генов. Несмотря на то, что многие из них оказывают вроде бы второстепенное влияние на продолжительность жизни, выяснение их природы может оказаться весьма полезным для того, чтобы научиться замедлять старение.
Мы, конечно, можем бегать по утрам и пить томатный сок, не пить, не курить, но нам все равно не удастся избежать неизбежного — смерти. Наука хоть и продвинулась далеко вперед, но все же не изобрела эликсира, подобного вину, которое выпили Мастер и Маргарита, чтобы перейти в бессмертие. Тем не менее, оптимисты считают, что если кому-то из нас посчастливится прожить еще лет тридцать-сорок, чтобы дождаться полного расцвета генной инженерии человека, то, после этого, возможно, наша жизнь продлится до 2050, 2080 или аж 2100 года. Но даже они понимают, что бессмертия достичь нельзя, также как нельзя достичь абсолютного нуля температуры, сконструировать вечный двигатель или превысить скорость света.
Следует отметить, что и без вмешательства молекулярной генетики мы постепенно превращаемся в планету с «сединою на висках». В докладе Комитета по народонаселению ООН, сделанном в 2002 году, говорится о том, что «человечество впервые в своей истории сталкивается с феноменом старения населения». Сегодня людей, уже отметивших свое столетие, на Земле около 150 тысяч. А тех, кому исполнилось 80 и больше, — 66 миллионов. По прогнозам, к 2050 году число пожилых людей в мире превысит число молодых людей. По данным ООН, в мире сегодня проживает 629 миллионов людей в возрасте свыше 60 лет. К 2050 году их станет в три раза больше: два миллиарда. В 1950 году люди старшего поколения составляли 8% населения земли. К 2000 году этот показатель увеличился до 10%. В 2050 году они будут составлять 21% населения планеты. Это самая быстрорастущая возрастная группа населения планеты.
А вообще-то задумаемся — нужно ли человеку бессмертие? Если хорошо поразмышлять, то можно и усомниться в этом. Недаром же мудрый царь Соломон отказался принять эликсир жизни, не желая жить дольше, чем близкие ему люди. А вот жить долго, причем желательно в бодром и дееспособном состоянии, действительно было бы весьма заманчивым. Лет, скажем, 150–200… Но будем помнить слова Жан-Жака Руссо: «Жить — это не значит дышать, это значит действовать. Не тот человек больше всего жил, который может насчитать больше лет, а тот, кто больше всего чувствовал жизнь». И еще высказывание Сенеки: «суть не в том, сколько лет живет человек, а как он живет». Мы ведь не просто хотим выживать, а полноценно жить.
ИНДИВИДУАЛЬНАЯ ПИЛЮЛЯ (фармакогеномика)
Некоторые лекарства опаснее самих болезней.
Сенека
Доктора — это те, кто прописывают лекарства, о которых мало знают, чтобы лечить болезни, о которых они знают еще меньше, у людей, о которых они не знают вообще ничего.
Вольтер
Когда на торжественном банкете встречаются друг с другом азиаты и европейцы, то легко заметить, что даже после первого бокала легкого вина у азиатов лица краснеют, тогда как у европейцев они практически не изменяются, может быть, только чуть-чуть розовеют. В чем же причина этого? Здесь в основе различий в реакции на алкоголь также лежит геном человека, вариабельность его и кодируемых им белков. Даже незначительные различия в геномах разных людей порой ведут к существенному изменению реакции организма на разнообразные внешние воздействия, в частности на чувствительность к алкоголю, различным компонентам пищи, а также к всевозможным лекарственным средствам.
Но все это стало понятно сравнительно недавно, хотя научная фармакология существует уже около ста лет. Считается, что началась она с синтеза теперь уже всем хорошо известного лекарственного препарата аспирина. Однако за весь прошедший век фармакологи дали практикующим врачам всего лишь около полутысячи веществ, используемых для изготовления лекарств. При этом впоследствии оказалось, что далеко не все из них обладают только лишь полезными для человека свойствами. Нередко выяснялось, что многие из лекарств могут иметь побочные эффекты, в том числе и обладать весьма токсическим действием. Понадобилось почти 80 лет, чтобы разобраться хотя бы с тем же аспирином. Оказалось, что он подавляет активность одной из разновидностей фермента циклооксигеназы, но одновременно стимулирует другую его разновидность. А вот последнее вместо лечебного эффекта приводит к кровотечениям в клетках слизистой желудка и, как следствие, к развитию гастрита. Дело зачастую в том, что большинство из существующих лекарств представляет собой чуждые для человека вещества, с которыми он практически не сталкивался ранее в природе.
Но все это только одна из проблем. Другая, не менее важная, заключается в том, что даже самые «испытанные» лекарства эффективны далеко не для всех больных. Практика показывает, что зачастую ожидаемый лечебный эффект проявляется менее чем у четверти из них. Вот почему, например, так много разных лекарств имеется в аптеках от кашля, от головной и сердечной боли. Одним помогает одно, другим — другое.
Отчасти все это связано с тем, что вплоть до настоящего времени лекарственные препараты разрабатывались и назначались к применению, пройдя чисто «популяционный» контроль, без учета возможных индивидуальных особенностей реакции организма. А между тем уже довольно давно известно, что от 10 до 40% людей не реагируют на ту или иную фармакотерапию. В чем же тут дело? Уже много лет назад было установлено, что индивидуальная вариабельность реакции организма на действие лекарственных средств может быть обусловлена генетическими факторами. Тогда же и было сформулировано понятие о фармакогенетике как о науке, изучающей влияние генетических факторов на особенности реакции организма в ответ на медикаментозное воздействие.
Успехи в области изучения генома человека создали научную базу и необходимые технологические предпосылки для дальнейшего прогресса фармакологии. И вот в результате секвенирования генома человека и совершенствования методов генетического анализа, которое произошло в ходе выполнения проекта «Геном человека», окончательно сформировалось целое новое направление — фармакогеномика. Сам термин возник в 1997 году еще в ходе полного секвенирования генома человека. Эта новая быстро развивающаяся наука представляет собой «сплав» фармакогенетики и современных геномных технологий.
Фармакогеномика сфокусировала свое внимание на поиске новых средств лечения с учетом знания о структуре генома человека и на базе изучения генетических основ вариабельности ответа пациентов на лекарства, определяемой различиями в наследственной природе разных людей. Фармакогеномика изучает, как те или иные особенности строения нашей ДНК могут ослабить или усилить воздействие лекарств, разрабатывает тесты на выбор наиболее оптимального сочетания медицинских препаратов для лечения каждого конкретного человека. Таким образом, фармакогеномику можно рассматривать как одно из первых реальных практических приложений результатов, достигнутых участниками международного проекта «Геном человека».
Сейчас поиск новых лекарств в значительной мере отличается от того, что было вчера, а завтра, благодаря фармакогеномике, он должен стать еще более эффективным и точным (рис. 36).
Началось все с «трудов» средневековых алхимиков, когда они пытались найти и создать элексир вечной молодости. Поиск шел в природе, в ее естественных продуктах. Один из подходов, применяемых в недалеком прошлом и не потерявших свою актуальность даже сейчас, — использование в качестве лекарственных средств тех естественных продуктов человеческих клеток, которые способны сами защищать организм от всевозможных патологий. Таких «защитников» довольно много в нашем организме, но не всегда их хватает для борьбы с патологическими процессам. Можно использовать не сами белки-защитники, а некие их усовершенствованные формы. Примером этому может служить путь, по которому шли российские ученые во главе с членом-корреспондентом РАН Н. Ф. Мясоедовым при создании уникального медицинского препарата «Семакс». По своим свойствам — это нейропептид. Обычно нейропептиды вырабатываются клетками нервной ткани и представляют собой, как правило, короткие аминокислотные последовательности, которые обладают высокой эффективностью и выраженной направленностью действия даже при условии их очень малой концентрации. «Семакс» был создан в результате анализа действия различных производных адренокортикотропного гормона на такие фундаментальные функции мозга, как обучение и память. Выяснилось, что пептид, состоящий всего из четырех аминокислот, входящих в состав этого естественного гормона человека, вмешиваясь в нарушенное управление больной клетки, способен восстанавливать ее нормальное состояние. Далее на один из концов этого пептида были искусственно добавлены три специфические аминокислоты, которые защищают его от быстрого разрушения в организме. И в результате появился медицинский препарат нового поколения, который сейчас все шире и шире используется в медицинской практике при лечении травм головного мозга, инсульта и расстройств памяти.
Еще недавно большим достижением считалось «плясать» от конкретного гена. И действительно, это стало весьма важным этапом на пути создания эффективных лекарственных средств.
Рис. 36. Схема, иллюстрирующая в общем виде эволюцию основных путей создания лекарственных средств
Но теперь основные эффективные пути поиска новых лекарственных средств уже базируются на знаниях о полной структуре генома человека, с переходом на знания о структуре всех белков человека (его протеома). Секвенированный геном человека стал «путеводной книгой» для фармацевтических компаний. Появилась, как иногда говорят, «единственная в жизни» возможность идентифицировать все человеческие гены-мишени. Это одна из основных причин, почему вокруг нее ведутся жаркие баталии между двумя основными исполнителями проекта «Геном человека». За все времена до секвенирования генома человека было определено лишь около 500 молекулярных мишений, на которые направлено действие лекарственных веществ. Теперь, благодаря успехам в геномике человека, ожидается десятикратное увеличение таких мишений (по разным оценкам, общее их число у человека может составлять от 5000 до 10000).
Фармакогеномика осуществляет поиск новых мишений на базе двух китов — секвенированной нуклеотидной последовательности ДНК человека и компьютера. Подробнее мы поговорим об этом в главе по биоинформатике. Здесь отметим лишь несколько подходов.
Среди новых генов, обнаруженных в ходе полного секвенирования генома, сейчас осуществляют активный поиск тех, которые имеют структурное сходство с ранее выявленными генами- и белками-мишенями. Например, известной мишенью для лекарств являются белки, обладающие свойствами протеаз, — ферментов, расщепляющих другие белки. Сейчас уже предсказано существование у человека около 1000 белков с такими свойствами (вот и 1000 новых потенциальных мишеней!).
Другой подход — анализ все тех же уже многократно упоминавшихся снипсов. Изучение вариаций в геноме позволяет осуществлять направленный поиск генов, ответственных за определенные заболевания человека, которые ранее не рассматривались как гены-мишени.
С помощью компьютеров осуществляют также отбор среди имеющихся в распоряжении человека миллионов различных химических соединений тех, которые способны специфически взаимодействовать с определенными белками-мишенями, определяющими развитие того или иного заболевания.
Важнейшее направление в фармакогеномике — перевод медицины на рельсы персонифицированного лечения. К настоящему времени уже накопилось большое количество информации о генах, которые влияют на процессы всасывания, распределения, метаболизма и выведения лекарственных средств. В связи с полиморфизмом таких генов у некоторых пациентов лекарственные препараты могут быть неэффективными или даже оказывать токсическое воздействие. Известно, например, что в норме у различных групп исследуемых людей скорость удаления (элиминации) лекарства из организма может отличаться от 4 до 100 раз. Одним из комплексов генов, определяющих метаболизм лекарственных препаратов, являются гены системы цитохрома Р450. Скорость метаболизма лекарств у людей с разными изменениями этих генов отличается в сотни раз. Это указывает на то, что у отдельных индивидуумов возможно развитие побочных реакций в ответ на прием лекарственных препаратов даже в обычных (официально рекомендованных) дозах.
По данным Американской медицинской ассоциации, в США в 1994 году развитие побочных реакций явилось причиной госпитализации 2 млн. человек. В настоящее время почти семи миллионам американцев в возрасте 65 лет и старше прописываются лекарства, которые им не совсем подходят. Хуже того, по мнению экспертов, около одного миллиона проглоченных ими таблеток им вообще не следовало бы принимать. В последние годы побочные реакции на прием лекарственных препаратов постоянно занимают 4-е — 6-е место среди причин смерти в США. По некоторым оценкам, из-за неблагоприятных реакций на сильнодействующие лекарственные средства ежегодно в мире умирают до 100 тыс. человек.
Важное значение для решения этих проблем имеет изучение особенности структуры не только генов, детерминирующих метаболизм лекарственных средств, но и ряда других, на первый взгляд, совершенно незначительных различий, которые имеются в геномах разных индивидуумов. В частности, восприимчивость и реакция человека на те или иные лекарства в ряде случаев тесно связана с уже упоминавшимися снипсами. Так же, как эти «незначительные» вариации в геноме определяют разницу в подверженности людей к определенным видам заболевании, с ними зачастую ассоциированы и различия в результатах, наступающих у конкретного человека после принятия определенного лекарства. Приведем один пример. Астматики часто используют лекарство албутерол, который взаимодействует с рецептором адреналина и подавляет приступ удушья. Однако из-за разнообразия гаплотипов людей лекарство действует не на всех, а некоторым больным оно вообще противопоказано. Выяснилось, что это связано со снипсами в одном из генов: люди с последовательностью букв ТЦТЦЦ не реагируют на албутерол, если же концевой цитозин заменен на гуанин (ТЦТЦГ), то реакция есть, но частичная. Для людей же с тимином вместо концевого цитозина в этом участке — ТЦТЦТ — лекарство токсично!
Теперь фармацевтические компании планируют использовать все эти данные для производства определенных лекарств, предназначенных различным группам пациентов. В конечном итоге это поможет устранить побочные реакции от лекарств, точнее понять механизм их действия, а в результате снизить миллионные затраты. В частности, генотипирование лекарственной устойчивости сможет привести к более эффективной и безопасной химиотерапии у каждого конкретного пациента, больного раком. На практике лечение рака обычно носит эмпирический характер и основано скорее на клинических данных, чем на понимании механизмов чувствительности к химическим агентам. Например, для лечения раковых больных сейчас широко используется препарат цисплатин. Но он далеко не всегда оказывается эффективным. Проведенные исследования выяснили, что формирование резистентности к этому препарату обеспечивают два гена нашего организма — MGMT и MLH1. Продукты этих генов в норме препятствуют развитию опухоли. У конкретного индивидуума данные гены могут не работать по ряду причин, например, в результате химической модификации, получившей название метилирование. Появление метильных групп в определенных участках этих генов приводит к их выключению (инактивации). Получая ДНК из сыворотки больных в ходе лечения, можно анализировать степень модификации вышеуказанных генов и таким образом определять целесообразность использования цисплатина для химиотерапии конкретных пациентов.
Другим примером использования фармакогеномики в клинике может служить изучение действия азотиоприна при лечении лейкемии и некоторых аутоиммунных заболеваний. Азотиоприн разрушается в клетках специальным ферментом. Если соответствующие гены работают плохо, то лекарство постепенно накапливается в организме и вызывает острые нарушения в костном мозге. Таким образом, из лекарства оно может превратиться в яд. В этих случаях рекомендуется или уменьшать его дозу, или использовать альтернативную терапию.
Наконец, такой показательный пример. Для лечения рака груди сейчас существует множество средств. Врач обычно на практике выбирает, порой чисто интуитивно, какое-то одно, а потом наблюдает за реакцией организма на их прием. Фармакогеномика обещает сделать выбор нужного препарата намного более быстрым и точным. Теперь известно, что около четверти пациенток с раком груди относится к уникальной генетической группе, обладающей так называемой «сверхвыраженностью Her2». Сделав несложный анализ для таких больных, врачи могут прописывать лекарство, специально разработанное для того, чтобы блокировать вредные белки, образующиеся в организме с этой генетической вариацией. Такой способ повышает выживаемость пациенток на 25 процентов.
По данным «Журнала американской медицинской ассоциации», почти семи миллионам пожилых американцев — примерно двадцати процентам живущих в стране людей в возрасте 65 лет и старше — прописываются лекарства, которые им не совсем подходят. Это еще один из аспектов фармакогеномики. Дело в том, что врачи подчас не учитывают возрастных изменений, происходящих в организме в процессе старения.
Не вызывает сомнения, что в результате обнаружения новых генов и последующего выяснения их точных функций будут созданы специальные тесты (например, в виде микрочипов) для определения персональных реакций организма на различные лекарственные препараты. Для разработки таких диагностических тестов в первую очередь необходимо обнаружить тот ген или тот «профиль» снипсов, который и позволяет предсказать реакцию организма на действие определенного лекарственного средства. Сравнение ДНКовых текстов пациентов с разной реакцией на одно и то же лекарство позволит также осуществлять поиск соответствующих генов без всякого знания об их участии в биохимических процессах.
Хотя разработанные в настоящее время тесты еще несовершенны, нет сомнения, что хорошие фармакогеномные тесты будут созданы в самые ближайшие годы. И тогда благодаря им появится возможность определить вероятность возникновения у конкретного человека побочных реакций, развивающихся в результате применения определенного лекарственного препарата или группы лекарственных средств. Для практического применения врачами таких тестов необходимо, чтобы они отвечали ряду требований: дешевизна, точность, простота в использовании.
Можно представить себе микрочипы недалекого будущего, на которые будут нанесены все известные гены, определяющие типы реакции на то или иное лекарственное средство. Это изменит полностью сам характер фармацевтической промышленности. Из изготовителей стандартной продукции и продавцов «универсальных» лекарств фирмы превратятся в поставщиков высококачественных медицинских услуг с выгодой как для себя, так и для экономики здравоохранения в целом. А конкретный пациент может оказаться в большем выигрыше за счет более точного назначения «индивидуальной пилюли» с улучшенными свойствами.
Нет сомнения, что фармакогеномика способна революционизировать процессы поиска генов и белков-мишений, а также создания лекарств и тестов на восприимчивость к ним, разработать схемы правильного применения различных медицинских средств. В широком смысле речь идет о создании на ее основе индивидуализированной (персонифицированной) медицины — медицины будущего. По словам доктора Сьюзен Хеллманн, руководящей медицинским отделом в биотехнической фирме Genentech, «это примерно то же, как если бы раньше мы работали топором, а сейчас собираемся заменить его на скальпель».
Согласно прогнозам американской консалтинговой компании «Front Line Strategic Management Consulting», к 2010 г. благадаря использованию фармакогеномики произойдет сокращение расходов на лечение больных в США приблизительно на 1 млрд. долларов. В результате применения тестов на снипсы для предварительного скрининга пациентов в отношении реакции организма на определенный лекарственный препарат более чем на 32% повысится эффективность медикаментозного лечения и на 25% сократится число побочных реакций.
КОМПЬЮТЕР ВМЕСТО ПРОБИРКИ (геноинформатика)
Конечно, обдумывай «что»,
но еще больше обдумывай «как».
И. Гёте
Одной из особенностей, характерных для многих современных наук, включая и генетику, заключается в активном использовании в ней передовых достижений информационных технологий. Секвенирование генома человека и развитие такого направления, как геномика, пришлось на то время, которое по праву называют информационным. И все это произошло не случайно.
Многие ученые отмечают, что никогда еще в биологии не было такого положения дел, как сейчас. Раньше у нас было мало фактов, но существовало огромное количество гипотез, что соответствовало известному закону Мэрфи. Но теперь, благодаря успехам в определении генома человека и ряда других организмов, генетика из относительно бедной фактами превратилась в чрезвычайно богатую информацией науку. Энциклопедия под названием «Геном человека», которую «восстановили» из небытия на рубеже двух тысячелетий, содержит такой гигантский объем информации, который просто невозможно переварить человеческому мозгу. Издавать ее в печатном виде не имеет никакого смысла — ведь никто не в состоянии ее прочесть и понять. И здесь на помощь человеку пришли компьютеры. На этой основе появилось новое направление в науке биоинформатике — компьютерная геномика, которая призвана с помощью математических методов понять и осмыслить всю ту информацию, которая содержится в Энциклопедии человека.
В течение многих лет изучение генов и их функций основывалось на экспериментах в системах in vivo (в живом) и in vitro (в пробирке). Лишь в 80-х годах на помощь экспериментаторам пришло мощное дополнение — компьютер. Появилось и свое латинское обозначение для этого подхода — in silico, то есть в компьютере. Компьютеры были сконструированы еще в 60-е годы, но тогда они были лишь вспомогательным средством для обработки и хранения ограниченного объема данных. Техника постепенно совершенствовалась, и с конца 80-х началось создание баз данных, в которых теперь хранится информация о миллионах последовательностей нуклеотидов в ДНК и РНК и об огромном числе последовательностей аминокислот в белках.
Однако вся эта огромная информация в значительной мере была бы бесполезной без ее упорядочения и систематизации, подобно тому, как без инвентаризации книг в гигантских книгохранилищах просто невозможно найти нужную нам книгу. Компьютерная геномика стала заниматься тем же, чем до того занимались классическая биохимия и молекулярная биология, но не с использованием пробирки, а с помощью специальной компьютерной техники. Этот подход иногда называют «сухой» биохимией.
Чем полезен компьютер для изучения генома человека?
Без компьютерных биоинформационных технологий (геноинформатики, или, в более широком смысле, — биоинформатики) развитие геномных исследований вообще едва ли было бы возможным. Даже трудно себе представить, как бы ученые смогли собрать, классифицировать и разобраться с тем огромным объемом информации, которая заключена в двухметровой молекуле ДНК.
Обратим внимание читателя лишь на некоторые основные информационные задачи, которые необходимо было решать при изучении генома человека, а некоторые из них еще предстоит решить. В первую очередь нужно отметить то обстоятельство, что работа с геномами высших организмов, и особенно с геномом человека, — это работа с огромными объемами информации. Один миллион п. н. ДНК эквивалентен примерно 1 мегабайту (1 млн. байтов). Следовательно, для хранения в компьютере только информации о последовательности генома человека требуется не менее 3 гигабайт. Одной из важнейших задач для реализации программы «Геном человека» была организация процесса создания окончательного «текста», состоящего из миллиарда слов, десятков тысяч предложений и огромного числа страниц, собранных в 24 тома. Этот процесс с самого начала работ по программе «Геном человека» был прекрасно организован. Данные по секвенированию, получаемые в разных лабораториях мира, предварительно преобразовывались из аналоговых сигналов в цифровые для того, чтобы их можно было обрабатывать на компьютере. В Центре биомедицинских исследований Массачусетского технологического института в США круглосуточно принимались вновь собранные данные, автоматически регистрировались и архивировались. Все они сразу же автоматически привязывались к определенным хромосомам человека. Далее, каждая вновь поступившая последовательность нуклеотидов пересылалась по Интернету в GenBank — общедоступную базу данных, обслуживаемую Национальным центром биотехнологической информации (www.ncbi.nlm.nih.gov), а уже оттуда поступала в другие общедоступные базы данных во всем мире. Организаторы программы старались предоставить доступ к этим данным как можно быстрее и как можно большему числу пользователей. Трудно себе даже представить, как без использования компьютеров можно было бы из сотен тысяч «текстов», которые читались в отдельности разными исследователями в разных лабораториях мира, собирать гигантскую единую «Энциклопедию человека». Этот процесс напоминал собой сбор без предварительного рисунка гигантского паззла, состоящего из сотен тысяч мелких фигур, сваленных в кучу.
Другая не менее сложная задача, решаемая геноинформатикой, — компьютерный анализ ДНКовых текстов, что чрезвычайно важно для их правильного «прочтения». Поиск генов в геноме человека затруднен тем, что в ДНК нет абсолютно четких «знаков препинания», которые бы указывали на начало и конец генов-предложений и других функционально значимых элементов. При этом методы классической генетики имеют ограниченное применение для человека — ведь человек, в отличие от мух или мышей, не может быть объектом генетических экспериментов. Основная трудность при идентификации генов состоит в определении их экзон-интронной структуры, т. е. определении кодирующих и некодирующих участков. И здесь на помощь приходила и приходит геноинформатика. На основе статистического анализа ученые научились с определенной долей вероятности устанавливать, к какому участку генома относится та или иная изучаемая нуклеотидная последовательность ДНК. Это схоже с ситуацией в газетном тексте. Вот наш глаз остановился на фразе «от Парижа до Находки ОМСА — лучшие колготки», и сразу становится понятным, что это реклама, а не текст статьи, так как подобное словосочетание в обычных публицистических статьях практически никогда не встречается. Примерно так же обстоит дело и с определенными сочетаниями нуклеотидов в ДНКовом тексте. Выявлены определенные сочетания нуклеотидов, которые указывают на принадлежность анализируемого фрагмента генетического текста к интрону или экзону, кодирующему белок.
В настоящее время разработан комплекс программ распознавания разных участков генома, которые позволяют с определенной вероятностью вычленять такие функциональные участки в длинных последовательностях ДНК. Уже не вызывает сомнения, что многое из того, что раньше делалось только с помощью специальных сложных методов, сейчас можно осуществить с помощью вычислений. В частности, любую секвенированную нуклеотидную последовательность ДНК можно попытаться разметить и найти в ней границы как самого гена, так и его регуляторных последовательностей, не прибегая к помощи клонирования определенных последовательностей ДНК, их секвенирования и анализа экспрессии генов, а всего лишь с использованием специальных компьютерных программ. Компьютерные анализы уже привели к расшифровке многих «предложений» ДНКового текста. Такого рода работы, проводимые в нашей стране, зачастую не только не отстают, но даже значительно опережают аналогичные исследования в других странах. Предсказание белок-кодирующих генов с помощью компьютерных алгоритмов (этот метод назван ab initio) хорошо получается в случае относительно небольших геномов. Однако применительно к геному человека этот подход не всегда срабатывает в полной мере, т. к. гены человека часто устроены из маленьких экзонов и огромных интронов. Не отработаны также точные критерии для поиска не кодирующих белок генов. В этом заключается причина, почему до сих пор мы не можем назвать точное число генов в геноме человека, хотя он весь секвенирован.
Третья, не менее важная задача геноинформатики, касающаяся генома человека, — создание книги под названием «Функционирующий геном». Информация о геноме человека, накопленная сейчас в базах данных, касается в основном одного аспекта организации геномной ДНК, а именно ее первичной структуры, то есть последовательности нуклеотидов. Но для описания функциональных особенностей геномов, например особенностей регуляции экспрессии содержащихся в них генов, структуры и функции кодируемых ими белков и др. потребуются неимоверно большие объемы информации. Например, оценено, что для описания пространственной структуры лишь одного белка среднего размера (около 600 аминокислот) требуется около 200 страниц текста. А число белков уже сейчас оценивается не менее, чем в 500 000 (по некоторым расчетам оно достигает 1 млн.). Ясно поэтому, что сведения о расшифрованных белках будут храниться в компьютерных библиотеках сверхгигантского размера.
Обычно, чтобы экспериментально установить функцию того или иного вновь обнаруженного гена или белка, требуются значительные усилия экспериментаторов и весьма большие финансовые затраты. Использование компьютеров позволяет решать многие вопросы без проведения специальных дорогостоящих и занимающих много времени экспериментов. Ярким примером может служить обнаружение гена, мутация в котором обуславливает преждевременное старение, происходящее при синдроме Вернера (напомним, что пациенты с этим заболеванием уже в молодые годы выглядят как дряхлые старики). С помощью Интернета и других современных средства информатизации всего за восемь месяцев удалось «вычислить» соответствующий ген. Для его обнаружения исследователям пришлось перебрать в базах данных свыше миллиона пар нуклеотидов. Очевидно, что без помощи геноинформатики этого события пришлось бы ждать еще несколько лет.
Другой пример — создание каталога всех имеющихся в геноме человека ферментов, называемых протеинкиназами («кином»). В результате этого поиска было выявлено 518 генов, кодирующих протеинкиназы, и, кроме того, 106 псевдогенов. При этом 70 из обнаруженных генов ранее были совсем неизвестны. Выяснилось также, что почти половина генов «кинома» располагается в участках генома, связанных с различными заболеваниями человека.
Дешифровка последовательности белка с помощью компьютера напоминает работу криптографов — из последовательности отдельных букв читается весь биологический текст, и на основании этого выясняется, что это за белок, какова его функция в организме. Впечатляющие результаты были получены, например, австрийцем Айзенбергом. Используя дешифровальные методы анализа нескольких тысяч белков, не проведя при этом ни одного эксперимента, он сразу предсказал функции почти половины из них. Вспомним, что еще не так давно ученые иногда тратили всю жизнь, чтобы определить структуру одного белка и познать его функцию. С помощью новых подходов можно одновременно предсказать функцию большого числа белков.
Для написания книги «Функционирующий геном» потребуется объединить вместе огромную информацию о картине работы десятков тысяч генов в различных типах клеток на разных стадиях развития и в разных физиологических состояниях, данные о структуре и функции отдельных белков, кинетические параметры, концентрации молекул, сведения о взаимодействии генов и генных продуктов, реакции генома на экстремальные стимулы и различного рода патологические процессы. Связь между генотипом и фенотипом, то есть между генами и их проявлением в совокупности признаков и свойств организма, зачастую обусловлена сложным взаимодействием множества различных генов, а также факторов окружающей среды. По этой причине во многих случаях ее экспериментально пока не удается однозначно установить. Слишком сложна задача и слишком много исходных данных. Такую ситуацию часто называют проблемой нелинейного картирования. Чтобы решить эту проблему, био- и гено-информатике понадобятся новые значительно более совершенные программы, еще более мощные компьютеры. В частности, для этой цели в настоящее время предложено использовать так называемое генетическое программирование. Гены в генетическом программировании рассматривают как аналоги компьютерных программ. Из огромного объема имеющейся информации, связанной с тем или иным фенотипом, строят многочисленные метаболические «деревья», соответствующие разным известным молекулярным взаимодействиям внутри клетки. Затем для поиска наилучшей модели, описывающей определенный фенотип, с «деревьями» осуществляют на компьютере различные операции, подобные мутациям и рекомбинациям в геноме. Следующий этап — отбор тех из них, которые в наибольшей мере соответствуют реальным данным. В конечном итоге все это позволяет осуществлять прогностическое нелинейное картирование, то есть указать на взаимосвязь между работой определенного набора генов и конкретного фенотипа. А далее уже наступает очередь экспериментаторов, которые должны подтвердить или опровергнуть данные, полученные с помощью генетического программирования. Таким образом, генетическое программирование служит для исследователей некой путеводной звездой. Несмотря на сложность задачи, ожидается, что она будет решена не более чем через несколько десятков лет.
Однако нельзя переоценивать возможности современной биоинформатики, она еще далеко не все может решить. Тем не менее, она выступает в качестве мощного инструмента для первоначальной переработки огромной по объему информации, содержащейся в ДНК. Биоинформатика дает для исследователей ценные данные и делает их поиск целенаправленным. Такой поиск может быть продолжен в дальнейшем с использованием других подходов, в частности, экспериментов на культурах клеток или даже на целых животных. Например, как уже говорилось выше, функции тех или других генов человека можно эффективно изучать на модели трансгенных животных.
Кроме перечисленных выше, биоинформатика решает и множество других не менее важных и сложных задач. Таковым являются разработка методов анализа экспериментальной информации; компьютерное моделирование структурно-функциональной организации (вторичной, третичной структуры) генетических макромолекул (ДНК, РНК и белков), молекулярно-генетических процессов (репликации, транскрипции, сплайсинга, трансляции) и молекулярных взаимодействий между генетическими макромолекулами в генных сетях; исследование закономерностей молекулярной эволюции генетических макромолекул, а также молекулярно-генетических систем. Так, используемый в науке геногеографии картографический подход (о нем мы еще поговорим ниже), позволяющий исследовать пространственное распространение по нашей плавнете различных генетических признаков человека, долгие годы был чрезвычайно трудоемким и отнимал у ученых очень много времени. Использование компьютерных технологий принципиально изменило ситуацию, позволило существенно облегчить эти рутинные процедуры, давая исследователю возможность сосредоточиться непосредственно на вопросах творческого анализа географической изменчивости популяционно-генетических характеристик.
Сравнительный анализ геномов с помощью компьютеров стал одним из наиболее распространенных и эффективных методов изучения их структурно-функциональной организации и эволюции. Об этом уже шла речь выше, когда рассказывалось о функциональной геномике, коснемся мы его и в следующих разделах. Наиболее важные участки генома относительно мало изменяются в процессе эволюции, и их функции, установленные в экспериментах на мышах или мухах, зачастую оказываются такими же и у человека. Экспериментальный поиск генов, которые сходны у человека и животных, занимает недели и месяцы работы целой лаборатории. С помощью созданных геноинформатикой эффективных алгоритмов поиска компьютеры позволяют сделать это за считанные минуты. При наличии сходства последовательностей ДНК геноинформатика, с определенной степенью точности, может предсказать эволюцию геномов, функцию отдельных генов и др.
Биоинформатика способна также предсказать пространственную структуру белка на основании данных по последовательности нуклеотидов в ДНК. Это чрезвычайно важное обстоятельство, так как число известных первичных белковых структур (последовательностей аминокислот), установленных по известным нуклеотидным последовательностям ДНК, намного превосходит число экспериментально подтвержденных пространственных белковых структур. И в этом направлении также разработано большое число подходов. Один из наиболее эффективных — использование информации о пространственной структуре белков, имеющих сходную первичную структуру.
И, наконец, принципиально изменилось взаимодействие между учеными разных стран. С помощью компьютера исследователи из многочисленных научных лабораторий мира осуществляют обмен идеями, результаты их работ быстро появляются в Интернете, там же ученые ищут интересующие их сведения, публикуемые коллегами. Всемирная паутина позволяет специалистам не только обмениваться сообщениями, но и за считанные минуты просматривать специализированные базы данных международных центров, в то время как в обычной библиотеке без специальных программ на это ушли бы дни и месяцы. Уж не говоря о том, что на такие полные библиотеки пришлось бы в каждом научном учреждении тратить гигантские средства. В России, под руководством профессора А. А. Александрова, создана большая и весьма полезная база знаний, в которой любой желающий, имеющий доступ к Интернету, может найти сведения обо всех аспектах, связанных с биологией человека (сайт http://obi.img.ras.ru).
В значительной мере потенциал био- и геноинформатики определяется техническими возможностями. Недавно появилось сообщение, что корпорация IBM продала свой самый мощный в мире коммерческий компьютер компании NuTec Sciences, которая будет использовать его в исследованиях генома человека. Производительность этого компьютера составляет 7,5 трлн. операций в секунду. Он построен на базе 5000 процессоров. И это один из важных путей совершенствования геноинформатики.
Если заглянуть в материал, хранящийся в наиболее полном архиве PubMed, то на конец 2002 года там можно найти свыше 10,5 тыс. научных публикаций, в которых упоминаются слова «геном человека». Сейчас очень трудно уследить за всей информацией, которая появляется ежедневно по данной проблеме. В этой связи одним из перспективных путей развития биологии и генетики в XXI веке сейчас считается создание полной компьютерной модели клетки. Только сверхмощные компьютеры способны обеспечить хранение, систематизацию и переработку той огромной фактической информации, которая накопилась учеными за последнее столетие. Такие клеточные модели теоретически способны не только анализировать существующие базы данных, но и предсказывать ученым пути поиска недостающих звеньев. И здесь для биоинформатики еще предстоит работа на многие десятилетия.
Геноинформатика — быстрый путь от гена к лекарству
Один из впечатляющих результатов био- и геноинформатики — создание методов и подходов для выявления новых узконаправленных лекарств на основании анализа генов и пространственных структур кодируемых ими белков. Поиском лекарств нового поколения сейчас активно заняты многочисленные фирмы. Приемы и методы современной биоинформатики позволяют с помощью компьютерного моделирования очень быстро проводить проверку огромного числа химических соединений (в распоряжении исследователей сейчас имеется свыше 2 миллионов таких соединений) с целью выбора тех из них, которые специфически действуют на различные белки-мишени, участвующие в развитии определенных патологий у человека. Такой анализ осуществляют с помощью специальных компьютерных программ на базе известных пространственных структур белков. Этот подход получил специальное название «дизайн лекарств» (англ. drug-design). Сначала идут от гена через мРНК к белку, а затем к его сложной пространственной структуре. Далее путем компьютерного анализа оценивается возможность целенаправленного взаимодействия белков-мишеней с различными химическими компонентами и среди последних отбирают такие, которые теоретически должны влиять тем или другим образом на мишени. На заключительном этапе все-таки требуется помощь экспериментаторов: в специальных опытах из небольшого уже числа отобранных теоретиками соединений вычленяют окончательно такие, которые оказывают ожидаемое биохимическое и физиологическое действие в живых системах.
Не вызывает сомнения, что в ближайшее время вместо всего нескольких сотен белков-мишеней, на которые направлено действие лекарств сегодня, биоинформатика на базе расшифрованного генома человека даст медицине десятки тысяч новых мишеней. А затем будут подобраны новые направленные на них лекарственные средства.
Немного фактов на грани с фантастикой
Компьютеры на основе ДНК
Молекула ДНК привлекла к себе внимание с разных, порой совершенно неожиданных сторон. Так, когда выяснилось, что в молекуле ДНК может храниться намного больше информации, чем в любом из микрочипов, заметный интерес вызвала возможность использования ДНК для обработки информации и решения математических задач.
Сама идея использовать ДНК для создания биокомпьютера возникла из сходства между процессами, происходящими в природе при синтезе ДНК, и работой вычислительных машин. Первые работы по созданию ДНК-компьютеров начались около 10 лет назад в Америке. Но сейчас уже в нескольких странах мира есть лаборатории, где пытаются «скрестить» компьютер с живыми организмами. Ученые, работающие над проблемой создания ДНК-компьютера, считают, что со временем он составит сильную конкуренцию теперешним компьютерам, благодаря своей сверхминиатюрности и сверхбыстродействию. Информационная емкость ДНК гораздо больше, чем у любых современных носителей: в кубическом сантиметре ДНК содержится больше информации, чем на триллионе CD-дисков. Вероятно, в будущем компьютер на основе ДНК может работать и внутри человеческих клеток. В результате этого он будет, например, отслеживать опасные для здоровья изменения в организме человека, рекомендовать набор лекарственных средств для лечения патологий и др. Все это пока еще далеко от реального воплощения. Тем не менее, уже появились сообщения о создании первых нанокомпьютеров, в которых роль программ, входных данных и результатов играют цепочки молекул ДНК, а роль символов — составляющие их буквы (А, Т, Г и Ц). Вместо обычного представления данных в виде нулей и единиц и использования математических формул для решения задач, вычисление с помощью ДНК использует данные, представленные в виде шаблонов молекул ДНК. Специфические ферменты (рестриктазы и лигазы) действуют как программные средства, обеспечивающие чтение, копирование и манипулирование кодом.
Поскольку каждый «символ» в ДНК занимает 0,35 нанометра, то плотность данных в цепочке составляет 18 мегабайт на дюйм, а если говорить о двумерном расположении ДНК, — то более миллиона гигабайт на квадратный дюйм. Для сравнения обычный винчестер содержит лишь около 7 гигабайтов на квадратый дюйм, то есть в 100 000 раз меньше.
Некоторыми учеными постулируется, что использование молекул ДНК станет будущим компьютерной техники и придет на смену полупроводниковым микросхемам. Однако исследования в этой области пока находятся в самом начале и их перспектива до конца не ясна. По мнению журнала «Science», отметившего лучшие достижения в мировой науке за 2001 год, возможности молекулярных компьютеров станут реальностью именно с появлением нанопроводов, в тысячи раз более тонких, чем проводники, используемые в современных микросхемах.
Мелодии человеческого генома
Имеют место и весьма экзотические подходы к проблеме генома человека. Сообщалось, например, что японский ученый Нобуо Мунатака попытался записать ДНКовый текст генома человека с помощью музыкальных нот. Он решил воспеть геном человека, полагая, что музыка проще выражает формулу жизни, чем цифры и символы. Изобретатель так прокомментировал свою попытку: «Тайны человеческой ДНК действительно сложно понять простым людям. Сегодня медицина уже способна определить предрасположенность человека ко многим заболеваниям, например, раку или диабету. Почти всегда за это отвечают наши гены, теперь люди об этом знают. Что такое генетическая карта человека, мы постарались показать музыкой». Найденные в геноме основные группы генов человека Мунатака попытался переложить на ноты. И в результате, как он утверждает, получились многометровые партитуры. Они, по мнению автора, позволяют еще до рождения ребенка на стадии эмбриона определить его предрасположенность к тем или иным серьезным заболеваниям и даже предсказывать его умственные способности. Пока все это кажется фантастикой или шуткой. Но кто знает, может быть, и композиторы внесут свой вклад в разгадки тайн человеческого генома.
ВСЕ ПОЗНАЕТСЯ В СРАВНЕНИИ (сравнительная геномика)
Между двумя представителями рода человеческого сходства меньше, чем между двумя различными животными.
Мишель де Монтень
То, что ново в себе, будет понято только по аналогии со старым.
Ф. Бэкон
Как уже говорилось, сравнительный метод служит традиционным подходом в старых классических областях биологии (анатомия, эмбриология, цитология). Так, еще Дарвин свою точку зрения о происхождении человека обосновывал с помощью сравнительно-эволюционного метода, указывающего на многочисленное сходство в анатомии и физиологии человека и обезьян.
В последнее время сравнительный подход стал широко и весьма эффективно использоваться в молекулярной биологии и генетике. Мощный толчок этому был дан крупномасштабным секвенированием геномов. Появилось даже новое направление в геномике — сравнительная геномика — сопоставление отдельных генов, групп генов и целых локусов далеко эволюционно отстоящих организмов. Это принципиально важное направление исследований позволяет по-новому решать ряд ключевых вопросов. Рассмотрим некоторые из них.
В настоящее время человечество кроме своей собственной Энциклопедии располагает подобными Энциклопедиями некоторых простейших организмов: кишечной палочки, мухи дрозофилы, дрожжей и червя Caenoharbditis elegans, а также мыши — и отдельными главами из Энциклопедий некоторых других высокоорганизованных организмов (обезьяны, крысы). Сегодня параллельно с секвенированием генома человека идет расшифровка еще около 1000 геномов других животных и растений. ДНКовый текст во всех этих Энциклопедиях написан одними и теми же четырьмя буквами, число которых у бактерий составляет миллионы, у птиц — сотни миллионов и миллиарды у млекопитающих и человека. Поскольку все тексты написаны одинаково, их удается сравнивать между собой. При этом выяснилось, что, несмотря на огромные различия в размерах геномов, число генов (наиболее значимых предложений в текстах) у разных видов организмов не сильно отличается. В этой связи стали говорить даже о неком парадоксе, который получил специальное название G-парадокса (первая буква англ. слова gene — ген). Сейчас этот парадокс объясняют тем, что главное для организма все-таки не общее число генов, а то, как они устроены и как регулируются, какова сложность взаимодействия между продуктами разных генов. «У нас одинаковые гены с кошками и собаками, но они по-разному регулируются», — заявил по этому поводу Крег Вентер, один из главных героев секвенирования человеческого генома. Скорее всего, именно устройство и регуляция работы генов уникальны для человека, делая его «венцом природы». Короче говоря, если ген — это короткое предложение, то из сочетания одних и тех же слов и предложений можно написать как умнейший трактат, так и примитивные детские стишки. Кроме того, важно, как они будут читаться и звучать.
Какими бы уникальными мы не казались сами себе, в нашей ДНК есть довольно много сходства не только с обезьянами и мышами, но даже с маленьким червем C. elegans и мухой дрозофилой. Можно удивляться, но у нас около 50% генов сходны с таковыми у червя. У человека и мыши еще больше одинаковых генов, хотя в эволюции человек и мышь разошлись уже около 100 миллионов лет назад. В геноме человека на сегодняшний день обнаружено лишь около 300 генов, которых нет у мыши, а общее их число примерно одинаковое. Таким образом, около 99% генов человека соответствуют генам мыши, причем примерно 80% из них почти полностью идентичны. Кроме того, до 90% генов, ответственных за возникновение различных заболеваний, у человека и мыши сходны. Есть, разумеется, и небольшие различия. Так, у мыши гораздо больше генов, отвечающих за обоняние.
Что же касается наших ближайших родственников, то здесь различия еще меньше. Согласно последним данным, в целом геном человека отличается от генома шимпанзе всего лишь максимум на 5%! Удивительно, но некоторые группы генов (например, гены, ответственные за формирование тела организма) у человека сродни аналогичным группам у биологических видов, возникших еще пятьсот — шестьсот миллионов лет тому назад, во времена так называемого Кембрийского биологического взрыва. Сейчас с нетерпением ожидается тот момент, когда будет полностью секвенирован геном шимпанзе. После этого в сравнительно геномике должен начаться новый очень важный этап. В результате такого сравнения могут быть обнаружены функционально важные мутации, специфические для человека как вида, что в свою очередь откроет новые пути для медицины. Безусловно, эти данные будут также способствовать более полному пониманию процесса эволюции человека.
Сравнения последовательностей ДНК человека с ДНК других организмов уже оказалось очень плодотворным методом поиска новых функционально важных последовательностей в геноме человека. Такой подход был использован и продолжает использоваться для выявления у человека новых белок-кодирующих и не кодирующих белок генов, а также для идентификации потенциальных регуляторных элементов и выяснения механизмов функционировании разных генных наборов. Для этой цели сейчас уже созданы специальные компьютерные программы, позволяющие «вылавливать» в разных геномах эволюционно консервативные области. Все это принципиально важно, поскольку, как уже подчеркивалось выше, мы не можем ставить генетические эксперименты на человеке, но, благодаря сравнительному методу, имеем возможность интерполировать на человека результаты, которые получаются при молекулярно-генетических исследованиях, проводимых на животных.
Так, в силу подобия геномов даже муха дрозофила может быть использована для более полного понимания функций тех или иных человеческих генов, в частности, ответственных за некоторые заболеваний человека. Примером тому может служить изучение гена dFMR–1 мухи, который имеет гомологию с соответствующим геном человека, определяющим синдром ломкости X-хромосомы — тяжелое наследственное нейродегенеративное заболевание. Это исследование позволило заключить, что причина синдрома скорее всего связана с нарушением механизма РНК-интерференции, о котором мы уже говорили выше. И это серьезная «подсказка» для ученых, решающих проблему синдрома ломкости X-хромосомы у людей.
Важно отметить, что когда мы изучаем геном человека, то фактически мы познаем весь живой мир. Геном человека устроен необычайно сложно. Геномы животных и растений чаще всего значительно проще. Поэтому, когда мы узнаем устройство сложного генома, нам будет очень легко от него перейти к изучению простого. А это сулит революцию в таких областях, как ветеринария, селекция растений и животных.
Сравнительная геномика дала ученым новый подход к пониманию вроде бы навсегда скрытого во мраке веков процесса эволюции и его механизмов. Так, например, проведенные сравнения геномов разных видов животных и человека показали наличие определенных тенденций в эволюции. Одна из них заключается в увеличении количества интронов в процессе эволюционного развития у человека, то есть эволюция как бы сопряжена с «разбиением» генома на отдельные функционально значимые фрагменты: на единицу длины ДНК приходится все меньше информации о структуре белков и РНК (экзоны) и возникает все больше участков, не имеющих пока ясного функционального значения (интроны). Проведенные исследования позволяют считают, что природа совершенствовала млекопитающих не столько посредством умножения разнообразия их генов, сколько путем постепенного копирования, модификации и комбинации уже существующих генов, а также путем изменения регуляции экспрессии генов. Специфика и разнообразие строения и функционирования генетического аппарата велики даже среди эукариот. В то же время существует множество общих принципов и механизмов, и результаты их изучения на одних объектах часто с успехом могут переноситься на другие, включая и человека.
Весьма интересные результаты были получены, в частности, при сравнении распределения по хромосомам сходных последовательностей ДНК человека и других животных. Приведем лишь один пример. Как уже указывалось, между геномами человека и мыши имеется большое сходство. На рис. 37 на цветной вклейке изображено расположение в разных хромосомах мыши сходных сегментов отдельных хромосом человека. Глядя на этот рисунок, мы можем увидеть, что участки одних и тех же хромосом человека распределены во множестве хромосом мыши. Это справедливо и наоборот. А что это значит? Это говорит нам о тех путях, по которым шла эволюция млекопитающих (ведь мышь и человек млекопитающие). Тщательно проанализировав картину, изображенную на рис. 37, ученые установили, что на границах разных участков ДНК мыши, которые обнаруживаются в составе ДНК человека, содержатся различные подвижные генетические элементы, тандемные повторы и другие «горячие точки», по которым, вероятно, и шла перестройка (рекомбинация) в ходе многовекового процесса эволюции животных организмов.

Рис. 37. Генетическое сходство (гомология) хромосом человека и мыши. Разными цветами и номерами на хромосомах мыши отмечены нуклеотидные последовательности человеческих хромосом, содержащие сходные сегмент.
Сравнительная геномика показала, что гены, одинаковые по эволюционному происхождению и выполняемой функции (гомологичные), часто оказываются сцепленными с одними и теми же гомологичными генами у разных видов. На основании этого предсказывают вероятный район локализации генов у одних видов, если известно, с какими генами они сцеплены у других, т. е. проводят «сравнительное картирование». Все это важно в связи с тем, что правила чисел и относительное положение генов на хромосоме не всегда предопределяют законы их функционирования. Так, белковый состав многих специализированных клеток мыши, крысы и человека выглядит похожим, хотя сами гены разбросаны на хромосомах по-разному.
Итак, сравнительная геномика позволяет нам судить о механизмах и путях эволюции геномов и даже на новом уровне воссоздавать классификацию всего животного мира. Все это и есть предмет еще одного нового направления — эволюционной геномики. Ее венцом должно стать создание определенной четкой системы живых организмов, в некотором смысле подобной таблице Менделеева.
Благодаря использованию методов и подходов сравнительной и эволюционной геномики уже получены сенсационные результаты, касающиеся такого сложного и интересного вопроса, как происхождение человека и эволюция его генома. Подробнее об этом и пойдет речь в следующей части книги.
ЧАСТЬ III. ПРОИСХОЖДЕНИЕ И ЭВОЛЮЦИЯ ГЕНОМА ЧЕЛОВЕКА
КАК ПОЯВИЛСЯ ЧЕЛОВЕЧЕСКИЙ ГЕНОМ? (происхождение человека)
Ничто в биологии не имеет смысла, кроме как в свете эволюции.
Ф. Г. Добжанский
Если бы человека создал человек, он устыдился бы плодов своего труда.
Марк Твен
Наверное, каждому из нас в детстве (или немного позднее) приходил в голову вопрос о том, откуда он взялся. Далее ход мысли обычно таков: у меня есть мама и папа, у них тоже были родители — мои бабушки и дедушки. У дедушек и бабушек — прадедушки и прабабушки. И так далее, до бесконечности. Но бесконечность трудно воспринять и понять. А хотелось бы, чтобы начатое рассуждение имело какой-то логический конец. Ведь кто-то же должен быть первым в этом длинном ряду наших предков, с кого-то когда-то ведь начался род человеческий? Один ответ на этот вопрос дает Библия: род человеческий начался с Адама и Евы. Другой ответ был дан свыше сотни лет назад Чарльзом Робертом Дарвиным (1809–1882) в его эволюционной теории, согласно которой человечество произошло от неких обезьяноподобных организмов. Кого-то вполне удовлетворяет первый ответ, кого-то удивляет или шокирует второй. Но все это эмоции. А как на этот вопрос отвечает современная генетическая наука, базирующаяся теперь на обширных знаниях о структуре генома человека? Попытаемся в этом разобраться.
Если есть книга, то у нее должен быть и автор. Автор Энциклопедии под названием «Геном человека» носит женское имя «Эволюция». Эволюция — от лат. «развертывание» — историческое развитие природы. Она является демиургом всей ныне существующей живой природы, включая и человека. В ходе эволюции возникают новые виды организмов, а затем эти организмы адаптируются, т. е. приспосабливаются к среде обитания, к изменениям условий внешней среды. В результате эволюции постепенно повышается общий уровень организации живых существ: они усложняются и совершенствуются. По нашим человеческим понятиям творческая деятельность эволюции протекала и протекает очень медленно. Но все познается в сравнении. По космическим измерениям жизнь каждого из нас — это даже не миллисекунды. И если посчитать в таком масштабе, то автор довольно плодовит. И он может радоваться результату своего творчества — переиздание Энциклопедии человека происходит постоянно на протяжении многих сотен веков, причем гигантскими тиражами.
Дарвин оказался прав!
В 1739 шведский естествоиспытатель Карл Линней в своей Системе природы (Systema Naturale) впервые классифицировал человека — Homo sapiens, человек разумный — как одного из приматов. Лишь через 120 лет после этого появилась книга Чарльза Дарвина «Происхождение человека и половой отбор», в которой он обосновал вывод о том, что нашими прямыми предками являются высокоразвитые человекообразные обезьяны. Он писал: «существует чрезвычайно близкое сходство в общем строении тела, микроскопическом устройстве тканей, химическом составе и конституции между человеком и высшими животными, в особенности человекообразными обезьянами».
Психологически было сложно согласиться с такой родословной человека. Еще при жизни Дарвина одна возмущенная девушка спросила его, правда ли, что и она произошла от обезьяны. Ученому пришлось элегантно отшучиваться: «Конечно. Но… от очаровательной обезьяны». Споры и раздоры по этому вопросу продолжаются даже до сих пор. Хотя научная общественность в целом приняла положение Дарвина как истину, до сих пор, по данным некоторых опросов, четверо из десяти американцев считают маловероятным, что человек произошел от обезьяны. В России подобные опросы пока не производились.
На самом деле никто никогда и не утверждал, что мы произошли от обезьян, которых видим сегодня в зоопарке. Речь идет о неких обезьяноподобных (а можно сказать и о человекоподобных) организмах, положивших начало современным обезьянам и человеку. После Дарвина на основе ископаемых свидетельств большинство палеонтологов долгое время утверждали, что эволюционное разделение человека и крупных человекообразных обезьян произошло свыше 25 млн. лет назад, а люди современного типа сформировались из своих архаичных сородичей (гоминид) за последний миллион лет. Однако эти представления существенно изменились, когда за работу принялись молекулярные генетики.
Для исследования происхождения человека первоначально использовали сравнение последовательностей ДНК человека и обезьян. Пока, к сожалению, геномы обезьян еще расшифрованы далеко не полностью. Тем не менее, на основании имеющихся данных оценено, что в среднем сходство геномов и количество сходных генов у человека и человекообразных обезьян (шимпанзе) достигает 95–99%, у человека и гиббона — 76%, у человека и макаки-резус — 66%. В то же время ДНК шимпанзе и гориллы имеют между собой 97% сходства. Это говорит о том, что у человека сходство с шимпанзе больше, чем у шимпанзе и гориллы. Используя метод «молекулярных часов», ученым удалось доказать, что от гоминид, т. е. представителей родословной линии человека, человек и шимпанзе разошлись чуть более чем 5 млн. лет назад, в то время как горилла отошла от общей ветви более 7 млн. лет назад (рис. 38). По различиям между полностью известными нуклеотидными последовательностями митДНК людей и шимпанзе было вычислено время первого разделения групп предков ныне живущих людей, которое произошло 180–200 тыс. лет назад. Это дата наиболее древней мутации в митДНК, которую генетики смогли распознать.

Рис. 38. Филогенетическое древо человека и высших обезьян (цифрами указаны миллионы лет, прошедших после каждого ответвления)
Таким образом, современные исследования подтверждают обоснованность заключения Дарвина о нашем происхождении от древних человекоподобных обезьян (типа современных шимпанзе, но не самих шимпанзе) и позволяют довольно точно оценить время, когда это произошло.
Как же все-таки сформировался новый вид, получивший латинское название Homo sapiens? Ведь налицо разительный парадокс: по ДНК мы отличаемся от существующих шимпанзе не более, чем на 5%, а по анатомии, по склонности к разным заболеваниям и по образу жизни отличия огромны. В чем заключаются те различия между геномом человека и геномом наиболее близкой к нему по ряду параметров из ныне живущих обезьян — шимпанзе? Обо всем этом мы пока знаем немного, хотя в результате секвенирования генома и изучения функций генов человека уже кое-что начинает проясняться.
Наибольшее отличие между геномами человека и шимпанзе заключается в разном числе хромосом в диплоидном наборе (23 пары у человека и 24 пары у шимпанзе). Большинство пар хромосом кажутся сходными у этих двух организмов. Но вот хромосома 2 человека произошла скорее всего в результате слияния двух разных хромосом обезьяны.
Кроме того, человеческая хромосома 9 больше гомологичной хромосомы шимпанзе, а хромосома 12 у человека короче, чем у обезьян. Установлено также, что различие, существующее между геномами человека и шимпанзе, не одинаково для всех хромосом этих двух организмов: наибольшее между Y-хромосомами, а наименьшее между X-хромосомами. На хромосомах 1 и 18 человека имеются большие инверсии по сравнению с соответствующими хромосомами шимпанзе. Большое количество различий обусловлено специфическими мутациями ДНК в районах, богатых ГЦ-парами нуклеотидов. По базовому замещению различия между ДНК человека и шимпанзе составляет около 1,4%, однако по инсерциям и делециям разница достигает 4%. Интересно, что в целом полиморфизм генома в популяции шимпанзе существенно выше, чем в человеческой популяции.
Существует несколько гипотез, пытающихся объяснить феномен происхождения человека от обезьяноподобных предков. Одни исследователи считают, что расхождение в эволюции (дивергенция) двух ветвей — человека и шимпанзе — произошла за счет специфического изменения в регуляции генов. Другие склонны думать, что это есть результат мутаций, приводящих к потере функции некоторых генов, и в этом свете называют современного человека «дегенеративной обезьяной». Существует также мнение, что имеется особый «ген человека», т. е. ген, который миллионы лет назад претерпел некую судьбоносную мутацию, благодаря чему наделил человека речью; этот ген следует искать на половых хромосомах. Так, у всех млекопитающих вплоть до обезьян на женской половой X-хромосоме имеется одинаковый кусок ДНК размером примерно в 4 млн. п. н., но только у современного человека этот участок ДНК скопировался также на мужскую Y-хромосому. Однако все это лишь предположения. Окончательного ответа мы пока не имеем.
Хотя еще многое остается неясным, мы начинаем понимать, что в своей эволюции человек достигал новшеств не с помощью каких-то особых способов, а с использованием в основном тех же путей и стратегий, что и все другие организмы. Не зря ведь говорят, что наиболее простой и дешевый способ изобрести что-то новое — это взять уже имеющееся открытие или изобретение и подогнать их под новые задачи.
При формировании современного человека активно происходила существенная перестройка генома, осуществлялась новая комбинаторика предсуществующих генных экзонов, что в конечном итоге приводило к образованию коллекций новых генов из имевшихся «старых». В результате этого полный набор белков (протеом), кодируемых геномом человека, более сложен, чем у других организмов. Еще один путь, использованный человеком в ходе эволюции, — это создание не просто семейств родственных генов (о них мы говорили ранее), а неких суперсемейств, состоящих из сотен, а иногда и тысяч родственных генов. Такие суперсемейства составляют в геноме человека более 60% всех генных семейств. Это указывает на то, что огромную роль в эволюции человека сыграло умножение генов путем их удвоения (дупликации) и последующего частичного расхождения (дивергенции). Примерами таких семейств генов могут служить семейство генов иммуноглобулинов, семейство кератиновых генов и многие другие. И всему этому есть определенный смысл в связи с особенностями развития и существования человека. В конечном итоге, в геноме размножалось в основном то, что нужно человеку. А вот то, что не нужно, наоборот, сокращалось. Так, с удивлением было обнаружено, что некоторые семейства генов содержат меньше членов в геноме человека по сравнению с геномами другими млекопитающими. В частности, у человека в два раза меньше генов семейства рецепторов обоняния. Это связано, скорее всего, с тем, что обоняние весьма важно для других позвоночных, а существование человека в меньшей мере зависит от этого чувства. Для человека намного важнее зрение, а не нюх. Несмотря на небольшое среднее различие в геномах человека и шимпанзе, становится очевидным, что оно может быть весьма неодинаковым для разных типов генов, в частности, для тех, которые работают в печени, и тех, которые выражают свою активность в мозгу.
Существенные различия обнаружены также в том, что в геноме человека много вставленных в него чужеродных элементов — ретровирусов, а вот у обезьян их как раз очень мало. Выше уже говорилось о том, что ретровирусы обладают способностью изменять «святая святых» живой материи — генетический аппарат клетки-хозяина. ДНК, синтезированная на вирусной РНК, внедряется в геном клетки, поставляя туда как бы «лжепрограмму» (провирус), которая затем передается по наследству. В результате этого происходит гораздо более сильное изменение генома, чем это возможно при «нормальной» эволюционной изменчивости. Академик Е. Д. Свердлов предложил гипотезу, согласно которой превращение обезьяны в человека в значительной мере связано именно с ретровирусами, вмешавшимися на каком-то этапе истории в эволюционный процесс.
Таким образом, в процессе формирования человека как вида и его эволюции происходили заметные изменения в геноме, обусловленные различными мутациями в нем. Однако должны существовать определенные пределы или ограничения этой вариабельности. Понятно, что они не могут быть очень большими, в ином случае это уже несовместимо с жизнью. И действительно, как уже говорилось, у всех ныне живущих людей генетические тексты очень похожи. Два любых человека, кроме однояйцовых близнецов, различаются всего лишь одной буквой-нуклеотидом из 1000. За 200 000 лет, прошедших после возникновения человека как нового вида, различия между геномами разных людей едва достигли 0,1%. «Изменения, которые произошли в процессе эволюции с человеком, гораздо меньше, чем у других животных», — делает вывод Эрик Ландер из Массачусетского технологического института.
Пока это собственно и все. Несмотря на все новое знание, которое пришло к нам в геномную эру, еще остается много нерешенных вопросов, касающихся происхождения и эволюции человека. Однако теперь после расшифровки генома человека появилась надежда на наше скорое понимание по крайней мере некоторых из них.
Поиск родственников по останкам (палеогеномика)
Если в начале были человекоподобные обезьяны, то кто был после них? Сохранилось ли какие-нибудь достоверные исторические источники об этом?
Современные люди, при всей генетической близости друг к другу, весьма отличаются по своим физическим и умственным характеристикам. Человеческий рост колеблется от 120 см у пигмеев до 215 см у народа масаи; цвет кожи, благодаря различному содержанию меланина, — от черного до белого. Очень разнятся черты лица. Объем мозга варьирует от 800 до 2000 кубических сантиметров. С кем же сравнивать этот разноликий образ человека?
Единственное, чем ученые располагают, — это ископаемые останки. Классическая палеонтология — наука о животных и растениях прошлых геологических эпох — уже давно изучает ранние этапы эволюции жизни по ископаемым остаткам. Но обычно через много веков от организма остается лишь минерализованный скелет. Традиционные способы, используемые палеонтологией для из исследования, в конечном итоге дают весьма ограниченные результаты. Но вот за останки принялись молекулярные генетики. И в результате этого родилось целое новое направление в геномике — палеогеномика.
Мы уже говорили об останках царской семьи и о том, что из них удалось выделить митДНК, с помощью которой и идентифицировали убиенных. Но в данном случае речь шла об останках, возраст которых менее 100 лет. А что же должно произойти с митДНК в останках, пролежавших в земле тысячи и даже сотни тысяч лет? Как показывают современные теоретические расчеты и конкретные исследования, наиболее вероятное время «выживания» фрагментов митДНК составляет 30–100 тысяч лет. Фрагменты ядерной ДНК, вероятно, могут быть получены из таких останков, как зубы и кости, возраст которых достигает 10 тысяч лет. Значит, примерно на такой период вглубь веков мы и сможем погрузиться с помощью анализа ДНКовых текстов.
Первый успех пришел к ученым еще в 1985 г., когда было осуществлено клонирование и определение нуклеотидной последовательности ДНК, выделенной из древней египетской мумии. Чуть позднее была показана возможность анализа митДНК из очень древних образцов при исследовании мозга человека давностью 7000 лет. В дальнейшем изучали митДНК из отдельных давно вымерших видов животных: сумчатого волка, термита в янтаре, мамонта, пещерного медведя и др. В конечном итоге подошла очередь для анализа древних останков человека.
Долгое время считалось, что останки самого близкого родственника человека были обнаружены в 1856 г. в местечке Неандерталь (Германия), отсюда обнаруженный предок получил название неандерталец. Неандертальцы населяли Европу и Западную Азию в период от 300 тыс. до 28 тыс. лет назад. На основе морфологического сравнения неандертальцев с человеком современного типа было предложено три гипотезы: неандертальцы — прямые предки человека; они внесли некоторый генетический вклад в генофонд Homo sapiens; они представляли независимую ветвь, которую полностью вытеснил человек современного типа. Для решения вопроса о месте неандертальцев на эволюционном древе и его родстве с человеком было проведено изучение митДНК, выделенных из обнаруженных останков. Конечно же, ядерная ДНК у них за несколько десятков тысяч лет сильно испортилась, развалилась на миллионы коротких фрагментов. По этой причине проще было работать именно с митДНК, которая, как уже говорилось, исходно имеет маленький размер, и в каждой клетке содержится до 100 копий такой ДНК, а не две копии, как в случае ядерной ДНК. ДНК выделяли с огромными предосторожностями в условиях высочайшей стерильности — ученые работали в специальной одежде, напоминающей скафандры, для того чтобы предотвратить даже малейшее случайное загрязнение исследуемых образцов какой-нибудь посторонней ДНК из современных организмов. С помощью полимеразной цепной реакции (о ней мы уже говорили) «размножили» те кусочки ДНК, которые сохранились. Они оказались очень короткими (не более 20 нуклеотидов). Тем не менее по ним все-таки удалось «реставрировать» исходную последовательность нуклеотидов в митДНК неандертальца. А далее сравнили эту последовательность и последовательность митДНК современного человека. Различия оказались столь существенными, что это дало основание сделать вывод — неандертальцы составляли совершенно самостоятельный, хотя и родственный человеку вид. А раз это отдельные виды, то скрещивание их было невозможно — и, следовательно, в геноме человека скорее всего нет генов, полученных напрямую от неандертальцев.
Позднее в пещере Мезмайской на Северном Кавказе российские антропологи нашли кости еще одного неандертальца. Его останки были точно датированы радиоуглеродным методом — им 29 тыс. лет. Доступные для анализа нуклеотидной последовательности ДНК этого ископаемого на 3,5% отличались от более раннего «дюссельдорфца». Тем не менее, оба неандертальца принадлежали к одному генетическому древу, которое явно отличается от древа современного человека.
По различиям в нуклеотидных последовательностях митДНК было приблизительно оценено время расхождения ветвей неандертальца и современного человека. Оно составляет от 500 до 690 тыс. лет. Таким образом, сейчас считается твердо установленным, что неандертальцы — это не наши прародители, а просто тупиковая ветвь эволюции.
К сожалению, пока по найденным к настоящему времени останкам так и не удалось найти нашего далекого прямого предка. Согласно современным представлениям, мы начинаемся скорее всего с кроманьонцев, но остается загадкой, так ли это и кто был до них. Ответ на этот вопрос пока скрыт в глубине веков.
Итак, несмотря на значительные успехи в расшифровке генома человека и в генетическом анализе ископаемых останков, к сожалению, поиск наших предков по останкам пока не дал окончательного ответа. Возможно, эти останки еще предстоит найти.
Существенно более интересные результаты были получены палеогеномикой при анализе ДНК мумий. Это направление исследований часто называют «генетикой мумий». Приведем несколько примеров. Так, анализ ДНК останков людей из древних поселений в различных частях Америки свидетельствует о том, что заселение Америки происходило не тремя волнами миграций, как считалось ранее, а в результате одной большой миграции, которая и привела к появлению современного человека на этом континенте.
Другой пример. Учеными были проанализированы образцы ДНК из сотни мумий, найденных на севере Чили, возраст которых около 1000–1500 лет. Неожиданно в них был обнаружен специфический вариант вируса, вызывающего такое заболевание, как лейкоз. В результате проведенных исследований была показана однотипность вируса, содержащегося в чилийских мумиях и у современных японцев. Эти данные позволили авторам сделать вывод о том, что переселенцы из Азии, монголоиды, одновременно попали в Японию и в Южную Америку около 10 000 лет назад.
Результатами такого рода исследований ДНКовых текстов древних популяций могут стать принципиально новые данные о структуре, внутри- и межпопуляционных связях, этногенезе, миграциях популяций человека и об эволюции человека как вида. Однако пока «генетика мумий», как всякая новая наука, несмотря на свою высокую информативность, ставит больше вопросов, чем дает ответов.
После обезьян были «Адам» и «Ева»
Разгадка вопроса о происхождении человека в конечном итоге оказалась спрятанной в самом геноме человека. Не зря же некоторые ученые называют ДНК «величайшим археологическим ископаемым всех времен». Природой, как бы специально для молекулярных генетиков, в ДНК человека заложены два особых, можно сказать исторических, источника: один в ядерном геноме, другой в митохондриальном. Это может вызывать удивление у непосвященного читателя, но для генетиков ничего неожиданного в этом, в общем-то, не было.
Первый из этих ДНКовых текстов — митДНК. Как уже говорилось, митДНК наследуется только от матери, а митДНК отца в ходе формирования зародыша бесследно исчезает. Следовательно, митДНК позволяет исследовать эволюцию человека по материнской линии. Каждый из нас получил митохондрии от своей матери, она — от своей, а та — от своей и так далее. Выстраивается линия родства — генетическая генеалогия, позволяющая ученым заглянуть в весьма отдаленное прошлое. Кроме того, митДНК накапливает мутации, как ранее сказано, с постоянной скоростью. Это означает, что митДНК ведет себя, как «часы» (за это ее и назвали «митохондриальными часами»), по которым можно довольно строго отсчитывать время, отделяющее нас от предков.
Другой специфический текст содержится в ДНК мужской Y-хромосомы. С его помощью можно прослеживать отцовскую линию эволюции. Мужчина получает Y-хромосому от отца, через него от деда, от прадеда и т. д., и так по мужской линии практически бесконечно, вплоть до тех наших очень далеких предков. И здесь также работают специфические «часы», определяющие возраст Y-хромосомы.
А теперь, вкратце, расскажем о том, что удалось «раскрыть» с помощью этих двух особых ДНКовых текстов.
Как уже говорилось, первоначально генетиками были расшифрованы значительно более простые последовательности нуклеотидов в митДНК. Вскоре выяснилось, что мутации в митДНК накапливаются относительно быстро, но при этом с довольно постоянной скоростью. Поскольку многие из них не затрагивают непосредственно функции митохондрий, они фактически нейтральны и естественный отбор их не отсеивает. Следовательно, нуклеотидные последовательности митДНК — это быстро идущие «молекулярные часы» (напомним, что о принципе работы «молекулярных часов» мы уже говорили выше). Важно также, что митДНК не способна к рекомбинации. Таким образом, единожды возникшая в ней мутация может быть затем легко прослежена у всех ее потомков. В материнских линиях родства наибольшее сходство наблюдается между родными братьями и сестрами, поскольку мутации в их митДНК накапливались лишь в течение одного поколения. Затем степень родства снижается шаг за шагом от двоюродных родственников, происходящих от бабушки по материнской линии, до троюродных с общей прабабушкой по этой же линии и т. д. Чем дальше по генеалогическому древу, тем шире круг родственников с материнской стороны, и так вплоть до того, когда к нему будут принадлежать все современники.
Эти рассуждения и привели к представлению о том, что митДНК всех живших и живущих ныне людей происходит в конечном итоге от одной женщины-предка. Поскольку библейскую праматерь человеческого рода звали Ева, то женщину-предка предложили назвать — «генетическая Ева». Проследив с помощью анализа митДНК генетическую эволюцию рода человеческого по материнской линии, американец Уилсон определил, когда и где жила прародительница всего нынешнего населения Земли. «Митохондриальные часы» показали, что она жила приблизительно 200 тысяч лет назад, а место ее существования — северо-восточная Африка. (Позднее некоторые исследователи, соглашаясь с африканским происхождением «Евы», оценили ее возраст несколько иначе — в 150 тыс. лет). Автор открытия, которое явилось мировой сенсацией, стал «крестным отцом» нашей прародительницы, он то и назвал ее «митохондриальной Евой». Все современные люди, будь то англичане, китайцы, немцы, русские или индейцы, произошли именно от нее. Конечно, понятие «генетическая Ева» или «митохондриальная Ева» довольно условное, но для понимания эволюции человека весьма полезное. Скорее всего, «генетическая Ева» не представляла собой одну единственную женщину-прародительницу. В действительности их, по-видимому, было довольно много (возможно, несколько сотен). Но если у каких-то древних женщин не рождались девочки, то материнская линия родства на этом обрывалась. В то же время у других женщин рождалось много девочек, и эти линии продолжались. В популяции древних женщин между ними не было существенных отличий, но в результате цепи случайных событий до наших дней дожили потомки одной единственной «генетической Евы». Не следует считать, что митохондрии этой женщины имели какие-либо преимущества перед другими, все это стало скорее всего результатом простой игры случая, по котором при прочих равных шансах кто-то непременно в конце концов должен выиграть. По независимым оценкам нескольких групп генетиков, размер популяции, к которой принадлежала африканская «Ева», составлял в то время около 10–30 тыс. человек. Иногда говорят, что ей (той единственной, «Еве») повезло. Может быть да, может быть нет, но сама она об этом ни тогда, ни теперь ничего нам сказать не может.
Если была Ева, то должен быть и Адам, который по библейскому сказанию был первым человеком и отцом рода человеческого. В вопросе о «генетическом Адаме» решающее слово оказалось за другим специальным ДНКовым текстом. Это — последовательность нуклеотидов Y-хромосомы, определяющей мужской пол. Как уже говорилось, от других хромосом она отличается тем, что передается в человеческой популяции только по мужской линии. Другое важное свойство этой хромосомы — отсутствие в ней, как и в митДНК, рекомбинаций при передаче по наследству. На сегодняшний день мы значительно меньше знаем о «генетическом Адаме», поскольку его генетический маркер — Y-хромосома — значительно более сложен во всех отношениях, чем митДНК — генетический маркер «Евы». Кроме того, оказалось, что Y-хромосома служит важным источником эволюционных инноваций у человека, с ней связано большое число мутаций, лежащих в основе эволюции и приводящих к весьма значительным изменениям генома человека. Иногда шутят: стоящая на двух ногах женская X-хромосома оказалась значительно менее склонной к мутациям, чем одноногая мужская Y-хромосома. Но в каждой шутке есть доля правды. Именно мужчины несут ответственность за множество мутаций, накапливающихся в человеческом геноме. Некоторые полагают, что в этом есть определенный смысл: мужчина — двигатель прогресса, он идет вперед и изменяется соответственно условиям жизни, а женщина — хранительница рода, она должна быть более постоянной и устойчивой.
В ряде лабораторий мира провели сравнение нуклеотидных последовательностей Y-хромосомы разных современных популяций человека с целью построения достоверных отцовских линий родства, ведущих к единственному предку — генетическому праотцу человечества — «генетическому Адаму». И те данные, которые уже имеются в нашем распоряжении, указывают нам, что «генетический Адам» происходит из Африки, где он существовал около 200 тысяч лет назад, то есть там же и примерно в то же время, как и «генетическая Ева». В результате все ныне живущие на Земле люди являются прямыми потомками по мужской линии одной небольшой популяции мужчин, существовавшей в те давние времена. Таким образом, условные «Адам» и «Ева» скорее всего действительно существовали на нашей планете в те древние времена, и от них-то, по всей видимости, и произошел весь род человеческий.
Дополнительное подтверждение всем этим фактам неожиданно пришло от давно забытой науки френологии, занимающейся изучением черепов человека, которой когда-то увлекался уже упоминавшийся двоюродный брат Ч. Дарвина Ф. Гальтон. Американские палеоантропологи Стрингер и Райт исследовали черепные кости останков самых ранних европейцев и обнаружили, что эти черепа не различаются, как сейчас, в зависимости от географии, а сходны друг с другом и очень подобны по характеристикам черепным костям людей, живших в Африке и нынешнем Израиле 120 тысяч лет тому назад. Это стало еще одним подтверждением генетических данных об исходе современного типа человека из Африки.
Оцененное молекулярно-генетическими методами совпадение, как по времени, так и по месту прародителя и прародительницы, сильно воодушевило исследователей и придало им большой оптимизм. Работа в этом направлении интенсивно продолжается, но она далека от завершения. Остается еще много вопросов. Так, казалось бы, само собой разумеется, что наши дальние африканские прародители должны были бы быть похожи на современных жителей этого континента. Однако некоторые новые исследования указывают на то, что первые люди, появившиеся в Африке, были по своему виду ближе к монголоидам. Вероятно, в ближайшее время после дополнительных крупномасштабных исследований геномов разных популяций человека появятся более точные сведения обо всем этом.
Итак, на основании анализа генетических текстов сегодня можно считать практически доказанным, что у человечества имеются весьма немногочисленные генетические прародительницы и праотцы. Эти генетические «Адам» и «Ева» жили скорее всего в Африке 150–200 тысяч лет назад. И их генетический материал до сих пор присутствует в каждом из нас. Конечно, речь идет не о библейских Адаме и Еве, а о вполне конкретных мужчинах и женщинах, потомками которых являемся мы все, ныне живущие на Земле люди. Человек современного типа скорее всего возник первоначально в одном месте. Учитывая небольшое различие между геномами разных современных людей, подсчитали, что исходная популяции наших предков состояла максимум из 10000 особей. За сотни тысяч лет, прошедшие после «Адама» и «Евы», в ДНКовом тексте их потомков постоянно появлялись все новые и новые мутации, в том числе и такие важные, которые определяли процесс эволюционного формирования человека (антропогенез) и обеспечили превращение наших человекоподобных предков в современных людей. Вывод об Африканском происхождении человека подтверждается и некоторыми другими фактами, в частности, данными, полученными при изучении языка бушменов, населяющих Южную и Восточную Африку. Их язык содержит специфические щелкающие звуки, обособленно стоящие в системе языков народов мира. У бушменов в митДНК обнаружена наиболее древняя мутация, которая появилась после возникновения человека как обособленного вида. Кроме того, у тех же бушменов и в Y-хромосоме выявлена мутация, которая имеется у обезьян, но отсутствует в популяциях других людей. Предполагают, что эта мутация возникла еще до эволюционного разделения человека и шимпанзе.
Итак, казалось бы, совершенно противоположные мысли и идеи относительно происхождения человека слились воедино. Обезьяноподобные существа все-таки оставила свой крупный след в этом процессе. Но далее были и «Адам» и «Ева». От них-то в конечном результате и пошел род человеческий! Однако это совсем не те библейские Адам и Ева. Вновь полученные генетические данные весьма существенно расходятся с православной христианской версией, согласно которой это событие произошло в 5508 году до н. э. (то есть всего около 7500 лет назад), а Адам и Ева были тогда единственными людьми на земле. Здесь нет совпадения с данными эволюционной геномики ни по времени, ни по месту, ни по числу, ни по истокам (что важнее всего в этом извечном вопросе).
Исследования полиморфизма геномов, проводимые с целью изучения происхождения и эволюции человека, дают новые аналогии между ДНКовым текстом человека и его языком. Так, мы говорили выше на основании анализа ДНКового текста человека о существовании генетических праотца и праматери всего рода человеческого. Сравнительно-историческое изучение разных индоевропейских языков выявило в них регулярное соответствие между звуками, словами и формами. И в этой связи сейчас предполагается, что все эти языки являются потомками одного исчезнувшего древнего языка, из которого они произошли — праязыка.
ИСТОРИЯ С ГЕОГРАФИЕЙ, ЗАПИСАННАЯ В НАШЕМ ГЕНОМЕ (этногеномика)
В каждом человеке есть что-то от всех людей.
Георг Кристоф Лихтенберг
В сей мир едва ли снова попадем,Своих друзей вторично не найдем.Лови же миг! Ведь он не повторится,Как ты и сам не повторишься в нем.Омар Хайям
Итак, по современным молекулярно-генетическим оценкам человек как биологический вид существует на Земле где-то около 200 тыс. лет. Что же с ним происходило в течение прошедшего периода? Как он распространился по всей планете? Как возникли разные расы и разные народы? Ответить на все эти вопросы до недавнего времени казалось практически невозможно. Думали, что из глубины 2000 веков не сохранилось никаких достоверных исторических источников.
Ранее об эволюции и истории человечества судили главным образом только на основании древних культурных исторических находок, анатомических исследований ископаемых останков и сравнительной анатомии, физиологии и эмбриологии современных людей и обезьян. Первые достоверные сведения о деяниях человеческих дают только археологические источники — декоративные деревянные и костяные предметы, записи погребальных обрядов на стенах пирамид, которые относятся примерно ко времени лишь за 25–26 тыс. лет до новой эры. Ясно, что и до этого времени что-то было (не мог же человек, только появившись на свет как вид, сразу начать писать разные тексты и украшать красивыми предметами свой быт), но вот что было до того — это долгое время оставалось совершенно непонятным.
Согласно сведениям догеномного времени, на Земле миллионы лет длился «каменный век», который закончился около 10 000 лет назад. В этом веке и появился человек. Считается, что культура стала развиваться в каменном веке с появлением кроманьонцев (40–50 тыс. лет назад). После этого начался недолгий «новый каменный век», который назвали «неолит» (ок. 8–3 тысячелетия до н.э.). В этот период стало развиваться земледелие и скотоводство. 5000–6000 лет назад наступил «медный век», потом «бронзовый век», а за ним «железный», которому чуть более 3000 лет. Но все это самые общие сведения, которые могут быть еще подкорректированы. Что говорить, даже историю Руси мы знаем более или менее достоверно только начиная с середины IX века нашей эры! Как же проникнуть взором на глубину 2000 веков? Долгое время это казалось совершенно невозможным.
Однако теперь после секвенирования генома человека и появления новых методов исследования ДНК ситуация существенно изменилась. Неожиданно для всех выяснилось, что вся длинная история человечества записана в геноме ныне здравствующих людей!
Ее просто надо уметь читать.
Академик Л. Л. Киселев считает, что «многие спорные вопросы истории цивилизаций будут, скорее всего, решены не историками, а геномоведами. Например, уже сейчас ясно (хотя эти работы начались совсем недавно), что происхождение и миграцию народов легче всего будет проследить по геномным маркерам, которые дают количественную и однозначную информацию».
Историки растерянно разводят руками перед объективными фактами, предоставляемыми геномикой, которые касаются вопросов происхождения человека, возникновения наций и новых государств, миграций целых народов и их деяний на нашей планете. Что значат на этом фоне, например, попытки создать «Новую хронологию», предпринятые академиком А. Т. Фоменко? Они похожи на усилия Герострата увековечить свое имя в истории. Только лишь благодаря геномике в ближайшие годы, безусловно, будут внесены существенные коррективы и в историю человечества, и в теорию эволюции живой материи. Всеми этими весьма неоднозначными проблемами теперь занимается новое направление в геномике — этногеномика. Взяв на себя весь большой груз ответственности, она начала на новом уровне и принципиально новыми методами описывать становление человека как биологического вида в целом, генетические особенности отдельных народов и рас, а также восстанавливать историю их формирования. Частично мы уже говорили о достижениях этногеномики в таком чрезвычайно тонком и принципиальном вопросе, как установление «генетического Адама» и «генетической Евы». Это, конечно же, большое и неоспоримое достижение ученых-этногеномиков, но оно не стало единственным. Продолжим этот разговор.
Прежде всего, поговорим о способах «прочтения» истории человечества, основанных не на исторических источниках и археологических раскопках (которым ученые-историки часто не доверяют, спорят с ними, создают вокруг этого целые новые теории), а лишь на ДНКовых текстах человеческого генома, содержащихся в каждом из нас. Теперь все споры из области логических рассуждений на базе разрозненных исторических фактов перемещается в область точных экспериментальных данных, хотя, конечно же, прежде надо будет научиться грамотно читать эти нетленные тексты.
После полного секвенирования генома человека появилась возможность изучать более детально историю рода человеческого по таким генетическим изменениям в нем, как мутации и перестройки, которые иногда назвают «конструктивными новинками», спонтанно возникающими время от времени у отдельных особей. Как уже говорилось, такие новинки — результат безостановочного накопления случайных мутаций в геноме. Понятно, что эти изменения должны быть невелики, чтобы не привести к патологии или гибели организма. Этому есть и определенная литературная аналогия: если кто-то пытается усовершенствовать классический литературный текст, внося только корректорскую правку (расстановку запятых или исправление ошибок в словах), результат будет скорее положительным, но когда кто-то попытается сделать существенные изменения, это почти во всех случаях испортит оригинальный текст.
«Конструктивные новинки» в геноме послужили основой для «прочтения» человеческой истории. Скорость изменения генов за счет точечных мутаций невелика, но настолько устойчива на протяжении долгих периодов времени, что ее можно использовать для датировки ответвления разных ветвей от общего ствола. Чем дальше родство, тем больше различий в генетических текстах (на этом основаны уже упоминавшиеся «молекулярные часы»). То есть, число различий в последовательностях ДНК двух организмов примерно пропорционально времени, прошедшему с момента дивергенции (расхождения) этих организмов от общего предшественника. На этом и базируется построение генеалогического (родословного) древа человечества.
Ранее генеалогические корни и древа люди искали, долго роясь в старинных документах, большинство которых, как правило, плохо сохранилось в течение веков, а порой и вообще не сохранилось.
Сотни тысяч лет, прошедшие с момента возникновения первых людей, погребли много тайн, раскрыть которые теперь уже казалось никогда невозможным. Да что говорить. В России, например, ведением родословных в основном занимались лишь в некоторых знатных дворянских семьях. Причем первые родословные росписи появились только в конце XV века. Но в большинстве же своем этот период отличался удивительным невежеством. Меткую характеристику ему дал в свое время писатель И. С. Аксаков. По его словам, жители России «большей частью о предках своих ничего не знают, преданий рода не уважают, семейной старины не помнят».
Что же говорить в этой ситуации о родословной всего человечества, которая простирается назад на двести тысяч лет, если мы и своих ближайших предков (прабабушек и прадедушек) плохо знаем, а чаще не знаем вообще? Где же найти такие древние первоисточники? Казалось, что все это пропало во мраке веков. И вдруг ситуация резко изменилась. Стало очевидным, что главный свидетель всех многовековых событий в истории человечества — ДНК самого человека — не горящий и не тонущий фолиант. Как же ДНКовый текст помогает создавать генеалогические древа человечества?
Лишь в последние годы выяснилось, что молекулярная генеалогия (иногда ее называют архегеномикой) может стать важнейшим средством для связи людей по принципу «семейного древа». Дело в том, что на земле не существовало и не может существовать людей с абсолютно одинаковым геномом. С другой стороны, мы наследуем ДНК от своих родителей и каждый конкретный человек несет в себе генетическую информацию о своих предках. Процесс наследования ДНК повторялся из поколения в поколение независимо ни от чего, и по этой причине все люди на планете несут (хотят они того лично или нет) информацию о том, как они связаны в прошлом друг с другом. Все это означает, что наша ДНК подобна некой «летописи», которая может быть использована как для того, чтобы различить людей, так и для выявления членов одной семьи, одного рода и одной популяции.
Рассмотрим типичную картину возникновения некой новой популяции людей. В результате каких-то причин небольшая группа людей, часто родственников, отселяется (изолируется) от остальных. Весьма вероятно, что, по крайней мере, у одного человека из этой группы имеется какой-то необычный вариант мужской половой Y-хромосомы, ДНКовый текст которой отличается от остальных одним нуклеотидом в определенном положении. Как уже говорилось, Y-хромосому получают от отца только вновь родившиеся мальчики. Она при этом ни с чем не перемешивается и, оставаясь неизменной, передается по мужской линии из поколения в поколение: от отца к сыну, к внуку и так далее. По сути дела в данном случае Y-хромосома служит чем-то вроде «фамилии», она указывает на принадлежность человека к данному роду и его происхождение. Только, в отличие от обычной фамилии, эту «фамилию», записанную в ДНКовом тексте Y-хромосомы, практически нельзя поменять, от нее нельзя отречься, как нельзя отречься от своих генетических предков и потомков, несущих в себе ту же самую Y-хромосому. В течение многих лет численность изолировавшейся группы людей растет, растет и число потомков человека с такой редкой мутацией (хотя, возможно, их доля и не возрастает). Но по истечении определенного времени в Y-хромосоме, которая маркирована этой мутацией, начинают накапливаться мутации и в других местах (например, в таких ее нестабильных участках, как микросателлитные повторы). Анализ происходящих изменений с помощью «молекулярных часов» позволяет определить, когда во времени разошлись разные ветви. Сравнивая ДНК отдельных людей, можно судить об общности их происхождения или родственных связях. Закон один: чем больше различий, тем дальше родство. Вот так по ДНК одной Y-хромосомы можно изучить историю ее потомков, т. е. реконструировать генеалогические древа человечества. Такие реконструкции ДНКовых тектов привели в конечном итоге к более ясному пониманию картин распространения человечества по планете и возникновению разных рас и народов.
Волны миграций человека по планете
Считается, что существенную роль в эволюции и распространении всех видов организмов по земле, в том числе и человека, играли циклические изменения климата, происходившие на нашей планете с интервалом в десятки тысяч лет. В периоды похолодания зоны обитания и численность животных сокращались, а в периоды потепления численность и разнообразие живых форм повышались, и разные виды расселялись на пригодные для жизни территории — из Африки в Азию и Европу. Всему этому удалось найти подтверждение при анализе геномов современных людей. Все новые и новые генетические данные постепенно проясняют более детально картину заселения людьми разных континентов, возникновения в разных регионах земли новых человеческих общностей. Хроника покорения человеком нашей планеты постепенно восстанавливается по многочисленным генетическим «уликам» (в первую очередь по снипсам).
Обследование митДНК и ДНК, содержащейся в Y-хромосоме, большого числа людей из различных районов мира привело к обнаружению свыше двух сотен полиморфных участков-маркеров, по которым в конечном итоге и шло сравнение. Совокупность изменений в маркерах отразила «молекулярную историю» миграции человека. В конечном итоге было выделено около двух десятков «пунктов назначения» движения миграционных волн, что позволило построить генеалогическое древо рода человеческого. Этому в значительной мере способствовало наличие уникальных групп маркеров, характерных для определенных географически и исторически изолированных популяций людей (таких, например, как Исландия и Япония).
В целом современные представления о процессе миграции человеческой популяции по Земле, полученные в результате анализа многочисленных снипсов в Y-хромосоме и митДНК, отражены на рис. 39 на цветной вклейке.

Рис. 39. Пути и время миграции человека на Земле, установленные по генетическим маркерам. Стрелки — направление миграции, разными цветами на стрелках обозначены времена миграции (из вкладки в журнале Nature, февраль, 2001 год).
Разные расы и народы возникли после разделения некой относительно однородной предковой популяции. В каждой из групп людей независимо произошли свои, весьма характерные для них мутации. Сравнительный анализ митДНК разных популяций ныне живущих людей позволил заключить, что в каменном веке предковая популяция разделилась по крайней мере на три группы, давшие начало африканской, монголоидной и европеоидной расам. Исследования этногенетиков указывают на отсутствие каких-либо генетических основ деления людей на расы. Люди, принадлежащие к разным расам, имеют очень маленькие различия в геномах. Тем не менее, эти небольшие, но весьма специфические различия между отдельными линиями митДНК могут служить указанием на монголоидное или европеоидное происхождение.
Согласно данным этногеномики, около 60–130 тыс. лет назад произошел выход человека из Африки в Азию. Первые переселенцы из Африки достигли Переднего Востока и около 60 000 лет назад заселили почти весь азиатский континент. 40–60 тыс. лет назад человек уже освоил земли Австралии, Америки и Европы.
По частотам древних типов мутаций в нуклеотидных последовательностях митДНК и ДНК Y-хромосом в разных европейских популяций человека удалось реконструировать несколько волн миграций людей в Старом Свете. Установлено, что первые переселенцы из Азии появились в Европе 40–50 тыс. лет назад в эпоху палеолита. Линии митДНК, попавшие в Европу с первой волной переселения, составляют сейчас значительную часть митДНК людей, населяющих территории от северозапада Европы до Уральских гор. По митДНК определено, что у 80% европейцев было, по крайней мере, семь матерей-основателей и десять мужчин-предков. По данным англичанина Брайана Сайкса, приведенным в его книге «Семь дочерей Евы», все современные европейцы являются потомками семи дочерей «генетической Евы». Другие 27 женщин стали прародительницами всего остального населения Земли. И одна из них должна быть вашей прапрапра…прабабушкой. Вывод относительно числа мужчин-предков европейского населения был сделан большим интернациональным коллективом ученых, включающим и исследователей из России (во главе с профессором С. А. Лимборской), в результате масштабного анализа Y-хромосомы. В генофонде большинства европейских мужчин были обнаружены всего десять типов этой половой хромосомы. Таким образом, основная часть европейцев (около 80%) имеет прародителей, переселившихся в Европу из Центральной Азии или с Ближнего Востока еще в каменном веке (т. е. около 40 тысяч лет назад).
Конечно, утверждение о десяти праотцах и семи праматерях современных европейцев не следует понимать буквально. Во-первых, их было, безусловно, значительно больше (но оценить общее число пока трудно). Во-вторых, они, вероятно, вообще жили в разные эпохи. Ученые лишь утверждают, что среди всех людей, живших 40 тысяч лет назад, очень немногие имели вероятность оставить прямых потомков, доживших до наших дней. Элементарная статистика предсказывает (и об этом мы уже говорили), что чем больше поколений пройдет, тем меньше вероятность того, что конкретный род, обладающий определенной Y-хромосомой, сохранится. Ведь на протяжении многих поколений в одних семьях рождалось несколько мальчиков, а в других — ни одного. Результатом этого стало то, что один род (и одна разновидность Y-хромосомы) навсегда исчезал, а какой-то другой род (совершенно случайно) давал более многочисленное потомство. В конечном итоге неизбежно должен наступить момент, когда в конкретной популяции исчезнут все исходные фамилии, кроме одной. Похожий процесс можно наблюдать, например, в небольших изолированных поселениях, гда все жители могут носить одну фамилию.
Что же еще прочли генетики в Энциклопедии человека? Согласно современным генетическим данным, в начале последнего ледникового периода (около 24 тыс. лет назад) потомки древних людей, пришедших в Европу из Азии, нашли прибежища в разных уголках Европы. В результате этого образовались три изолированные эволюционные ветви: первая на территории нынешней Испании, вторая — на территории Украины, третья — на Балканах. Наиболее уникальной по генетическим характеристикам популяцией оказались баски. Сейчас считается, что они являются единственными современными представителями древнейших жителей Европы — кроманьонцев. Интересно, что выводы генетиков подтверждаются и некоторыми данными лингвистов, свидетельствующими об уникальности языка басков. В дальнейшем, примерно 16 тысяч лет назад, когда произошло таяние льдов, племена расселились по всей Европе: испанские племена двинулись на северо-восток, украинские — в Восточную Европу, а балканские так и остались в Центральной Европе. Вторая волна переселения народов в Европу соответствует продвижению неолитических земледельческих народов из мест зарождения земледелия (район Месопотамии) на север и запад Европы. В этом генетическая оценка совпала с археологическими данными: процесс скорее всего произошел во время неолита, примерно 7–9 тыс. лет назад. Вот эти то переселенцы и добавили европейцам-мужчинам недостающие 20% генофонда (напомним, что 80% генофонда было получено еще в каменном веке). Наконец, еще одна волна миграции, которая соответствует экспансии греческой культуры, произошла в I тысячелетии до нашей эры. Как раз перед этим Моисей, согласно преданиям, вывел еврейский народ из Египта, а потом 40 лет водил его по пустыне.
Ученые продолжают изучать детали миграционных процессов, происходивших в истории человечества. И постепенно выяснилось еще много интереснейших фактов, которые удалось установить только благодаря исследованиям ДНК человека. Так, было определено, что полинезийцы скорее всего открыли Америку задолго до Колумба. К такому выводу пришли ученые в результате сравнения ДНК коренных жителей Самоа с ДНК индейских племен Южной Америки. В генетике людей, живущих за шесть тысяч километров друг от друга, обнаружилось заметное сходство. Вероятно, около 500 года новой эры мореплаватели из южной части Тихого океана, передвигаясь на парусных суденышках, достигли Америки. Какое-то время полинезийцы поддерживали торговые отношения с коренным населением континента. Подкрепляет эту теорию следующий негенетический факт: уже около 1000 года новой эры в Полинезии появляется батат, хотя этот клубнеплод был «официально» открыт лишь пять столетий спустя, когда в Америке побывал Колумб.
Так откуда же в конечном итоге пришли люди в Америку? И на этот вопрос уже получены первые ответы. Согласно данным анализа ДНК современных людей, прародителями первоамериканцев являются предки из Южной Сибири. Обнаружены многочисленные следы, оставленные в Y-хромосоме, связывающие население Америки с их отдаленными предками, жившими в районе Байкала. Сложнее обстоит пока дело с предками по женской линии. Но так или иначе генетики уже дали существенную подсказку, где искать истоки американизма — на территории современной России. (Теперь у американцев имеются «веские» основания претендовать на нашу Сибирь как на свою историческую родину!).
Исследуя мутации, которые проникли в ДНК Y-хромосомы, ученые могут оценить, насколько мужчины из двух этнических групп отдалены (в генетическом смысле) от нашего общего предка. Некоторые из полученных этим способом результатов оказались весьма удивительными. Например, выяснилось, что уэльсцы и англичане генетически почти не связаны между собой. (Может быть, в этом и кроется причина постоянных противоречий между ними). При этом только уэльсцы оказались истинными потомками бриттов (древних жителей Британии), а современные англичане оказались генетически наиболее близки к жителям Нидерландов, где ранее предположительно они и проживали.
Проведенные исследования ДНК дали много и других любопытных результатов. Так, всегда считалось, что путешествия есть прерогатива мужского пола. Однако, как показали анализы митДНК и ДНК Y-хромосом, женщины в те далекие времена мигрировали гораздо интенсивнее, чем мужчины. Этот факт можно объяснить, по-видимому, тем, что для большинства разнообразных человеческих сообществ всегда был характерен уход женщин после замужества в дом мужа. Таким образом, миграции женщин, связанные с браком, вероятно, оставили в геноме человечества не меньший, а, может быть, более заметный след, чем, скажем, исход евреев из Египта или все военные походы Александра Македонского.
Итак, без всяких археологических находок и исторических источников, а только лишь по ДНКовым текстам, содержащимся в ядерном и митохондриальном геноме современных людей, генетикам удается восстановить историю появления первых людей на Земле, описать пути их миграции, отследить глубокие родственные связи между разными расами, народами и нациями. Отсюда следует важный вывод: природа сохранила в нашей ДНК единственный достоверный сотневековый летописный текст.
Генетические ландшафты (геногеография)
Анализ нуклеотидных последовательностей геномов позволяет разными методами оценивать степень родства между разными популяциями ныне живущих людей. Осуществляют это, например, по специальным картам, на которые нанесена информация о распределении частот вариаций сотен вариантов (аллелей) генов в разных регионах Земли. Такие карты называют иногда «генетическими ландшафтами», а сам подход — геногеографией. Слово география по-гречески обозначает «землеописание». Описывать территорию можно по разным критериям. Так, рельеф земной поверхности описывает физическая география, размещение государств на земле — экономическая, территориальное распространение языков — лингвическая. География генома изучает и описывает территориальное распространение различного рода структурных особенностей генома индивидуумов. Сам термин геногеография был предложен российским ученым А. С. Серебровским в 1928 году задолго до появления программы «Геном человека». Тогда же было введено понятие «генофонд», обозначающее совокупность генов у особей популяции, занимающей отдельную административную или национальную территорию. Однако начало геногеографии было положено по сути дела еще раньше, благодаря работам Н. И. Вавилова по изучению географических закономерностей в распределении генов культурных растений и выявлению генетических центров их происхождения. Уже тогда пришло понимание того, что эволюционный процесс, до того рассматриваемый лишь во времени, необходимо изучать и как географический процесс возникновения разнообразия генов в определенных центрах с последующим распространением их по периферии.
Современная геногеография основывается на изучении и сравнении полиморфизма генома человека в разных популяциях людей. С помощью построения генетических карт она позволяет определять генетические расстояния между разными существующими на нашей планете группами людей и на этом основании вычислять время их разделения в ходе эволюции, то есть позволяет воспроизводить сюжеты из истории человечества. Картографический метод исследования в геногеографии создает специальные карты, которые отражают результаты генетических процессов, возникающих в ходе формирования и развития народонаселения и их взаимодействия со специфической географической средой обитания. На рис. 40 на цветной вклейке в качестве примера приведена одна из таких карт.

Рис. 40. Карта географической изменчивости в населении Старого Света частоты гена CCR5-?32, который обуславливает устойчивость людей к инфицированию вирусом иммунодефицита человека. Цветовой переход соответствует изменению значений частоты (указан в шкале интервалов). Карта выявляет четкую клинальную изменчивость: падение частоты мутации от Северной Европы (выше 15 %) к югу и востоку. Так, если в Европе в целом частота мутации превышает 5 %, то в Африке южнее Сахары и Восточной Азии мутация отсутствует. (Карта любезно предоставлена доктором биологических наук Е. В. Балановской).
Это интересное направление исследований сейчас интенсивно развивается во всем мире и особенно бурно в многонациональной России с ее многочисленными этническими группами. Чем, например, отличаются башкиры от славян? А монголы от турок? Удмурты от грузин? То, что они говорят на разных языках, знают все. А вот каковы ДНКовые различия между ними? Оказывается, что, хотя раз личия в геномах представителей разных этнических групп чрезвычайно незначительны, они абсолютно достоверны. Поэтому можно в ДНК выделить определенный «рисунок» последовательности нуклеотидов, который будет говорить о том, что этот человек — башкир, а этот — татарин. На базе этих фактов российские ученые показали, например, что русские, и в целом славяне, очень близки к западноевропейцам, но очень далеки, например, от монголов и китайцев. Это не соответствует существовавшим долгое время подозрениям, что после татаро-монгольского ига русские как нация могли сильно «загрязниться». По нашей ДНК этого совсем не видно. Среди русских, населяющих центральные области Европейской части нашей страны (Рязанской, Курской и Калужской областей), 97–98% материнских линий являются европеоидными, и лишь 2–3% составляют монголоидные. В Волго-Уральском регионе столкнулись две волны расселения: европеоидная и монголоидная. Следы этого также хранят наши геномы. Согласно записанным в них «преданиям», у всех современных народов, населяющих этот район, кроме башкир, по материнской линии преобладает европеоидный тип. Но по мере продвижения с запада на восток происходит уменьшение численности европеоидов и увеличение монголоидов.
Европеоидные линии преобладают и у народов финно-угорской языковой группы (мари, удмурты, коми), и у тюркоговорящих народов, проживающих в этом регионе. Так, 85% татар по материнской линии европеоидные, а таковых чувашей аж 90%. Монголоидные линии составляют 65% только у их восточных соседей, башкир. Это означает, что современная граница расселения европеоидов и монголоидов географически проходит примерно по Уралу, а популяционно-генетическая — между башкирами, обитающими по обе стороны Уральского хребта, и их западными соседями — татарами. Интересно, что наблюдаемая картина далеко не всегда коррелирует с языком этих народов.
Благодаря геногеографическому изучению генофонда порой обнаруживаются поразительно интересные факты. Так выяснилось, что славяне близки по материнской линии к нашим западным соседям: немцам и угро-финнам. Весьма принципиальны генетические исследования, которые проливают свет на извечный вопрос о родстве евреев и арабов. Анализ генетического материала Y-хромосом у мужчин в этих популяциях позволил заключить, что, несмотря на теперешние различия, у арабов, евреев, сирийцев, палестинцев и ливанцев был единый предок, живший в Средней Азии примерно четыре тысячи лет назад. Не зря, видимо, в библейских преданиях речь идет об Аврааме, родоначальнике евреев и арабов, а в мусульманской мифологии говорится об Ибрахиме — общем праотце этих двух народов.
К огромному сожалению, пока что эти объективные генетические данные (нередко совпадающие с мифами и легендами) реально очень мало чем помогли в вопросе взаимоотношений рас и народов. Зачастую одно государство идет войной на другое, где живут их почти генетические братья. Возьмите хотя бы постоянные войны между англичанами и ирландцами, французами и немцами, хорватами и сербами, евреями и палестинцами. Одумайтесь, братья!
Продолжая рассказ о достижениях современной этногеномики и геногеографии человека, следует привести еще один недавний, но очень показательный пример. Английский исследователь Б. Сайкс (Sykes) решил просто так, наудачу, проверить ДНКовые тексты микросателлитов Y-хромосомы своих многочисленных однофамильцев. Для этого, не мудрствуя лукаво, он просто использовал имевшиеся под рукой телефонные справочники г. Йорка и графств Чешира и Ланкашира. (Хотя выбор Сайкса был вообще-то совершенно случаен, комментаторы в дальнейшем отметили, что он у них ассоциирует с некоторыми историческими фактами — с войной между династиями Ланкастеров и Йорков, известной как война Алой и Белой роз, и со знаменитым чеширским котом. Но дело совсем не в этих ассоциациях.) Сайкс получил результат, который поразил даже его самого (не говоря уж о многих других ученых): почти у половины случайно отобранных однофамильцев имелось полное сходство в снипсах ДНК. Это однозначно указывает на то, что все они произошли скорее всего от единого предка. Ученый даже не мог себе представить, что у него такое огромное число родственников. Это значит, что 700 лет назад, когда в Англии появились фамилии, род Sykes был локализован на одной площади. Дальнейшие исследования показали аналогичную пропорцию и для других имен. А ведь и у нас с вами ситуация, по-видимому, во многих случаях именно такая же.
По результатам исследований, проведенных Сайксом, удалось сделать еще один очень любопытный вывод: супружеская измена, и как следствие этого невозможность для ребенка узнать своего истинного отца, не так распространены, как теоретически предполагалось. Ранее вероятность этого оценивалась в 5–10 процентов, работа по роду Sykes дала цифру всего около 1 процента.
Сегодня уже любой желающий может проследить свое происхождение как по отцовской, так и по материнской линям. Для этого в Англии существует специальная фирма Family Tree DNA (www.familytreedna.com). Чтобы удовлетворить свое любопытство, достаточно заплатить 150 фунтов и прислать несколько капель собственной крови. Взамен вы получите расшифровку определенного фрагмента ДНК, полную информацию о вашей прародительнице и карту, обозначающую ваше место на генеалогическом древе человечества. Многие уже этим воспользовались, в результате чего обзавелись новыми многочисленными родственниками.
Информация, содержащаяся в Энциклопедии человека, порой удивительным образом совпадает с известными преданиями и легендами. Например, одно из древних преданий гласит, что все монголы произошли от трех матерей. И анализ митДНК, наследующейся только по материнской линии, показал, что большая часть населения Монголии по генетическим характеристикам очень четко разделяется на три группы. Возможно, здесь имеет место просто случайное совпадение, но подобного рода результаты воодушевляют ученых на все новые и новые крупномасштабные исследования.
Во всём этом просматривается еще одна аналогия между ДНКовым текстом и языком человека. Из лингвистики известно, что развитие языка как средства общения людей регулируется двумя противоборствующими процессами: дивергенцией (расхождением, дифференциацией) и конвергенцией (схождением, интеграцией). Первый из них происходит при распаде некогда единого языкового коллектива и ведет к накоплению языковых различий, проявляющихся в образовании диалектов. Напротив, в случае объединения племен (например, при формировании государства) неизбежно начинается интеграция диалектов. Оба этих процесса происходят и при эволюции генома. Они хорошо просматриваются при анализе геномов разных популяций человека. Диалекты в языке — это снипсы и полиморфизм генов в геноме. В ходе эволюции в геномах изолированных групп людей накапливаются разные снипсы, происходит дивергенция геномов. При объединении этих групп в их геномах появляются сходные полиморфизмы-диалекты. Более того, лингвистическая география уже давно оперирует диалектными картами, весьма схожими с геногеографическими картами.
Итак, сейчас стало окончательно ясно, что человечество получило в свое распоряжение надежный и воспроизводимый метод «генохронологии». Конечно, все это чрезвычайно интересно не только для генетиков, историков и политиков, но и для обычного читателя. Здесь кроется ключ к решению многих проблем, таких, как поиск причин различных наследственных заболеваний, индивидуальной восприимчивости к лекарствам, выяснению роли мутантных генов во взаимодействии организма человека со средой обитания и многих других. Такой подход связывает геномику с историей, лингвистикой, токсикологией, археологией, палеонтологией, этнографией.
ЗАКОНЧЕНА ЛИ ЭВОЛЮЦИЯ ЧЕЛОВЕКА?
Кто не идет вперед, тот идет назад: стоячего положения нет.
В. Г. Белинский
Уже самый факт происхождения человека из животного царства обуславливает собой то, что человек никогда не освободится полностью от свойств, присущих животному, и, следовательно, речь может идти только о различной степени животности или человечности.
Ф. Энгельс
Подавляющее большинство из нас безусловно ответит на вопрос, поставленный в заголовке, положительно и будет отвергать любую возможность естественной и тем более искусственной эволюции человека. В первую очередь, это люди верующие, согласно мировоззрению которых, они были созданы творцом в качестве венца и в таковом качестве в дальнейшем улучшении или развитии совершенно не нуждаются. Во-вторых, это люди, которые, даже не будучи религиозными, считают себя тем же венцом творения, просто потому, что человек объективно представляет собой самое высокоразвитое существо на планете. Вообще-то средний человек никогда даже не задумывается над такой проблемой, в его подсознании просто преобладает чувство довольства собой. Удивление и непонимание вызывают даже те, кто стремятся как-то развить свои умственные способности, поскольку это требует значительных усилий. В романе «Подросток» Ф. Достоевский устами своего героя Версилова выразил важную мысль: «А, и ты иногда страдаешь, что мысль не пошла в слова! Это благородное страдание, мой друг, и дается лишь избранным; дурак всегда доволен тем, что сказал».
По мнению многих антропологов, человек как вид практически не эволюционирует уже на протяжении 30 тысяч лет. Вместе с тем окружающая среда, экология, питание и образ жизни человека все время меняются. И это неизбежно на нем отражается. Например, отмечаются некоторые микроэволюционные изменения человека, такие, как грациализация скелета и редукция зубов. Общеизвестно, что всего за последние 200 лет средний рост европейцев увеличился на 30 см. В наше время изобилие жирной пищи поставило человечество еще перед одной проблемой — избыточным весом. Сейчас мы увеличиваемся не в росте, а в объеме. Так, согласно статистике, в 1980 году средний вес мужчин составлял 73,7 кг, женщин — 62,2. В 2000 году эти цифры составили соответственно 81,6 и 68,8 кг. Ученые считают, что все чаще встречающийся у населения многих стран избыточный вес принесет человечеству новые болезни и страдания.
Следует также иметь в виду, что в нашу эпоху генофонд человечества испытывает все увеличивающуюся нагрузку в виде радиационного, химического и электромагнитного загрязнения среды обитания, что влечет за собой увеличение количества мутаций, связанных с развитием различных патологий, в частности, опухолевых заболеваний. Ситуация меняется и в связи началом массового применения технологии генной инженерии и искусственных манипуляций со структурой ДНК. Совершенно очевидно, что от модификации ДНК модельных животных организмов до ее направленного изменения у человека, передающегося по наследству, не так много шагов. Следует также учитывать скрытую возможность влияния средств массовой информации и глобальной сети Internet на психическую сферу человека.
Таким образом, не подлежит сомнению, что эволюция человека как вида будет происходить и далее (хотя, естественно, очень медленно). Во-первых, нельзя отменить законы генетики. Как бы мы не хотели, но мутации будут время от времени возникать в нашем геноме (особенно в связи с ростом популяции и нарушением экологии). Естественный отбор в обществе происходил и будет продолжаться независимо от нашего желания, одобрения или гневного возражения. Другое дело, что это не тот искусственный отбор, который осуществляли, например, спартанцы. В современном мире значение мускульной силы приобрело второстепенное значение. Но отбор на интеллект как фактор самостоятельного выживания, отбор на здоровое тело и дух будет продолжаться. И это несмотря на огромные достижения как в области медицины, так и в социальной защите населения.
Человеку еще предстоит многое сделать для своего собственного будущего, для раскрытия своих истинных возможностей. До сих пор мы мечтали о том, как мы изменим окружающую действительность, и мало думали о том, как бы нам изменить самих себя. Однако закон эволюции требует от нас сознательного роста, преобразования своей собственной природы. И созданная учеными-генетиками Энциклопедия человека должна стать важным подспорьем в этом архиважном деле.
Некоторые представления о диапазоне способностей и возможностей современного человека, определяемых геномом в сочетании с внешними условиями, дают любопытные факты, собранные в хорошо известной Книге рекордов Гиннесса.
Вот отдельные из них.
Наш современник Бханданта Висичара (Бирма) способен прочесть наизусть 16 000 страниц буддийских текстов.
Китаянка Гу Янлинь обладает способностью помнить наизусть 15 000 номеров телефонов города Харбина.
Американка Барбара Мур за 19 дней исполнила по памяти 1852 песни от начала и до конца.
Самым высоким мужчиной на земле был американец Роберт Першинг Уодлоу (США) — 2 метра и 72 сантиметра.
Самой высокой женщиной была Сен Чунлинь (Китай). Ее рост достигал 2 метров 48 сантиметров.
Самым маленьким мужчиной считается Гал Мохаммед из Нью-Дели (Индия). Его рост составляет 57 сантиметров, а вес — 17 килограмм.
Самой маленькой женщиной была голландка Полин Мастерс. Рост ее едва достигал 61 сантиметров.
Самым толстым мужчиной был Джонс Бровер Миннок из Бейнбридж-Айленда (штат Вашингтон, США). Его рост составлял 1метр 85 сантиметров, а вес достигал более 635 килограмм.
Самой толстой женщиной была Розали Брэдфорд (США). Ее максимальный вес составлял 544 килограмма.
Самым худым мужчиной был Хопкинс Хопкинс (Великобритания). В 7 лет Хопкинс весил 8,6 килограмм. А к моменту смерти его вес составлял всего 6 килограмм.
Самой худой женщиной была Лючия Сарате (Мексика). В 17 лет она была лилипуткой, которая при росте 67 сантиметров весила всего лишь 2,13 килограмма.
Самую длинную шею имеют женщины из племени падаунг, наибольшая из них — 40 сантиметров.
Самую большую грудь имел Роберт Эрл Хьюс из США. Ширина его груди составляла 3 метра 15 сантиметров.
Самые большие бицепсы имеет Дэнис Сестер из Блуминпона (штат Миннесота, США). Его правый бицепс в расслабленном состоянии составляет 77,8 сантиметра.
И, наконец, последний рекорд: за пять секунд выпил кружку пива (1,42 литра) англичанин Питер Додсвелл.
Вот таков он, многоликий современный ЧЕЛОВЕК!
ЧАСТЬ IV. ЧТО ДЕНЬ ГРЯДУЩИЙ НАМ ГОТОВИТ?
Сделай первый шаг и ты поймешь, что все не так страшно.
Сенека
В настоящее время, отвечая на вопрос, поставленный в заголовке этой части книги, мы можем воспользоваться словами из известной оперы. Сегодня наш «взор напрасно ловит» полное понимание того, что нам даст в будущем Энциклопедия человека, к чему приведут дальнейшие успехи молекулярных генетиков. Тем не менее, некоторые тенденции, надежды и сопутствующие им опасения уже можно высказать сейчас.
ГЕНОМ ЧЕЛОВЕКА КАК ОБЪЕКТ ИСКУССТВЕННЫХ МАНИПУЛЯЦИЙ
В связи с секвенированием генома человека и впечатляющими результатами, достигнутыми при работе с геномами лабораторных и сельскохозяйственных животных, с неизбежностью встал вопрос об искусственном вмешательстве в геном человека. Сегодня, когда мы стали многое знать о геноме человека, наступило время подумать и об использовании этих знаний в практических целях. В первую очередь речь идет о лечении различных наследственных заболеваний человека. Выше уже говорилось о первых успехах генной терапии, проводимой на уровне соматических клеток, и о тех ограничениях, которые сопровождают этот подход. Теперь ученые начинают думать и о других возможностях.
Огромное количество экспериментов, проведенных на трансгенных мышах и других лабораторных животных объектах, показало, что различные сходные с человеком патологии могут быть успешно преодолены у них с помощью искусственного внедрения в генетический аппарат половых клеток новых генов или исправления в половых клетках имеющихся «больных» генов. Список таких промоделированных на животных заболеваний весьма широк: серповидноклеточная анемия, диабет, нейродегенеративные нарушения, разные виды рака, дефекты иммунной системы и др. Однако для человека этот подход пока неприемлем по целому ряду причин. В первую очередь это связано с непредсказуемостью тех последствий, которые могут быть вызваны такого рода манипуляциями с геномом. Не меньшую роль играют здесь и морально-этические проблемы, на которых мы подробнее остановимся в следующей главе.
Другой путь для лечения различных патологий человека, который сейчас широко обсуждается, — это использование так называемых стволовых клеток человека. Эти клетки имеются как у эмбрионов на самых начальных этапах развития (их называют эмбриональными стволовыми клетками), так и в разных органах уже взрослого организма. В процессе жизни стволовые клетки служат постоянным источником все новых и новых специализированных клеток организма (клеток крови, печени, почек, мозга и др.). На модели лабораторных животных уже показана высокая эффективность использования таких клеток для лечения целого ряда болезней, сходных с заболеваниями человека. Например, ученые вводили здоровые стволовые клетки в мозг мышей с дефектом, передающимся генетическим путем. Стволовые клетки перемещались туда, где нужно было восстановить погибшие клетки, там они развивались, приобретали необходимый вид и успешно работали, исправляя природный дефект.
Сейчас уже активно обсуждаются подходы к генетическим манипуляциям со стволовыми клетками человека, их «лечению» на генетическом уровне и последующему пересаживанию таких искусственно «излеченных» клеток человеку для преодоления ряда тяжелых заболеваний, таких, как болезнь Альцгеймера, инсульт, рассеянный склероз и других врожденных и приобретенных патологий.
Однако неоевгеники справедливо утверждают, что лечение генно-инженерными методами уже родившегося человека с дефектной наследственностью не в состоянии исправить дефектные гены в его половых клетках и, следовательно, спасение таких индивидуумов от судьбы, уготованной им естественным отбором, позволит им передавать дефектные гены своему потомству, что неминуемо будет приводить к прогрессирующему ухудшению человеческого генофонда. По этой причине предлагается осуществлять замену дефектного гена непосредственно в половых клетках или клетках самых ранних человеческих эмбрионов. В этом случае от наследственной болезни будет избавлен не только сам больной пациент, но и все его будущие потомки. Но вот тут-то и возникает главная проблема. (Об евгенике, как об одном из направлений в генетике, определенное представление у читателя может дать материал, приведенный в Приложении 2.)
Действительно, для принципиального решения вопроса о наследственной болезни потребуются манипуляции с половыми клетками человека или с эмбрионами ранних стадий развития. Однако такое вмешательство может не пройти бесследно. Вылечивая определенные заболевания, мы можем параллельно создать такие непредсказуемые изменения в геноме, которые потенциально будут в отдаленном будущем иметь более серьезные негативные последствия, чем те, которые несут конкретные генетические дефекты. Одно дело трансгенные мыши и даже трансгенная обезьяна, совсем другое — трансгенный человек. Важно и то, что подобного рода манипуляции проводятся на уровне половых клеток и ранних эмбрионов, когда еще нет индивидуума как такового. А, родившись, трансгенный человек может и предъявить иск его непрошеным «целителям».
Еще более серьезная проблема, возникшая на рубеже двух тысячелетий, которая имеет отношение к искусственным манипуляциям с геномом человека, — клонирование людей. Эта проблема появилась в связи с успешной апробацией процедуры клонирования на различных лабораторных и сельскохозяйственных животных. К началу 2002 года было клонировано большое число мышей, 50 овец, 78 телят, 6 поросят и даже две обезьяны. И вот теперь подходит очередь человека.
Эта проблема имеет широкий резонанс в обществе, вокруг нее возник большой ажиотаж, появилось множество различных сенсационных сообщений. (Например, сообщалось, что некоторые американцы собираются «клонировать» Иисуса Христа, используя образец ДНК, полученный из одной христианской реликвии, которая, как считается, содержит частичку тела Иисуса.)
Дебаты о клонировании идут на разных уровнях: от обывателя на кухне до парламентов разных стран и даже Совета объединенной Европы. Но, что удивительно, далеко не все спорящие имеют четкое представление, как осуществляется процедура клонирования, в чем ее суть, к чему она может привести. Зачастую преобладают эмоции и обычная отрицательная реакция на все новое. Так, в свое время отрицали пересадку органов, затем боролись с искусственным оплодотворением в пробирке, пренатальной диагностикой и др. Теперь все это осталось позади. Общество приняло многое из того, что разработали ученые. В мире ежедневно пересаживается людям сотни чужих органов, ежедневно рождаются тысячи людей, зачатых в пробирках. И никакой трагедии для человечества нет. Теперь главный раздражитель — клонирование людей.
Имеются мнения, что придумал метод клонирования еще в 40-х годах советский биолог Георгий Викторович Лопашев. А в 50-е годы американские эмбриологи Брикс и Кинг «переоткрыли» этот метод. В конце 60-х гг. английский биолог Д. Гёрдон опубликовал работу, в которой описал опыты с ядрами, выделенными из клеток кишечного эпителия, почек, кожи и легкого уже взрослых шпорцевых лягушек. Сначала он уничтожал ультрафиолетом ядра икринок, а затем подсаживал в них ядра, выделенные из разных клеток головастиков. Работа была очень тонкая и кропотливая, большая часть полученных таким образом икринок погибала, и лишь совсем маленькая их доля (около 2,5%) развивалась в головастиков. Взрослых лягушек получить таким образом не удавалось. Тем не менее, это был определенный успех, и результаты этих опытов Д. Гёрдона уже давно попали во многие учебники и руководства по биологии.
Собственно с тех пор и начались разговоры о клонировании млекопитающих, включая человека. Упрощенная схема этой процедуры приведена на рис. 41. Завершилась вся эта длинная история в 1997 году, когда в лаборатории Вильмата в Шотландии появилась на свет овечка по имени Долли. В этом случае ученые пошли чуть-чуть другим путем: они не трансплантировали ядро, а сливали соматическую и половую клетки.
Рис. 41. Общая схема процедуры клонирования любых животных организмов (включая человека) с помощью пересадки ядер взрослых соматических клеток в женскую половую клетку (яйцеклетку)
Для полной ясности следует отметить что, уже давно точные генетические копии организмов (клоны) получает на своих шести сотках любой огородник, размножая картошку клубнями или смородину отводками. Подавляющее большинство растений способно размножаться вегетативным способом, и ни у кого этот факт не вызывает удивления — он слишком для нас привычен, чтобы стать поводом для сенсаций. Но вот теперь дошла очередь до человека. Ясно, что сегодня клонирование человека вполне осуществимо с помощью имеющихся технологий и, может быть, оно технически не сложнее, чем клонирование какой-нибудь овцы. Но здесь главенствует этический вопрос.
В дальнейшем ситуация будет развиваться непредсказуемо. Однако следует помнить, о чем мы уже говорили раньше, — очень многое в биологии человека зависит от окружающей среды. И это одна из основных причин, почему полное клонирование человека невозможно. Можно создать человека, который будет выглядеть, как ваш близнец. Однако вероятность того, что у него будет такой же характер и такие же интересы, как и у вас, весьма мала. Клоны никогда не будут полностью идентичны своим прародителям.
Даже овца Долли не есть точная копия овцы, клетки которой использовали для ее клонирования, так как она росла и развивалась совсем в другом окружении, в матке другой суррогатной овцы. Любой клонируемый организм не наследует гены митДНК своего «родителя», он будет нести митохондриальный геном того организма, который предоставил для клонирования свою яйцеклетку. Клонированного ребенка, вероятно, можно будет назвать «запоздалым» генетическим близнецом своего «родителя», однако содержащим множество (причем совершенно непредсказуемых) отличий.
Поэтому надежды на то, что с помощью генетической инженерии можно создавать и клонировать людей с определенными свойствами (Гегеля, Моцарта, Шварцнегера или Гитлера) пока явно не оправдываются. А ведь многие сторонники глубоко внутри лелеяли надежду чуть ли не на личное бессмертие, на панацею от всех бед и напастей человечества. Кто-то уже собирался нести в лабораторию свои собственные клетки или бережно сохраненные кусочки тканей умерших родственников… Дело дошло до того, что группа американских бизнесменов заявила о своем новом проекте: они собираются клонировать вампира графа Дракулу. Для этого они хотят выкопать останки Влада Дракулы, который жил в 15 веке в Трансильвании. Именно этот человек стал прототипом героя известного романа Брэма Стокера «Дракула». Нет предела человеческим желаниям и мечтам!
Таким образом, самое большое препятствие на пути к клонированию человека — вовсе не техническая подготовленность к эксперименту, а неопределенность результата и недостаточная оценка опасностей, таящихся в этой процедуре. Ясно, что клонирование опасно прежде всего тем, что может привести к определенному обеднению генетического фонда человека, повторяя дефекты генома и не давая при этом ему никаких новых качеств. Много неожиданных проблем может возникнуть с появлением человеческих уродцев как результата манипулирования с клетками эмбрионов, с преждевременным старением клонов, с онкологией, с иммунологией и др. Профессор Жан Доссе, лауреат Нобелевской премии по физиологии и медицине (1980 г.), предупреждает: «В области генетики человека неразумное использование новых технологий может привести к катастрофическим последствиям».
Так что давайте посмотрим на все это в реальной плоскости. Первое, на что хотелось бы обратить внимание, это то, что клонируемый человек, как и любой зачатый естественным путем, сначала должен пройти все стадии нормального эмбрионального развития. В результате через 9 месяцев он появится на свет из утробы женщины, согласившейся принять в себя генетически модифицированную яйцеклетку (суррогатная мать). Потом пройдут долгие годы, пока новорожденный станет тем, что мы от него ждем. Если мы, например, пытаемся клонировать какую-то выдающеюся личность, то придется ждать очень долго, пока станет ясно, что результат достигнут или не реализовался. В реальности — скорее всего нет. Дело в том, что «близнец» в общем-то скорее всего вырастет внешне очень похожим на образец. Но на протяжении многих лет жизни генетической копии не возможно воспроизвести все те условия, которые сопутствовали в течение жизни его образца. На своеобразие психической деятельности человека, по современным данным, геном оказывает воздействие, которое оценивается максимум на 50%. А вот другие 50% зависят от очень многого, но не от генома. Здесь вносят свой вклад и окружение, и воспитание, и образование, и сопутствующие заболевания, и даже просто питание. Мы не зря выше говорили об однояйцовых близнецах — они нам демонстрируют результаты клонирования, которое осуществляет сама природа. Вернитесь к соответствующему разделу этой книге и вспомните о результатах многолетних исследований близнецов в генетике. По словам К. Вентера, можно создать человека, который будет выглядеть как ваш близнец, однако вероятность того, что у него будет такой же характер, такие же способности и такие же интересы, как и у вас, «близка к нулю». Ксерокопировать людей невозможно.
Далее. Никто особо не задумывается над тем, что у новорожденной «копии» с самого рождения не будет родителей в полном смысле этого слова. Точнее, конечно, он будет, но, в отличие от других, только один. Условным «родителем» служит донор клеточного ядра: условный «папа», если родился мальчик, или условная «мама», если родилась девочка. Сегодня клонирование себя могут себе позволить только очень состоятельные люди, которые, как правило, уже прожили свой век. Их генетическая копия с большой вероятностью большую часть жизни проведет без того человека, который решился на свое клонирование. Есть ли уверенность, что эта копия будет благодарной своим создателям, которые не пожалели сотни тысяч долларов на это? Не осудит ли она их, когда подрастет, не начнет ли она из чувства противоречия жить совершенно по другим правилам, нежли те, которыми руководствовалась ее исходная «матрица»? Предположим, родитель был великим спортсменом, а копия оказалась страшно ленивой или склонной к «богемной жизни» или к философствованию. Таков может быть совершенно не прогнозируемый результат «создателя». Поэтому надежды на то, что с помощью современных подходов можно создавать людей с определенными свойствами, пока явно не оправдываются. А ведь некоторые уже надеялись чуть ли не на личное бессмертие.
Не менее важными, а может быть, даже более важными, чем перечисленные выше, являются другие проблемы, связанные с клонированием человека. Технология клонирования отработана пока лишь только на животных (единичные указания на клонирование эмбрионов человека можно не принимать во внимание, и даже если появятся сообщения о клонировании одного-двух людей, это еще не решение вопроса). Дело в том, что даже с животными не все ясно. Не накоплено достаточно данных, чтобы исключить, что клонированные организмы могут иметь такие свойства, которые порой мало совместимы с нормальной жизнью, такие, например, как укороченное время жизни (ускоренное старение), предрасположенность к развитию у них различных патологий, включая нейродегенеративные заболевания, рак и иммунологические растройства.
Известно, что при клонировании животных часто возникают многочисленные уродцы, организмы, несущие различные патологии. Что же будут делать с такими «дефектными» копиями, которые с неизбежностью появятся на свет, особенно на начальных этапах клонирования человека? Задумываются ли об этом те, кто планирует или уже приступил к этому? Все вышесказанное однозначно указывает на то, что сегодня никто не имеет никакого морального права заниматься клонированием людей.
Однако следует понимать, что прогресс в науке продолжается и ничто и никто не может его остановить. И, видимо, не в столь уж отдаленном будущем мы с вами будем свидетелями рождения первого человеческого клона. (В начале 2003 года уже было объявлено, правда, без всяких научных доказательств, о появлении на свет первой клонированной девочки — Евы). Хочется надеяться лишь, что это реально произойдет только после всестороннего изучения возможных негативных последствий такого эксперимента, а не в результате действий какого-нибудь авантюриста, движимого или славой Герострата, или огромными деньгами. В перспективе можно ожидать, что клонирование поможет отдельным семейным парам, в которых кто-нибудь из родителей страдает тяжелыми генетическими болезнями, а особенно если больны оба родителя. Так, если ген, определяющий какую-либо патологию, содержится в хромосомах отца, то при клонировании в яйцеклетку матери можно пересаживать ядро ее собственной соматической клетки, — и тогда появится ребенок, лишенный опасных отцовских генов, который будет копией матери. Если дефектный ген содержится в хромосомах матери, то в ее яйцеклетку можно пересадить ядро соматической клетки отца — появится здоровый ребенок — копия отца.
Тем не менее, думается, что сегодня на повестке дня стоит не клонирование человека как целого организма (репродуктивное клонирование), а клонирование его отдельных клеток. Последняя процедура получила специальное название — терапевтическое клонирование. Суть этого перспективного направления вот в чем. У эмбрионов на ранних стадиях развития имеются уже упоминавшиеся эмбриональные стволовые клетки. Кроме того, практически во всех органах взрослого организма наряду с хорошо дифференцированными клетками, составляющими основную массу этого органа, в очень незначительном количестве присутствуют специальные стволовые клетки. Стволовые клетки в условиях in vitro под «руководством» экспериментатора могут быть превращены в любые другие типы клеток, имеющихся у взрослого организма. Далее они могут быть перенесены в тот или иной пораженный орган и способствовать восстановлению его функций. Являясь собственными клетками организма (т. е. иммунологически идентичными), искусственно перенесенные клетки не будут отторгаться. Теоретически все это относительно просто, но до реальной широкой практики дело пока не дошло.
Ясно, что кроме чисто научных проблем и опасений, существуют и многочисленные морально-этические проблемы, связанные как с геномом человека вообще, так и с искусственными манипуляциями с ним, и с клонированием человека. Теперь и поговорим об этом подробнее.
ЭТИЧЕСКИЕ ПРОБЛЕМЫ (Этика + Генетика = ГенЭтика)
Если существуют два или более способа сделать что-либо, причем использование одного из этих способов ведет к катастрофе, то кто-нибудь изберет именно этот способ.
Закон Мэрфи
То, что полезно по своей природе и сущности, нельзя отвергать из-за какого-то зла, наличествующего в нем побочно.
Ибн-Рушд (Аверроэс)
Успехи, достигнутые в результате успешного осуществления проекта «Генома человека», породили не одни только радужные ожидания, но одновременно и обоснованную большую тревогу как ученых, так и широкой международной общественности. Об этом сейчас много пишут в газетах и солидных научных журналах, проводят дискуссии на радио и телевидении. Какие же высказываются опасения, почему звучат сомнения в важности достижений генетиков в изучении генома человека, какие этические соображения высказываются против искусственных манипуляций с геномом человека? Что же такое «игры с ДНК человека» — путь к «эликсиру жизни» или все же «подарок дьявола» и «мина замедленного действия»? Частично обо всем этом уже говорилось выше. Продолжим этот разговор.
Сначала несколько слов об этике вообще. Этот термин впервые употреблялся Аристотелем (правда, тогда он имел несколько иной смысл, чем сегодня). Сейчас этические нормы иногда формулируют известными словами В. Маяковского «что такое хорошо, а что такое плохо», что понятно даже детям. Мы соблюдаем эти нормы, если поступаем в нашей жизни так, чтобы хорошего было побольше, а плохого — поменьше. Существенно, что этот моральный принцип всегда довлел над наукой и медициной. У человека, в отличие от животных, этика базируется на тех или иных идеологических доктринах. Ранее, и в какой-то мере сейчас, в этом принимала участие этика религиозная. Этическая регламентация медицинской деятельности известна со времен Гиппократа. Когда мы жили по «моральному кодексу строителей коммунизма», то и тогда присутствовала определенная строгая этика, обязательная к исполнению всеми членами общества. Существует также этика, которая устанавливается по взаимной договоренности людей или человеческих общностей: как им вести себя по отношению друг к другу. Она была сформулирована еще в 18-м веке Жан-Жаком Руссо в его трактате «Общественный договор», где расписывалось, как люди договариваются, чтобы друг другу поменьше вредить и побольше оказывать пользы, стараясь при этом обеспечить и себе максимум пользы, но не во вред другим. Все мы живем в едином сообществе, никто не может сказать: остановите землю — я сойду. А коли так, то этические нормы должны быть общими для всего человечества.
Сегодня биоэтику определяют как «свод принципов и норм, действующих на основе традиционных духовных ценностей в области здоровья и здравоохранения и регулирующих в этой сфере взаимоотношения государства с обществом, семьей и личностью, а также взаимоотношения медицинского работника и пациента в связи с медицинским вмешательством». Сохраняет свою актуальность тезис Гиппократа «не вреди», означающий, что этично применять к какому-либо лицу только те воздействия, которые не принесут вреда ему и его потомкам.
По-видимому, впервые по-крупному человечество столкнулось с этической проблемой в науке при создании атомной бомбы. Этот пример, наверное, еще долго будет приводиться как иллюстрация разных возможностей использования одного и того же научного достижения. Организаторы проекта «Геном человека» учли это обстоятельство с самого начала. По их инициативе было развернуто широкое изучение социально-этических проблем, которые могут возникнуть в связи с проникновением научной мысли в сокровеннейшую тайну человека — его генетический аппарат. Биоэтика была подключена ко всем вопросам, которые могли возникнуть в связи с полным секвенированием генома человека. И, что существенно, на это в проекте «Геном человека» были сразу выделены значительные средства.
Еще в 1883 году вездесущим англичанином (антропологом, психологом и основоположником биометрии) Ф. Гальтоном был предложен новый термин «евгеника», которому было дано следующее определение: «Изучение подлежащих общественному контролю влияний, могущих улучшить или ухудшить как физические, так и умственные качества грядущих поколений». Наиболее ярко евгенестические представления начала прошлого века отражены в знаменитом письме Мюллера (см. Приложение 2). Но непредвиденные последствия таких соблазнов тогда пугали многих. Так, эти опасения нашли метафорическое отражение в романе М. Булгакова «Собачье сердце». Профессор Преображенский, создавший Шарикова, горестно восклицает: «…я заботился совсем о другом, об евгенике, об улучшении человеческой породы… Вот, что получается, когда исследователи, вместо того, чтобы идти ощупью и параллельно с природой, форсируют вопрос и приподымают завесу: на, получай Шарикова и ешь его с кашей… Зачем надо искусственно фабриковать Спиноз, когда любая баба может родить его когда угодно».
Но теперь ясно, что евгеника в свое время стала одним из стимулов зарождения и развития генетики человека и ее важной части — медицинской генетики. Поставленные евгеникой цели — освободить геном человека от вредных наследственных мутаций и обогатить его ценными для физического и умственного развития генами — остаются актуальными и сегодня. Однако для этого только теперь наступило время. Сейчас можно провести параллель между ранними евгеническими соблазнами и реальными возможностями манипулировать с генетическим аппаратом человека, появившимися в самом конце предыдущего века.
Между тем до сих пор решение этических проблем, связанных с геномными исследованиями, порой напоминает прогулку по острию ножа. Дело в том, что еще до недавнего времени слова «геном», «гены», «ДНК» вызывали ассоциации лишь с фундаментальными исследованиями заумных «очкариков», ученых-генетиков. Мало кто мог подумать, что все это станет для нас серьезнейшей проблемой, которая будет обсуждаться на уровне президентов и парламентов. Но теперь поняли, что так же, как в свое время при изучении атома, исследования генома человека могут принести как колоссальную пользу, так и огромный вред для человечества. Стало абсолютно очевидным, что молекулярная генетика способна спасти людей от сотен ранее неизлечимых болезней, имеющих наследственную и приобретенную природу. В то же время теперь возникла серьезная проблема — необходимость учитывать предотвращение даже малейшей возможности того, чтобы искусственное вмешательство в геном человека не привело человечество к генетическим «хиросимам» и «чернобылям».
Очевидно, что для лечения человека вполне приемлемы и новые лекарства, разработанные на основе знания о структуре генома, и методы генной терапии на уровне соматических клеток, и современные способы диагностики. Все это не вызывает особых споров. Тем не менее, новое знание и новые возможности породили достаточно большое число новых этических проблем. Остановимся на некоторых из них.
Так, для многих наследственных заболеваний еще нет эффективных способов лечения. Но вот, предположим, врачи диагностировали у человека серьезную патологию, ведущую к смерти, которая может произойти лишь через 20 или даже 40 лет (а может и не произойти). Что делать в этой ситуации? Надо ли или не надо информировать больного человека об этом? Это один из главных вопросов, стоящих перед медико-генетическим консультированием уже много лет, но однозначного ответа на который нет и сегодня. Другая проблема, хотя пока еще несколько отдаленная, связана с тем, кто и как может распорядиться информацией о геноме конкретного человека и не существует ли потенциальной опасности распространения персональной информации без разрешения тех, кого она касается. Дело со всей очевидностью идет к тому, что вскоре каждый из нас будет иметь свой личный генетический паспорт. Некоторые фирмы уже дают рекламу на изготовления таких паспортов (правда, цена их сегодня пока еще очень велика — около 800 тыс. долларов за один паспорт). Это, конечно, чрезвычайно важно во многих случаях для сохранения нашего здоровья и порой даже для предотвращения преждевременной смерти. Но с появлением генетического паспорта можно ожидать и возникновения новых морально-этических проблем. У всех нас есть какие-то не очень хорошие гены. Так, считается, что каждый человек несет от 5 до 10 «плохих» генов, которые могут при определенных обстоятельствах привести к появлению некоторых заболеваний у нас самих или у наших детей — если именно эти гены достанутся им. Генетик М. Кабак из Калифорнийского университета утверждает: «Мы все — мутанты, все генетически дефектны». Самому человеку и лечащему его врачу полезно было бы об этом знать, чтобы быть предупрежденным об опасности того или иного заболевания и определить выбор наиболее радикального способа профилактики и лечения. Но очевидно, что эта информация может иметь и немалую коммерческую ценность, которая может быть использована против самого человека. В этой связи и возникает вопрос: кто может иметь доступ к этой информации? Как она должна храниться и кем использоваться? Подобная информация в нашем несовершенном обществе сможет стать предметом торговли и шантажа. Понятно, что, например, различные страховые компании будут стремиться любыми способами узнать о генетической предрасположенности клиента к каким-либо болезням, а после получения соответствующей информации станут требовать от него повышенной платы за страховку. Безусловно, генетический паспорт заинтересует и работодателей. Они, учитывая генетические данные, могут отказывать в найме на работу, поскольку при некой известной генетической конституции определенная работа теоретически может повысить риск возникновения того или иного заболевания. Приведем в качестве примера историю с бывшим Президентом США Рональдом Рейганом. Его президентство оставило полезный вклад в экономику страны (вспомним термин рейгономика). Но после выхода на пенсию Рейган был поражен тяжелой формой болезни Альцгеймера. Оказалось, что у него и членов его семьи имеется наследственная мутация, которая и привела к развитию этого заболевания. А теперь давайте ответим на вопрос: был бы Р. Рейган выбран Президентом США, если бы в те далекие годы могли диагностировать такую мутацию и эта информация стала бы достоянием широкой американской общественности перед выборами?
Так что высказанные выше опасения совсем не умозрительны и не беспочвенны. Мы уже имеем пример из современной истории, как генетическое тестирование обернулась скорее злом, чем благом. Речь идет о проведенной в начале 70-х годов в США правительственной программе по выявлению носителей мутантного глобинового гена, обуславливающего такое неприятное заболевание, как серповидноклеточная анемия. Мутация, приводящая к этой патологии, распространена в основном в малярийных районах Африки и ряде других жарких стран. Само заболевание связанно с присутствием в эритроцитах ненормального варианта белка гемоглобина, в результате чего эритроциты крови приобретают специфическую «серповидную» форму, а у больного развивается тяжелая анемия, иногда приводящая к смерти. В 1972 году в рамках борьбы с малярией на паспортизацию людей было истрачено свыше 100 млн. долларов. Методика выявления носителей этого гена к тому времени уже была разработана, она оказалась довольно простой, наличие мутантного гена можно было определить с помощью анализа одной капли крови. Программа генетического обследования на выявление носителей гена серповидноклеточной анемии была проведена среди американцев африканского происхождения и поначалу получила бурное общественное одобрение. Однако вскоре после этого начались неожиданные серьезные осложнения. Выяснилось (хотя думать об этом надо было раньше), что общество не знает, как распорядиться результатами этого широкомасштабного обследования. Во-первых, людей, абсолютно здоровых, но несущих ген серповидноклеточной анемии, стали считать больными, а у самих этих людей возник комплекс неполноценности и даже вины. Во-вторых, возникли сложности с медицинскими страховыми компаниями. В-третьих, появились новые формы сегрегации — отказ в приеме на работу на основании геномной диагностики. В частности, авиакомпании перестали принимать к себе носителей мутантного глобинового гена, поскольку, как они посчитали, существует риск обострения заболевания и распада эритроцитов при снижении давления кислорода на большой высоте.
Естественно, не хотелось бы и в третьем тысячелетии вновь наступать на одни и те же грабли. По этой причине, чтобы в будущем избежать негативного развития событий, различные специалисты уже сейчас интенсивно трудятся над выработкой необходимой законодательной базы. В настоящее время, чтобы уберечь человека от дискриминации, удалось выработать ряд этических и правовых норм, которые должны если не предотвратить полностью, то, по крайней мере, существенно нейтрализовать негативные последствия. Основная из них заключается в том, что информация о генах определенного индивидуума не может быть передана третьим лицам без его ведома. Даже если кто-то захочет использовать ее для исследовательских целей, он прежде должен будет проинформировать об этом конкретного человека и получить его согласие. В частности, Конгресс США уже принял ряд законов, запрещающих возможные злоупотребления в этой области. Конфиденциальность наследственной информации каждого человека считается одним из неотъемлемых прав личности.
Однако в некоторых конкретных обстоятельствах эти на первый взгляд совершенно разумные нормы также могут породить серьезные конфликты интересов. Приведем такой пример. У некого индивидуума выявлено определенное отклонение в генетическом аппарате, которое в скором времени может привести к развитию у него очень серьезного заболевания. Эта информация может быть в буквальном смысле жизненно важной для его близких и родственников, в частности при вступлении такого индивидуума в брак. Должны ли родные и близкие люди открывать друг другу сведения, содержащиеся в своем генетическом паспорте? Здесь сколько «за», столько и «против». К сожалению, до сих пор все эти проблемы пока не решены.
Или другой интересный пример. В 2002 году появилось сообщение об идентификации «гена преступности». 85% процентов мальчиков, у которых один из генов содержал определенную мутацию, оказывались склонными к антиобщественному поведению во взрослой жизни. В этой связи британский Совет по биоэтике пришел к выводу, что судьи должны иметь возможность изучать генетическую структуру обвиняемых перед вынесением приговора, а генетическая предрасположенность человека к антиобщественному поведению должна быть для суда таким же фактором, как психиатрическое освидетельствование. По мнению экспертов Совета, выявление генетической предрасположенности к преступлению даст возможность назначить человеку определенное лечение, вместо того, чтобы отправить его на многие годы в тюремную камеру. Но это мнение не бесспорно. Ясно, что генетика не должна стать поводом для безоговорочного оправдания подсудимых.
Остается сложной и проблема собственности на информацию о геноме человека вообще, о патентовании вновь выявляемых генов человека. По этому вопросу уже прошли жаркие дебаты между учеными, финансируемыми частным капиталом и поддерживаемыми государством, и даже между разными странами (в частности, между США и Европой, между Европейским Союзом и Советом Европы). Одни настаивают: генетическая информация, коль скоро она была кем-то расшифрована, то есть открыта вновь, должна быть собственностью осуществившего эту расшифровку исследователя и защищаться патентом. Каждый, кто захочет воспользоваться ею, обязан за это платить; патентная защита интеллектуального вклада тех, кто расшифровывает гены, станет мощным стимулом для дальнейшего прогресса исследований. Однако их оппоненты настаивают на другом: генетическая информация создана самой природой, и ее собственником скорее следует считать того, в чьих генах она содержалась, чем того, кто ее «прочел»; патентование генов ограничит доступ ученых к информации и тем самым не ускорит, а затормозит исследования. Пока и по этой проблеме общепризнанной точки зрения нет.
Особняком стоит вопрос о клонировании человека. Выше мы подробно рассматривали эту проблему. Здесь кратко остановимся только на некоторых связанных с ней морально-этических аспектах. Уже говорилось о том, что существующий на сегодняшний день метод пока еще нельзя считать абсолютно безопасным. Многое еще остается неясным. Так, нет ответов на вопросы, как скажется на клонах влияние так называемого генетического импринтинга (разного проявления у потомков одних и тех же генов, но произошедших от отца или матери), как будет происходить старение такого организма и его клеток, как отразятся на клонах возможные мутации в ядрах клеток-доноров, как клонирование скажется на здоровье, на склонности к различным заболеваниям, в частности, к раку. Тем не менее, целый ряд ученых заявляли и заявляют, что они готовы или даже уже приступили к клонированию людей. Такие безответственные заявления вызвали массу протестов в обществе. Срочно были приняты меры на государственных уровнях. Клонирование человека было запрещено во всех цивилизованных странах. Сейчас в Японии экспериментаторам за эксперименты по клонированию человека и создание химероподобных существ (скрещивание генов человека с животными) грозит от 3 до 7 лет тюрьмы. В Германии наказание — 5 лет, во Франции — до 20. В США нарушителю моратория обеспечены 10 лет заключения и миллион долларов штрафа. В России в 2002 году также введен мораторий на 5 лет на клонирование людей.
Однако надо понимать, что все это не может остановить начавшийся процесс. Всегда найдутся (например, в странах второго мира, или на необитаемом острове, или, в конце концов, на корабле в мировом океане) авантюристы, которые за большие деньги клонируют все-таки определенного богатого и очень амбициозного человека, или его погибшего, но сильно любимого ребенка, или какую-нибудь выдающуюся личность прошлого. И это, по-видимому, неизбежно. Несмотря на все возражения, протесты и запреты клонирование человека произойдет в самое ближайшее время. Безусловно, уже мы с вами будем свидетелями этого события и невольными наблюдателями за реальными его последствиями.
Сторонники клонирования часто задают саркастический вопрос: если запрещаем клонирование людей, может быть, одновременно нужно запретить и рождение естественных близнецов? Но это, конечно же, не вопрос, а попытка подмены понятий. Более существенен другой вопрос: являются ли все клетки человека его неотъемлемой собственностью, с которой он может делать что угодно, вплоть до выращивания из них собственных копий, а вот другим без его разрешения ничего делать с его клетками не разрешено? Если ответить утвердительно на последний вопрос, то многие люди могли бы подать иски на лаборатории и клиники, где в экспериментах используются различные клетки их самих или клетки их родственников или, наконец, абортивный материал. Один из примеров тому — раковые клетки HeLa, которые были получены из карциномы шейки матки некой Хелены, американки африканского происхождения, скончавшейся в далеких 50-х годах XX в. в США. С тех пор в десятках биологических и медицинских институтов мира проделаны сотни тысяч опытов на этих клетках, что происходило без всякого согласия на то ее самой и ее родственников.
Так как же все-таки можно ответить сегодня на вопрос: следует ли клонировать человека? Конечно, научный прогресс не остановить. Не так давно многих возмущали «дети из пробирки», трансплантация органов, а раньше крайне удивляли самолет, кинематограф, телевидение, лазер и др. Наверное, все равно настанет время, когда, по крайней мере, данные, полученные в области клонирования людей или на основе его принципов, войдут в повседневную жизнь. Хотелось бы только, чтобы общественное мнение базировалось не на поверхностных представлениях о них, а на глубоком знании предмета и было направлено на благо как сегодняшнего человека, так и будущих поколений.
Пока вокруг клонирования и манипуляций с эмбриональными стволовыми клетками человека идут научные дискуссии, в США было принято чисто фарисейское решение. Президент разрешил финансирование из бюджета США исследований на основе использования уже существующих стволовых клеточных линий человека, поскольку эмбрионы, из которых были созданы существующие стволовые клеточные линии, уже уничтожены и не способны далее развиваться в человеческие существа и, следовательно, грех человекоубийства не будет довлеть над исследователями. Европа в целом пока не поддержала это начинание, хотя нельзя думать, что это навсегда.
Считается, что проблема клонирования, хотя и привлекает к себе большое внимание, в реальности пока не входит даже в сотню наиболее важных проблем человечества. Значительно более актуальна борьба с дефектной наследственностью. Как уже говорилось выше, уже найдены гены, связанные со множеством патологий человека, с помощью современных генно-инженерных методов и генной терапии уже возможно лечение ряда наследственных и приобретенных заболеваний. С точки зрения медицинской, да и просто человеческой этики, нельзя оставить без помощи медицины страдающего, особенно когда для этого имеются соответствующие подходы и средства. Но все эти используемые в настоящее время подходы, средства и методы направлены на соматические клетки нашего тела. Половые (зародышевые) клетки (сперматозоиды и яйцеклетки) по современным этическим и правовым нормам не могут быть объектом вмешательства, т. к. воздействие на зародышевые клетки в том или ином виде может сказываться на потомстве. Последствия таких вмешательств могут обнаружиться лишь в череде поколений, и есть риск того, что эти последствия окажутся чрезвычайно опасными. Таким образом, современная генная терапия направлена только на соматические клетки. Однако, что чрезвычайно важно, при этом в половых клетках «излеченных» пациентов дефектные гены сохраняются! В результате спасения таких индивидуумов от судьбы, уготованной им естественным отбором, т. е. в конечном итоге от смерти, они в дальнейшем смогут передавать аномальные гены своему потомству.
Это неминуемо будет приводить к прогрессирующему ухудшению человеческого генофонда. Вот еще одна этическая дилемма, которая стоит перед человечеством.
Некоторые ученые полагают, что ее решение заключается в поиске подходов к безопасному «лечению» половых клеток человека. Но здесь мы вновь оказываемся в очень спорной и наиболее пугающей области возможного применения тех знаний, которыми вооружает нас современная генетика. Речь идет о таком вмешательстве в геном, которое направлено на то, что когда-то именовалось улучшением человеческой породы, или евгеникой.
В настоящее время, благодаря успешной реализации проекта «Геном человека», произошло определенное оживление интереса к евгеническим идеям. Все чаще и чаще евгенические подходы и принципы рассматриваются как возможный выход из надвигающейся на нас генетической катастрофы — безнадежного ухудшения качества «генетического материала» — генофонда человека. Однако в отличие от своих предшественников нынешние приверженцы евгеники больше уповают на совершенствование отдельных индивидов, чем больших социальных групп.
Колоссальные достижения в познании структуры генетического аппарата человека и, в не столь уж далекой перспективе, возникновение подходов к направленному его изменению с новой остротой ставят вечные вопросы: что же такое человек, насколько пластична или, напротив, консервативна его генетическая природа, что можно и что нельзя насильственно менять в нем, какова биологическая опасность искусственных геномных манипуляций для вида гомо сапиенс, не станет ли теперь реальностью целенаправленное изменение человеческой расы, о котором мечтали евгеники? Пока реальных предпосылок к этому не видно, хотя теоретически такую возможность исключить нельзя. При решении подобных вопросов нам приходится полагаться не только на знания, которые открывает наука, но и на то, что мы, люди, считаем морально дозволенным в воздействии на человеческий геном. Думается, что человечеству хватит мудрости и здравого смысла, чтобы обратить в свою пользу результаты, достигнутые в изучении генома человека.
Один из главных действующих лиц в геномном проекте Крег Вентер считает, что для полного определения функций всех генов может потребоваться около ста лет, а до тех пор о заметных направленных изменениях в геноме говорить не приходится. Но такая оценка не может успокаивать, т. к. ненаправленные изменения, в том числе и вредные, теоретически и практически могут быть осуществлены уже сейчас.
Существуют также опасения относительно того, не могут ли новые данные о геноме человека быть использованы для создания биологического оружия нового типа, например, опасного только для некоторых популяций или рас? Вопрос вполне правомерный, и пока на него нет однозначного ответа. Вместе с тем, имеющиеся данные о различиях в структуре геномов разных популяций людей указывают пока на отсутствие возможности появления такого оружия. Ряд ученых считает, что гораздо большую опасность для человечества могут представлять данные по определению структур ДНКовых текстов многочисленных болезнетворных бактерий и вирусов. Тем не менее, в этих случаях подобный вопрос почему-то практически не возникает.
В нашей стране все перечисленные выше проблемы имеют свою специфику. У нас генетика долгое время пробивала себе законное место под солнцем. Да и вообще вся естественная наука, не связанная напрямую с военной проблематикой, большую часть XX века не была у нас в почете. Однако времена постепенно меняются и генетику не только признали как науку, но и стали ориентироваться на ее достижения.
Сегодня сохраняется насущная потребность в разработке международно признанных этических норм, которые бы регулировали искусственное вмешательство в геном человека. Сейчас этим активно занимаются такие международные организации, как Совет Европы, ЮНЕСКО, ВОЗ. Попыткой установить эти нормы служит Всемирная декларация «О геноме человека и правах человека», разработанная Международным комитетом ЮНЕСКО по биоэтике и принятая Генеральной конференцией ЮНЕСКО в 1997году. Полагаю, что читатель заинтересуется важнейшими положениями этого международного документа (полный текст см. в Приложении 3).
Из Всемирной декларации о геноме человека и правах человека
Исследования генома человека открывают широкие перспективы в области улучшения здоровья и процветания каждого человека и всего человечества в целом.
Применение генетических исследований должно, однако, регулироваться надлежащим образом для защиты от евгенической практики, которая идет вразрез с человеческим достоинством и правами человека.
Результаты исследования генома человека ни в коем случае не должны быть использованы в военных или агрессивных целях…
Геном человека есть составная часть общего достояния человечества.
Геном каждого человека представляет его особую генетическую индивидуальность.
Личность человека не может быть сведена только лишь к его генетическим характеристикам. Каждый имеет право на уважение его прав и достоинств вне зависимости от этих характеристик…
В области биологических и генетических исследований защита личности будет гарантировать неприкосновенность человечества как вида, а также уважение достоинства, свободы и прав каждого из его членов.
Каждый имеет право извлекать пользу из достижений биологии и генетики…
Никакие достижения в области биологии и генетики не должны превалировать над уважением человеческого достоинства и прав человека…
Никакое воздействие на геном человека (в научных ли, терапевтических или диагностических целях) не может быть предпринято без строгой предварительной оценки возможных последствий, а также без предварительного свободного согласия заинтересованного лица…
Никто не может быть подвергнут дискриминации на основании генетических характеристик…
Генетические данные, связанные с конкретным человеком, хранящиеся или обрабатывающиеся в исследовательских или любых других целях, должны быть защищены от третьих лиц.
Каждый человек имеет право на справедливую компенсацию ущерба, явившегося прямым результатом воздействия на его геном.
Государства обеспечивают интеллектуальные и материальные условия, благоприятствующие исследованию генома человека настолько, насколько это исследование способствует продвижению в познании, облегчению страданий, улучшению здоровья и процветанию человека и человечества в целом.
Исследования в биологии и генетике влекут за собой особую ответственность, требуют от ученых тщательности, осторожности и интеллектуальной честности.
Государства должны гарантировать действенную помощь гражданам, семьям и группам населения, нетрудоспособным или подверженным болезням из-за аномалий генетического характера.
ПЕРСПЕКТИВЫ И ПРОГНОЗЫ
Мы не можем вырвать ни одной страницы из нашей жизни, хотя легко можем бросить в огонь саму книгу.
Ж. Санд
Давно уже существовало мнение, что XXI век станет веком биологии. Сегодня по сути дела сбывается предсказание великого физика современности Нильса Бора, который в 50-х годах прошлого века неоднократно заявлял, что в ближайшем будущем наиболее интенсивное проникновение в тайны природы станет прерогативой не физики, а именно биологии. Среди наук, занимающихся биологическими проблемами, наиболее продуктивной оказывается молекулярная генетика.
На рубеже тысячелетий, на основе успехов по определению структуры генома человека и многих других организмов, возникло совершенно новое направление молекулярной генетики — геномика, изучающая не отдельные гены, а целые геномы, их функциональную значимость как единого целого. Выше мы уже ознакомились с тем, как геномика охватила многие сферы деятельности человека, она уже вторглась в медицину, этнографию, лингвистику, антропологию и другие области гуманитарного знания. Появились специальные ответвления: медицинская геномика, этногеномика, палеогеномика, геноинформатика, генотоксикология и др. В последние годы из геномики выросло еще одно важное направление — протеомика, которая занялась по сути дела инвентаризацией всех белков клетки, анализом их функции и взаимодействия друг с другом. Ясно, что задачи, стоящие перед протеомикой, на несколько порядков сложнее, чем у структурной геномики.
Сугубо научная, хотя и имеющая большой выход в практику, задача — определение структуры генома человека — приобрела теперь яркую мировоззренческую окраску. Уже давно многие генетики считали, что «гены решают все», а человек пусть очень сложная, но всего лишь машина; у других эта точка зрения вызывала субъективный внутренний протест.
Если в человеке все запрограммировано генетически, то, подправив генетическую программу, можно будет выводить людей с любыми заданными свойствами. Неужели кто-то (и.о. Господа Бога на земле?) может по своему разумению использовать эту информацию и создавать, например, идеального инженера, идеального фермера или идеального солдата? Но на другой чаше весов было понимание того, что прогресс науки остановить нельзя, на базе нового знания можно избавить человечество от наследственных заболеваний, которых известно уже около четырех тысяч, найти принципиально новые способы лечения многочисленных приобретенных заболеваний, продлить жизнь человека и многое другое. И в этой непростой ситуации ведущие государства мира в лице своих правительств сделали выбор — приняли решение поддержать ученых, берущихся осуществить грандиозный по масштабам труд по расшифровке генома человека. В результате этого проблема определения структуры генома человека была практически решена. Но теперь предстоит сделать новый более грандиозный шаг — превратить полученную огромную и дорогостоящую информацию в реально действующий в пользу человечества механизм.
Геномика с самого начала была направлена не только на теоретические изыскания, но, главным образом, на практическое использование этих достижений на благо человека. Собственно, это и предполагали организаторы программы «Геном человека», когда затевали свой беспрецедентный по земным масштабам проект.
В самом начале работ по этой программе существовали опасения, что ее реализация приведет к «индустриализация» биологии, к утрате ее творческого потенциала. Однако теперь уже ясно, что огромная творческая работа исследователей по созданию сложнейшей технологии для массированного секвенирования генома человека имеет универсальное значение, ее идеи и методы применимы для решения большого числа биологических проблем, далеко отстоящих от собственно генома человека. Это, прежде всего, разработка методов создания радиационных гибридов (коллекций клеток, в которых удалены разные небольшие фрагменты хромосом), конструирование новых векторных систем (искусственные дрожжевые хромосомы, бактериальные и фаговые векторы, позволяющие размножить огромные по размерам фрагменты ДНК человека), появление принципиально новых компьютерных программ и многое др. Вновь созданная приборная база и методология теперь успешно применяется к любым геномам, от вирусов и бактерий до сельскохозяйственных растений и животных.
Следует также иметь в виду, что когда мы изучаем геном человека, то фактически при этом мы одновременно познаем весь живой мир. Геном человека устроен в целом существенно сложнее, чем геномы многих животных и растений. Поэтому, когда мы узнаем устройство сложного генома, нам будет значительно легче перейти к изучению более простых геномов. А это уже сулит революцию в таких областях, как ветеринария, селекция растений и животных. Ясно, что когда у нас будет каталог всех генов человека, то по аналогии находить гены животных и растений будет намного проще.
Геном человека — неиссякаемый родник для многих поколений исследователей. У специалистов захватывает дух от масштаба и потенциального значения результатов, ожидаемых на основе развития геномики. Что можно ожидать от геномных исследований в ближайшее будущее? Вот как сформулировал прогноз на ближайшие 40 лет Ф. Коллинз, один из руководителей программы «Геном человека» (США).
2010 год
– Генетическое тестирование, профилактические меры, снижающие риск заболеваний, и генная терапия до 25 наследственных заболеваний. Медсестры начинают выполнять медико-генетические процедуры.
– Широко доступна преимплантационная диагностика, яростно обсуждаются ограничения в применении данного метода.
– В США приняты законы для предотвращения генетической дискриминации и соблюдения конфиденциальности.
– Не всем доступны практические приложения геномики, особенно в развивающихся странах.
2020 год
– На рынке появляются лекарства от диабета, гипертонии и других заболеваний, разработанные на основе геномной информации.
– Терапия рака, прицельно направленная на свойства раковых клеток.
– Фармакогеномика становится общепринятым подходом для создания многих лекарств. Изменение способа диагностики психических заболеваний, появление новых способов их лечения, изменение отношения общества к таким заболеваниям.
– Демонстрация безопасности генотерапии на уровне зародышевых клеток при помощи технологии гомологичной рекомбинации.
2030 год
– Определение последовательности нуклеотидов всего генома отдельного индивида станет обычной процедурой, стоимость которой не будет превышать 1000 $.
– Каталогизированы гены, участвующие в процессе старения.
– Проводятся клинические испытания по увеличению максимальной продолжительности жизни человека.
– Лабораторные эксперименты на человеческих клетках заменены экспериментами на компьютерных моделях.
– Активизируются массовые движения противников передовых технологий в США и других странах.
2040 год
– Все общепринятые меры здравоохранения основаны на геномике.
– Определяется предрасположенность к большинству заболеваний (при/до рождения).
– Доступна эффективная профилактическая медицина с учетом особенностей индивида. Болезни детектируются на ранних стадиях путем молекулярного мониторинга.
– Для большинства заболеваний доступна генная терапия.
– Замена лекарств продуктами генов, вырабатываемыми организмом при ответе на терапию. Средняя продолжительность жизни достигнет 90 лет благодаря социоэкономическим мерам. Проходят серьезные дебаты о возможности человека контролировать собственную эволюцию.
– Неравенство в мире сохраняется, создавая напряженность на международном уровне.
Жизнь, безусловно, может внести существенные коррективы в эти грандиозные прогнозы. Но в целом приведенные выше прогнозы, безусловно, будут реализованы, хотя, вероятно, с неким сдвигом в годах.
ЭПИЛОГ
Пока в России в последнее десятилетие прошлого века все «перестраивали» и «переосмысливали», низвергали «идолов» и создавали «калифов на час», пересматривали свою историю, слушали «советы» кашпировских и чумаков, ломали промышленность и уничтожали науку, весь цивилизованный мир продолжал в это самое время двигаться вперед. Мы отрицали истины, а другие постигали их. Можно еще два тысячелетия выяснять вопрос, есть ли Бог или его нет, а вот отражающие близкую к абсолютной истину данные о том, как устроен наш геном, благодаря целенаправленным усилиям ученых многих стран (наше участие, к сожалению, было минимальным) удалось получить всего лишь чуть более чем за 10 лет. В результате этих усилий в начале XXI века все мы являемся свидетелями начального этапа глобальной генетической революции.
Происходящие изменения в мировой науке столь фундаментальны и многочисленны, что порой трудны для полного понимания и осознания даже самими учеными. Еще когда программа «Геном человека» только начиналась, многим было очевидно, что одно секвенирование ДНК не может решить все проблемы человека, но то, что оно, бесспорно, станет краеугольным камнем в разрешении многих проблем человечества, практически ни у кого не вызывало сомнения ни тогда, ни сейчас. Было ясно также, что это скажется на прогрессе не только молекулярной генетики, но и всей биологии в целом, а также на множестве других наук. Так оно в конечном итоге и оказалось.
Программа «Геном человека» по сути дела стала мощным «локомотивом», к которому оказались прицепленными еще сотни разных «вагонов». Главные из них — геномы многих не изученных ранее организмов. В конце 2002 года сообщено о завершении секвенирования генома мыши. Сейчас на очереди секвенирования стоят уже геномы собаки, коровы, пчелы и других важных и полезных животных организмов. Дошло дело и до растений. Уже определена полная последовательность нуклеотидов генома риса. Технология секвенирования теперь настолько усовершенствована, что здесь не должно быть никаких особых проблем. В конечном итоге все это сулит нам огромные возможности, которые в полной мере даже трудно сегодня представить.
Другие «вагоны» — это созданные вновь современные технологии, прогресс в смежных дисциплинах, появление новых научных направлений (геномика, протеомика, транскриптомика) и многое другое. Проникновение в тайны, хранящиеся в геноме, уже началось, но происходит оно медленно, намного медленнее, чем нам хотелось бы сегодня. Однако только на этой основе могут появиться в будущем новые реальные и эффективные средства, которые улучшат качество нашей жизни, укрепят наше здоровье и расширят границы долгой полноценной творческой жизни человека.
Все это можно сравнить с феноменом, возникшим во время правления президента Р. Рейгана, когда он сильно увеличил военный бюджет США на пресловутую программу СОИ. Несмотря на то, что все цели программы СОИ заведомо не могли быть решены, в нее были вложены огромные средства. И это привело к экономическому «чуду» в США, плодами которого пользовались еще целое десятилетие. Был ликвидирован назревавший экономический кризис, достигнут огромный прогресс в различных технологиях. Результаты этого способствовали развитию многих других, не связанных с военными целями областей промышленности и науки. И когда некоторые скептики говорят: «Почему так много денег вкладывают в изучение человеческого генома?», они не учитывают того, что новая информация и новые технологии уже широко используются не только молекулярными генетиками, занимающимися человеком, но и медиками, этнографами, палеонтологами, селекционерами, ветеринарами, токсикологами, многими другими исследователями живой природы. Все было сделано человеком на пользу человека и ради человека. Хочется надеяться, что читатель хотя бы частично сможет все это понять и в достаточной мере оценить.
Существует предание, что древнегреческий философ Платон две с половиной тысячи лет назад охарактеризовал человека как «двуногое без перьев». Тогда его современник Диоген взял да и изготовил наглядное пособие — ощипанного петуха, чем пристыдил Платона. Много веков спустя герой «Записок из подполья» Ф. Достоевского делает сходное (возможно, вычитанное у Платона), но вроде бы более глубокое философское заключение: «... лучшее определение человека — это: существо на двух ногах и неблагодарное». Правда, и для этого определения есть наглядное пособие — тот же петух, но не ощипанный. Еще одна формулировка принадлежит греческому философу Эпиктету: «Что такое человек? — Душонка с телом — ходячий труп». Вот так он всех нас оценил!
Но теперь понятно, что истинное определение человека, его сущности может быть получено только после полного секвенирования его генома, детального выяснения функций всех его элементов и их взаимодействия с различными компонентами клетки, а также сложных взаимосвязей всех клеток организма друг с другом. Огромная роль в этом будет принадлежать функциональной геномике и, в особенности, психогеномике. Мы, к сожалению, не имеем еще полного ответа на многие вопросы. Как говорили древние греки, знания представляют собой радиус круга, а незнание — длину окружности. В отношении человека и его генома радиус существенно вырос после определения структуры ДНК, но вместе с тем еще больше выросла длина окружности — наше незнание о его работе и о функционировании клетки в целом.
Морально-этические проблемы, возникшие в последние годы в связи с бурным развитием молекулярной генетики человека, также весьма сложны. В новом тысячелетии международные юристы должны быть не менее, если не сказать более продуктивными, чем ученые. И способность человечества дать достойный ответ на все возникающие вопросы в соответствующих нормах международного права — задача настолько же сложная, насколько сложна наука, ее поставившая.
Уинстон Черчилль сказал во время Второй мировой войны крылатую фразу: «Это — конец начала». Академик Л. Киселев использовал ее для отражения нынешней ситуации с геномом человека. Сегодня начинается самое главное и, без сомнения, самое интересное — изучение тончайших механизмов работы генома человека, огромного числа генов и разнообразных генных сетей, всех сложных взаимодействий многочисленных соединений и процессов в клетке, что в конечном итоге должно привести к нашему полному пониманию функционирования клетки и сущности живого. Магистральный путь современной молекулярной генетики и геномики — от имеющейся в распоряжении ученых частичной Энциклопедии человека к созданию полноценной Книги жизни.
ПРИЛОЖЕНИЯ
Приложение 1. ВЫДЕРЖКИ ИЗ КНИГИ Р. ДОКИНЗА «ЭГОИСТИЧНЫЙ ГЕН»
Прежде чем начать свое изложение, я хочу вкратце разъяснить, что это за книга, а также предупредить, чего от нее ожидать не следует. Если нам скажут о ком-то, что этот человек прожил долгую и благополучную жизнь среди чикагских гангстеров, мы вправе сделать некоторые предположения о том, какой это человек. Можно предположить, что это человек крутой, всегда готовый пустить в ход оружие и способный обзаводиться преданными друзьями. Нельзя рассчитывать на то, что такие дедукции окажутся безошибочными, но, зная кое-что об условиях, в которых данный человек жил и преуспевал, вы в состоянии вывести некоторые заключения о его характере. Основной тезис этой книги состоит в том, что человек и все другие животные представляют собой машины, создаваемые генами. Подобно удачливым чикагским гангстерам, наши гены сумели выжить в мире, где царит жесточайшая конкуренция. Это дает нам право ожидать наличия у наших генов определенных качеств. Я утверждаю, что преобладающим качеством преуспевающего гена должен быть безжалостный эгоизм. Генный эгоизм обычно дает начало эгоистичности в поведении индивидуума. Однако, как мы увидим в дальнейшем, при некоторых особых обстоятельствах ген способен лучше всего достигать своих собственных эгоистичных целей, поощряя ограниченную форму альтруизма на уровне индивидуальных животных. Слова «особые» и «ограниченная» в последней фразе имеют важное значение. Как бы нам ни хотелось верить, что все обстоит иначе, всеобщая любовь и благополучие вида как целого — концепции в эволюционном плане бессмысленные.
…представление о генетически унаследованных признаках как о чем-то постоянном и незыблемом — это ошибка, кстати, очень распространенная. Наши гены могут приказать нам быть эгоистичными, но мы вовсе не обязаны подчиняться им всю жизнь. Просто научиться альтруизму при этом может оказаться труднее, чем если бы мы были генетически запрограммированы на альтруизм. Человек — единственное живое существо, на которое преобладающее влияние оказывает культура, приобретенная в результате научения и передачи последующим поколениям. По мнению одних, роль культуры столь велика, что гены, эгоистичны они или нет, в сущности не имеют никакого значения для понимания человеческой природы. Другие с ними не согласны. Все зависит от вашей позиции в спорах о том, что определяет человеческие качества — наследственность или среда. Это подводит меня ко второму предупреждению о том, чем не является эта книга: она не выступает в роли защитника той или другой из сторон в споре «наследственность или среда». Конечно, у меня имеется собственное мнение по этому вопросу, но здесь я его выскажу лишь в той мере, в какой оно связано с моими взглядами на культуру, излагаемыми в заключительной главе. Если действительно окажется, что гены не имеют никакого отношения к детерминированию поведения современного человека, если мы в самом деле отличаемся в этом отношении от всех остальных животных, тем не менее остается по крайней мере интересным исследовать правило, исключением из которого мы стали так недавно. А если вид Homo sapiens не столь исключителен, как нам хотелось бы думать, то тем более важно изучить это правило.
В последнее время наблюдается неприятие расизма и патриотизма и тенденция к тому, чтобы объектом наших братских чувств стало все человечество. Такое гуманистическое расширение нашего альтруизма приводит к интересному следствию, которое опять-таки, по-видимому, подкрепляет эволюционную идею «во благо вида». Люди, придерживающиеся либеральных политических взглядов, которые обычно бывают самыми убежденными пропагандистами «видовой этики», теперь нередко выражают величайшее презрение к тем, кто пошел в своем альтруизме чуть дальше, распространив его и на другие виды. Если я скажу, что меня больше интересует защита от истребления крупных китов, чем улучшение жилищных условий людей, я рискую шокировать этим некоторых своих друзей. Убеждение, что представители твоего собственного вида заслуживают особо бережного отношения по сравнению с членами других видов, издавна глубоко укоренилось в человеке. Убить человека в мирное время считается очень серьезным преступлением. Единственное действие, на которое наша культура налагает более суровый запрет, это людоедство (даже в случае поедания трупов). Однако мы с удовольствием поедаем представителей других видов. Многие из нас содрогаются от ужаса, узнав о вынесенных судом смертных приговорах, даже если это касается самых отвратительных преступников; однако мы охотно одобряем уничтожение безо всякого суда довольно мирных животных, причиняющих нам неудобства. Более того, мы убиваем представителей других видов просто для развлечения и времяпрепровождения. Человеческий зародыш, чувства которого находятся на уровне амебы, пользуется значительно большим уважением и правовой защитой, чем взрослый шимпанзе. Между тем шимпанзе чувствует и думает, а возможно — согласно новейшим экспериментальным данным, — способен даже освоить какую-то форму человеческого языка. Но человеческий зародыш относится к нашему собственному виду и на этом основании сразу получает особые привилегии и права.
В какой-то момент (истории) случайно образовалась особенно замечательная молекула. Мы назовем ее Репликатором. Это не обязательно была самая большая или самая сложная из всех существовавших тогда молекул, но она обладала необыкновенным свойством — способностью создавать копии самой себя. Может показаться, что такое событие вряд ли могло произойти. И в самом деле, оно было крайне маловероятным. В масштабах времени, отпущенного каждому человеку, события, вероятность которых так мала, следует считать практически невозможными. Именно поэтому вам никогда не удастся получить большой выигрыш в футбольной лотерее. Но мы, люди, в своих оценках вероятного и невероятного не привыкли оперировать сотнями миллионов лет. Если бы вы заполняли карточки спортлото еженедельно на протяжении ста миллионов лет, вы, по всей вероятности, сорвали бы несколько больших кушей.
На самом деле вообразить молекулу, которая создает собственные копии, вовсе не так трудно, как это кажется сначала, да и возникнуть она должна всего один раз. Представьте себе репликатор как форму для отливки или матрицу; как большую молекулу, состоящую из сложной цепи разного рода более мелких молекул, играющих роль строительных блоков. Эти блоки в изобилии содержались в бульоне, окружавшем репликатор. Допустим теперь, что каждый строительный блок обладал сродством к другим блокам одного с ним рода. В таком случае всякий раз, когда какой-нибудь строительный блок, находившийся в бульоне, оказывался подле той части репликатора, к которому у него было сродство, он там и оставался. Прикрепляющиеся таким образом строительные блоки автоматически располагались в той же последовательности, что и блоки репликатора. Поэтому легко представить себе, что они соединялись друг с другом, образуя стабильную цепь, подобно тому, как это происходило при образовании самого репликатора. Этот процесс может продолжаться в форме постепенного наложения одного слоя на другой. Именно так образуются кристаллы. Но две цепи могут также и разойтись, и в таком случае получатся два репликатора, каждый из которых будет продолжать создавать дальнейшие копии.
Следующее важное звено в наших рассуждениях, на которое делал упор сам Дарвин (хотя он имел в виду растения и животных), это конкуренция. Первичный бульон не мог обеспечить существование бесконечного числа молекул-репликаторов. Не говоря уже о конечных размерах Земли, важную роль должны были играть другие лимитирующие факторы. Описывая репликатор как матрицу или форму для отливки, мы предполагали, что он был погружен в бульон, богатый мелкими строительными блоками, т. е. молекулами, необходимыми для создания копий. Но с возрастанием численности репликаторов эти блоки стали использоваться с такой скоростью, что очень быстро оказались дефицитным и дорогостоящим ресурсом. Репликаторы разных типов или штаммов конкурировали за них.
Для простоты я представляю дело так, будто нынешние гены в общем почти то же самое, что и первые репликаторы, возникшие в первобытном бульоне. На самом деле это может оказаться неверным, хотя в данном случае оно неважно. Исходными репликаторами могли быть молекулы, родственные ДНК, или же молекулы совершенно иного типа. Во втором случае мы могли бы допустить, что на какой-то более поздней стадии ДНК захватила их машины выживания. Если это так, то исходные репликаторы, очевидно, были полностью уничтожены. поскольку в современных машинах выживания никаких следов от них не сохранилось. Продолжая развивать это направление, А. Кэрнз-Смит (A. G. Cairns-Smith) высказал занятное предположение, что наши предки — первые репликаторы — были, возможно, не органическими молекулами, а неорганическими кристаллами-минералами, кусочками глины. ДНК, была ли она узурпатором или нет, сегодня, несомненно, находится у власти, если только, как я предположительно заметил в гл. 11, в настоящее время не начинается новый захват власти.
Первое, что нам следует усвоить относительно современного репликатора, — это то, что он очень общителен. Машина выживания содержит не один, а многие тысячи генов. Построение организма — мероприятие кооперативное, причем внутренние связи в нем так сложны и запутанны, что отделить вклад одного гена от вклада другого почти невозможно (1). Данный ген может оказывать самые разнообразные воздействия на совершенно разные части тела. Данная часть тела может находиться под влиянием многих генов, и эффект каждого отдельного гена зависит от его взаимодействия со многими другими генами. Некоторые гены выступают в роли главных генов, контролирующих действие кластера других генов. Вновь воспользовавшись нашей аналогией, можно сказать, что каждый данный лист чертежей имеет отношение ко многим разным частям здания; и каждый лист приобретает смысл лишь при условии перекрестных ссылок на многие другие листы.
Эта сложная взаимозависимость генов может вызвать резонный вопрос: а надо ли вообще пользоваться словом «ген»? Почему не прибегнуть к какому-нибудь собирательному названию вроде «генного комплекса»? Во многих случаях это действительно было бы удачным решением. Но если подойти к проблеме с другой стороны, то представляется также разумным рассматривать генный комплекс как совокупность дискретных репликаторов или генов. Такой подход связан с явлением пола. При половом размножении гены смешиваются и перетасовываются. Это означает, что каждое отдельное тело представляет собой лишь временное транспортное средство для короткоживущей комбинации генов. Данная комбинация генов, т. е. каждый отдельный индивидуум, может быть короткоживущим, но сами гены потенциально являются долгоживущими. В ряду поколений их пути постоянно пересекаются и расходятся. Отдельный ген можно рассматривать как единицу, продолжающую существовать в ряду многочисленных последовательных индивидуальных тел. Это центральное положение, развиваемое в настоящей главе, и именно с ним некоторые из моих самых уважаемых коллег упрямо отказываются соглашаться, так что читатели должны простить мне, если им покажется, что я разрабатываю его слишком тщательно. Прежде всего я должен вкратце изложить основы явления пола.
Если принять за презумптивную генетическую единицу целую хромосому, то ее жизненный цикл продолжается в течение всего лишь одного поколения. Допустим, что это ваша хромосома 8а, полученная вами от отца. Она образовалась в одном из семенников незадолго до того, как вы были зачаты. Она не существовала никогда прежде за всю мировую историю. Она была создана в процессе перемешивания, происходящего при мейозе, постепенно образуясь из объединяющихся друг с другом участков хромосом от ваших бабки и деда с отцовской стороны. Она попала в один сперматозоид, который стал единственным в своем роде. Этот сперматозоид был одним из нескольких миллионов, образующих мощную армаду малюсеньких сосудов, которые все вместе вплыли в организм вашей матери. Этот сперматозоид — один-единственный (если только вы не один из неидентичных близнецов) из всей флотилии, который проник в одну из яйцеклеток вашей матери и дал вам жизнь. Рассматриваемая нами генетическая единица, ваша хромосома 8а, реплицируется вместе со всем остальным вашим генетическим материалом. Теперь она существует в дуплицированном виде во всех клетках вашего тела. Но когда вы в свою очередь соберетесь стать отцом (или матерью), эта хромосома будет разрушена в процессе образования в вашем организме сперматозоидов (или яйцеклеток). Между этой хромосомой и вашей материнской хромосомой 8б произойдет обмен участками. В каждой половой клетке будет создана новая хромосома 8; она может оказаться «лучше» старой или «хуже», но, если исключить возможность довольно маловероятного совпадения, она будет определенно иной, определенно единственной в своем роде. Продолжительность жизни одной хромосомы — одно поколение.
А какова продолжительность жизни более мелкой генетической единицы, составляющей, например, 1/100 длины хромосомы 8а? Эту единицу вы также получили от своего отца, но весьма вероятно, что ее сборка происходила не в его организме. В соответствии с нашими прежними рассуждениями он с вероятностью 99% получил ее в интактном состоянии от одного из двух своих родителей. Допустим, это была его мать, т. е. ваша бабушка со стороны отца. Опять-таки эта бабушка с вероятностью 99% получила эту хромосому в интактном виде от одного из своих родителей. В конечном счете, проследив родословную маленькой генетической единицы на достаточном числе поколений, мы дойдем до ее первоначального создателя. На какой-то стадии она, вероятно, была создана впервые в некоем семеннике или яичнике одного из ваших предков.
Под словом «ген» я имею в виду генетическую единицу, которая достаточно мала, чтобы сохраняться на протяжении многих поколений и распространяться вокруг в большом числе копий. Это не жесткое определение типа «все или ничего», но определение несколько расплывчатое, подобное таким определениям, как «большой» или «старый». Чем больше вероятность того, что данный участок хромосомы будет разорван при кроссинговере или изменится в результате разного рода мутаций, тем меньше он заслуживает названия гена в том смысле, который я вкладываю в этот термин. По-видимому, под это определение подпадает цистрон, но это могут быть и крупные единицы. Десяток цистронов может располагаться в хромосоме в такой тесной близости, что для наших целей их можно считать одной долгоживущей генетической единицей. Хорошим примером служит кластер, определяющий мимикрию у бабочек.
Когда цистроны покидают одно тело и входят в следующее, используя сперматозоид или яйцеклетку для путешествия в следующее поколение, они, вероятно, могут обнаружить на своем маленьком кораблике своих ближайших соседей по предыдущему путешествию — старых товарищей, вместе с которыми они совершили долгое путешествие, начавшееся в телах очень далеких предков. Соседние цистроны, лежащие в той же хромосоме, образуют тесно сцепленную группу попутчиков, которым лишь в редких случаях не удается «взойти на борт» того же «судна», когда наступает время мейоза.
Строго говоря, эту книгу следовало бы назвать не «Эгоистичный цистрон» и не «Эгоистичная хромосома», а «Немножко эгоистичный большой кусочек хромосомы и даже еще более эгоистичный маленький кусочек хромосомы». Такое название, мягко говоря, малопривлекательно, а поэтому, определив ген как небольшой кусочек хромосомы, потенциально сохраняющийся на протяжении многих поколений, я выбрал название «Эгоистичный ген».
Индивидуумы не вечны, они преходящи. Хромосомы также уходят в небытие, подобно пачке карт, полученных каждым из игроков и отыгранных вскоре после сдачи. Но с самими картами при тасовке ничего не происходит. Карты — это гены. Гены не разрушаются при кроссинговере, они просто меняют партнеров и продолжают двигаться дальше. Конечно, они движутся дальше. Это их работа. Они — репликаторы, а мы — машины, необходимые им для того, чтобы выжить. После того, как мы выполнили свою задачу, нас выбрасывают.
Но гены — выходцы из геологического времени, они здесь навеки.
Гены, подобно алмазам, вечны, но в несколько ином плане, чем алмазы. Отдельный кристалл алмаза постоянно сохраняет неизменную атомную структуру. Молекула ДНК не обладает таким постоянством. Жизнь каждой отдельной физической молекулы ДНК довольно коротка, составляя, возможно, несколько месяцев, и, безусловно, не больше, чем продолжительность жизни человека.
Но молекула ДНК может теоретически продолжать существование в виде копий самой себя в течение 100 млн. лет. Кроме того, подобно древним репликаторам в первичном бульоне, копии какого-то одного гена могут распространиться по всему миру. Разница лишь в том, что все современные варианты аккуратно упакованы в тела машин выживания.
Ген является хорошим кандидатом на роль основной единицы естественного отбора благодаря своему потенциальному бессмертию.
Теперь настало время остановиться на слове «потенциальное». Ген может прожить миллион лет, но многие новые гены не доживают до конца даже в своем первом поколении. Те немногие гены, которым это удается, выживают отчасти просто потому, что им повезло, но главным образом благодаря имеющимся у них необходимым качествам, а это означает, что они способны создавать машины выживания. Они воздействуют на эмбриональное развитие каждого из последовательного ряда тел, в которых они оказываются, в результате чего шансы этого тела на выживание и размножение становятся чуть выше, чем они могли бы быть при воздействии на него конкурентного гена или аллеля. Например, «хороший» ген может обеспечить свое выживание, наделяя последовательные тела, в которых он оказывается, длинными ногами, дающими им возможность убегать от хищников. Это частный, а не универсальный пример. Длинные ноги ведь не всегда дают преимущество. Кроту они осложняли бы жизнь. Не лучше ли нам, не увязая в деталях, подумать о каких-то универсальных качествах, которые мы ожидаем встретить у всех хороших (т. е. долгоживущих) генов? А также о том, каковы те свойства, по которым можно сразу узнать «плохой» недолговечный ген? Таких универсальных свойств может быть несколько, но одно из них особенно тесно связано с темой этой книги: на генном уровне альтруизм — плохая черта, а эгоизм — хорошая.
Это неумолимо вытекает из наших определений альтруизма и эгоизма. Гены непосредственно конкурируют за выживание со своими аллелями, содержащимися в генофонде, поскольку эти аллели стремятся занять их место в хромосомах последующих поколений.
Любой ген, поведение которого направлено на то, чтобы повысить собственные шансы на сохранение в генофонде за счет своих аллелей, будет, по определению, стремиться выжить (в сущности, это тавтология). Ген представляет собой основную единицу эгоизма.
Один гребец в одиночку не может выиграть соревнования по гребле между Оксфордским и Кембриджским университетами. Ему нужны восемь товарищей. Каждый из них — «специалист» в своей области и всегда занимает в лодке определенное место, выполняя функции рулевого, загребных или носового. Гребля — коллективное мероприятие, причем одни спортсмены часто бывают сильнее других. Допустим, что тренер хочет набрать себе команду из числа кандидатов, среди которых есть рулевые, загребные и носовые.
Предположим, что отбор происходит следующим образом. Каждый день тренер создает три новые пробные команды, произвольно перебрасывая кандидатов на каждое место в лодке из одной команды в другую и устраивая затем соревнования между командами. Спустя несколько недель выясняется, что в выигрывающей команде часто участвуют одни и те же отдельные спортсмены. Их берут на заметку как хороших гребцов. Другие кандидаты чаще всего оказываются в проигрывающих командах и от них в конце концов отказываются. Но даже выдающийся гребец может иногда оказаться в проигравшей команде либо вследствие низкого уровня других ее членов, либо просто по невезению, например из-за встречного ветра. Сильные спортсмены лишь в среднем попадают в состав выигрывающей команды.
Гребцы — это гены. Соперники за каждое место в лодке-аллели, способные занимать одно и то же место в хромосоме. Быстрая гребля соответствует способности построить тело, достигающее успеха, т. е. выживающее. Ветер — это внешняя среда. Масса альтернативных кандидатов — генофонд. В той мере, в какой это касается выживания каждого отдельного тела, все его гены находятся в одной и той же лодке. Многие «хорошие» гены попадают в «плохую» компанию, оказавшись в теле, где имеется летальный ген, убивающий это тело еще в детском возрасте. В таком случае хороший ген гибнет вместе с остальными. Но это только одно тело, а ведь копии нашего хорошего гена живут и в других телах, в которых нет летального гена. Многие гены идут на дно, потому что они оказались в данном теле вместе с плохими генами, многие гибнут из-за неприятных событий другого рода, например, потому, что в тело ударила молния. Однако по определению удача и невезенье распределяются случайным образом, и ген, который постоянно проигрывает, не просто неудачник — это плохой ген.
Ген, вызывающий смерть своих обладателей, называют летальным геном. Существуют также полулетальные гены, ослабляющие индивидуум и повышающие вероятность его смерти от других причин. Каждый ген проявляет свой максимальный эффект на какой-то определенной стадии жизни организма, и летальные и полулетальные гены не составляют в этом смысле исключения.
Большинство генов оказывают свое влияние на плод, некоторые другие — в детстве, третьи — в молодом возрасте, четвертые — в среднем и, наконец, некоторые — в старости. (Обратите внимание, что гусеница и бабочка, в которую она превращается, содержат абсолютно одинаковые наборы генов.) Совершенно очевидно, что летальные гены должны удаляться из генофонда. Но столь же очевидно, что летали, действие которых проявляется в позднем возрасте, в генофонде более стабильны, чем летали, действующие на более ранних стадиях. Ген, оказывающий летальный эффект, находясь в старом теле, может тем не менее сохраняться в генофонде, если этот эффект проявляется после того, как данное тело имело возможность принять хоть какое-то участие в размножении. Например, ген, обусловливающий развитие в старом теле злокачественных новообразований, может быть передан многочисленным потомкам, потому что его носители успевают родить детей до развития болезни. В отличие от этого ген, вызывающий злокачественный рост у молодых индивидуумов, не может быть передан большому числу потомков, а ген, проявляющий аналогичное действие у детей, не будет передан никому вообще. Таким образом, согласно этой теории, старческое угасание — просто побочный продукт накопления в генофонде тех действующих на поздних стадиях летальных и полулетальных генов, которым удалось пройти сквозь сети естественного отбора лишь потому, что их эффект проявляется в позднем возрасте.
…как гены делают «предсказания» о будущем. Один из способов, позволяющих генам решать проблему предсказаний при достаточной непредсказуемости условий среды, состоит в том, чтобы снабдить машину выживания способностью к обучению. Соответствующая программа может носить форму следующих инструкций: «Вот перечень ощущений, определяемых как вознаграждение: сладкий вкус во рту, оргазм, комфортная температура, вид улыбающегося ребенка. И вот перечень неприятных ощущений: разного рода боль, тошнота, чувство голода, плачущий ребенок. Если вы совершили какой-то поступок, за которым последовала одна из этих неприятностей, не делайте этого больше, но зато повторяйте все те действия, за которыми последовали вознаграждения». Преимущество такого рода программирования состоит в том, что оно сильно сокращает число подробных правил, которые пришлось бы включать в первоначальную программу; кроме того, оно позволяет справляться с изменениями среды, которые невозможно предсказать во всех подробностях.
Какое все это имеет отношение к альтруизму и эгоизму? Я пытаюсь сформулировать идею, что поведение животного, будь оно альтруистичным или эгоистичным, находится лишь под косвенным, но тем не менее весьма действенным контролем генов. Диктуя, как должны быть построены машины выживания и их нервные системы, гены, в конечном счете, держат в своих руках верховную власть над поведением. Однако в каждый данный момент решения о том, что следует делать дальше, принимает нервная система. Гены вырабатывают политику, а мозг является исполнителем. Но по мере того, как мозг достигает все более высокого уровня развития, он все в большей степени берет на себя принятие решений, используя при этом такие приемы, как обучение и моделирование. Логическим завершением этого направления, не достигнутым ни одним видом, было бы положение, при котором гены дают машине выживания одну всеобъемлющую инструкцию: делай то, что считаешь самым важным для нашего выживания.
Генофонд — это та среда, в которой ген находится долго. «Хорошие» гены отбираются вслепую как гены, выжившие в данном генофонде. Это не теория, это даже не факт, обнаруженный в результате наблюдения; такое утверждение — попросту тавтология. Интересно другое: что делает ген хорошим? В качестве первого приближения я высказал мысль, что ген попадает в категорию хороших, если он способен создавать эффективные машины выживания — тела. Эту идею следует несколько усовершенствовать. Генофонд становится эволюционно стабильным множеством генов, определяемым как генофонд, если в него не может включиться никакой новый ген. Большая часть новых генов, возникающих в результате мутирования, перестановки или иммиграции, быстро устраняется естественным отбором: восстанавливается эволюционно стабильное множество. Время от времени новому гену удается проникнуть в такое множество: ему удается распространиться в генофонде. Существует некий переходный период нестабильности, завершающийся появлением нового эволюционно стабильного множества, — происходит маленькое эволюционное событие. По аналогии со стратегиями агрессии популяция может иметь более одной альтернативной стабильной точки и может перескакивать с одной из них на другую. Прогрессивная эволюция — это, возможно, не столько упорное карабканье вверх, сколько ряд дискретных шагов от одного стабильного плато к другому. Может показаться, что популяция в целом ведет себя как отдельная саморегулирующаяся единица. Но эта иллюзия возникает в результате того, что отбор происходит на уровне единичного гена. Гены отбираются по своим «заслугам». Но заслуги данного гена оцениваются по его поведению на фоне эволюционно стабильного множества, каковым является нынешний генофонд.
Люди, у которых слишком много детей, оказываются в проигрыше не потому, что вся популяция вымирает, а лишь потому, что число выживающих детей у них ниже. Гены, определяющие рождение большого числа детей, просто не передаются следующему поколению в большом количестве, потому что из детей, несущих эти гены, достигают зрелого возраста только немногие. У современного цивилизованного человека величина семьи уже не ограничена тем конечным количеством ресурсов, которое могут обеспечить родители. Если у супружеской пары оказалось больше детей, чем она может прокормить, то на сцену выступает государство, т. е. остальная часть популяции, и заботится о том, чтобы дети выжили и выросли здоровыми и крепкими. В сущности, нет решительно ничего, что мешало бы супружеской паре, не имеющей никаких материальных средств, производить на свет и растить ровно столько детей, сколько женщина в состоянии родить. Однако всеобщее благосостояние — вещь весьма неестественная. В природе у родительских особей, рождающих больше детенышей, чем они могут выкормить, внуков бывает немного, и их гены не передаются последующим поколениям. В альтруистичном сдерживании рождаемости нет нужды, так как в природе не существует всеобщего благосостояния. Любой ген сверхснисходительности быстро настигает кара: детеныши, несущие этот ген, голодают. Поскольку мы, люди, не хотим возвращаться к прежним эгоистичным обычаям, когда дети в слишком больших семьях были обречены на голодную смерть, мы отменили семью в качестве единицы экономической самодостаточности, заменив ее государством. Однако на гарантированную помощь детям посягать нельзя.
В чем, в конечном счете, главная особенность генов? В том, что они являются репликаторами. Считается, что законы физики справедливы во всех доступных наблюдению точках Вселенной. Существуют ли какие-нибудь биологические законы, которые могли бы носить такой же универсальный характер? Когда астронавты отправятся к отдаленном планетам в поисках жизни, они могут встретиться с существами, настолько странными и неземными, что нам трудно их себе представить. Но есть ли что-нибудь, что свойственно всему живому, где бы оно ни находилось и на чем бы ни основывалась его химия? Если бы оказалось, что существуют такие формы жизни, химия которых основана на кремнии, а не на углероде, или использует аммиак, а не воду, если бы обнаружились формы, которые при температуре минус 100°С вскипают и гибнут, или формы, базирующиеся вовсе не на химии, а на каких-то очень хитрых электронных схемах, то мог бы тем не менее существовать некий общий закон, которому подчинялось бы все живое?
Разумеется, я этого не знаю, но если бы мне пришлось держать пари, я бы сделал ставку на один фундаментальный закон — закон о том, что все живое эволюционирует в результате дифференциального выживания реплицирующихся единиц. Случилось так, что реплицирующейся единицей, преобладающей на нашей планете, оказался ген — молекула ДНК. Возможно существование и других таких единиц. Если они существуют, то при наличии некоторых иных условий они неизбежно составляют основу некого эволюционного процесса.
В теории эгоистичного гена имеется некая несообразность, лежащая в самой ее основе: это противоречие между геном и индивидуальным телом как основным носителем жизни. С одной стороны, перед нами встает обманчивая картина независимых ДНК-репликаторов, перескакивающих свободно и беспрепятственно из одного поколения в другое и временно оказывающихся вместе в обреченных на выброс машинах выживания; бессмертные спирали избавляются от бесконечной вереницы смертных тел, медленно шествуя каждая к своей собственной вечности. С другой стороны, глядя на сами индивидуальные тела, мы видим, что каждое из них явно представляет собой некую целостную, интегрированную, невероятно сложную машину с ясно выраженным единством цели. Тело не производит впечатления непрочного и преходящего объединения непримиримых генетических факторов, у которых почти нет времени, чтобы хотя бы познакомиться друг с другом, прежде чем загрузиться в сперматозоид или яйцеклетку для создания следующего колена великой генетической диаспоры. У него есть один целеустремленный мозг, который координирует сообщество, состоящее из двигательных элементов и органов чувств, направляя его на достижение единой цели. Это тело выглядит и ведет себя как нечто вполне целостное и самостоятельное.
Мы можем довести эти рассуждения до логического конца и приложить их к нормальным «собственным» генам. Наши собственные гены кооперируются друг с другом не потому, что это действительно наши собственные гены, но потому, что все они вступают в будущее одним и тем же путем — через сперматозоид или яйцеклетку. Если какие-то гены данного организма, например человека, могли бы найти другие способы распространения, которые бы не зависели от этого обычного пути, связанного со сперматозоидами или яйцеклетками, то они освоили бы их и были бы менее склонны к кооперированию. Причина здесь в том, что при этом им оказались бы выгодными другие сочетания будущих факторов, определяемых другими генами тела.
Фундаментальные единицы естественного отбора, те основные объекты, которым удается или не удается выжить, которые образуют последовательные ряды идентичных копий с возникающими время от времени случайными мутациями, называют репликаторами. Молекулы ДНК — это репликаторы. По причинам, о которых будет сказано ниже, они обычно бывают собраны в большие общины — машины выживания, или «носители». Лучше всего нам известны носители, представляющие собой индивидуальные тела, подобные нашему собственному телу. Таким образом, тело — это не репликатор, это носитель. Я вынужден подчеркивать этот момент, так как здесь существует недопонимание. Носители не реплицируются; их функция состоит в размножении своих репликаторов. Репликаторы не совершают поступков, не воспринимают окружающий мир, не ловят добычу и не убегают от хищников; они создают носителей, которые делают все это. Для многих целей биологам удобнее сосредоточить свое внимание на уровне носителя. Однако для других целей им удобно сосредоточить внимание на уровне репликатора. Ген и индивидуальный организм не соперничают за главную роль в дарвиновском спектакле. Им суждено выступать в разных, взаимно дополняющих и во многом одинаково важных ролях — в роли репликатора и в роли носителя.
Некоторые критики ошибочно считают, что «Эгоистичный ген» проповедует эгоизм как нравственный принцип, которого мы должны придерживаться в жизни! Другие (возможно, потому, что они прочитали только заглавие книги или не пошли дальше первых двух страниц) полагают, что по моему мнению эгоизм и другие скверные черты характера составляют неотъемлемую часть человеческой природы, нравится нам это или нет. В эту ошибку легко впасть, если вы считаете, как, по-видимому, полагают непостижимым образом многие другие люди, что генетическая «детерминированность» дана нам навсегда, что она абсолютна и необратима. На самом же деле гены «детерминируют» поведение лишь в статистическом смысле… Хорошей аналогией этому служит широко распространенное мнение, что красный закат обещает ясную погоду на следующий день. Возможно, что по статистике красный закат действительно предвещает великолепную погоду назавтра, но никто не станет заключать об этом пари на крупную сумму. Мы прекрасно знаем, что на погоду действует множество факторов и притом очень сложными путями. Любое предсказание погоды подвержено ошибкам. Это всего лишь предсказание, опирающееся на статистику. Мы не считаем, что красные закаты бесспорно определяют хорошую погоду назавтра, и точно так же мы не должны считать гены окончательными детерминантами чего бы то ни было. Нет никаких причин, чтобы влияние генов нельзя было повернуть в противоположную сторону с помощью других воздействий.
Приложение 2. ПИСЬМО Г. Г. МЮЛЛЕРА И. СТАЛИНУ
ПИСЬМО Г. Г. МЮЛЛЕРА И. СТАЛИНУ
Товарищу Иосифу СТАЛИНУ,
Секретарю Коммунистической партии СССР,
Кремль, Москва.
Дорогой товарищ Сталин!
В качестве ученого, убежденного в окончательной победе большевизма во всех отраслях человеческой деятельности, я обращаюсь к Вам с вопросом жизненной важности, возникающим в области науки, которой я занимаюсь, — биологии и в частности генетики. Вопрос, несомненно, таков, что он должен быть изложен в первую очередь лично Вам. С одной стороны потому, что он заключает в себе безграничные возможности прогресса. А с другой стороны, для суждения о нем необходима Ваша дальновидность, и Ваше уменье реалистически применять диалектическую мысль.
Дело касается не более не менее, как сознательного контроля над биологической эволюцией человека — то есть контроля человека над наследственным материалом, лежащим в основе жизни в самом человеке. Это тот процесс, которому буржуазное общество было совершенно неспособно смотреть прямо в лицо. Его увертки и извращения в этом вопросе обнаруживаются в пустой болтовне о «евгенике», обычной для буржуазных «демократий», и лживом учении о «расовой чистоте», которое служит национал-социалистам орудием в классовой борьбе. Эти фальшивые положения предлагаются как замена социализма, т. е. как приманка для обмана и раскола рабочих и мелкой буржуазии.
В противовес этим буржуазным извращениям, генетики, принадлежащие к левому крылу, признают, что только социалистическая экономическая система может дать материальную базу и социальные и идеологические условия, необходимые для действительно разумной политики в отношении генетики человека, для политики, которая будет руководить человеческой биологической эволюцией в социально-желательном направлении. Они признают далее, что уже имеются достаточные биологические знания и достаточно разработанная физическая техника для получения весьма значительных результатов в этой области даже на протяжении нашего поколения. И они сознают, что как непосредственные, так и конечные возможности биологического порядка, открывающиеся, таким образом, при социализме, настолько превосходят биологические цели, которыми до сих пор задавались буржуазные теоретики, что последние выглядят совершенно смешными. Подлинная евгеника может быть только продуктом социализма и, подобно успехам в физической технике, явится одним из средств, которое будет использовано социализмом для улучшения жизни.
В этой связи применим революционный завет Маркса: «Философы лишь различным образом объясняли мир, но дело заключается в том, чтобы изменить его». Подобным же образом здесь применимо Ваше собственное недавнее обращение к ученым вообще, которое призывает их прислушаться к голосу практики, опыта и быть готовыми в их свете отбросить традиционные стандарты, установленные устаревшими теоретиками, и поставить каждую отрасль знания в максимально возможной степени на службу обществу.
Биология не нашла доказательств для поддержки старой наивной веры в то, что физическая организация человека или его врожденные свойства ума и темперамента, а также способности достигли какой-либо окончательной стадии, какого-либо свыше установленного предела. Эти свойства еще не приблизились к «совершенству», что бы ни подразумевать под этим словом, или к каким-нибудь физическим границам возможностей.
Человеческая порода не неизменна и не неспособна к улучшению, и это так же справедливо в генетическом, как и в социальном смысле. Не пустая фантазия, что посредством сочетания благоприятного воспитания и общественных и материальных преимуществ, которые может дать социализм, с одной стороны, с научным применением генетики, освобожденной от буржуазных общественных и идеологических оков, с другой стороны — возможно будет в течение лишь нескольких поколений наделить даром даже так называемого «гения» практически каждого отдельного индивидуума — поднять фактически всю массу на уровень, на котором сейчас стоят наши наиболее одаренные индивидуальности, те, которые больше всего способствуют прокладыванию новых путей жизни. И даже это еще только начало.
Если рассматривать вопрос с более далекой перспективой, то это может быть началом биологического прогресса, с небывалой быстротой и верностью цели шагающего от одной вершины к другой. Подобный прогресс явится результатом того, что вместо случайных, колеблющихся и мучительных процессов естественного отбора, господствовавших в отдаленном прошлом, вместо близорукого, неправильного и зачастую губительного вмешательства в природу, осуществлявшегося людьми в досоциалистическую эпоху, будет сознательный социалистический контроль, основанный на разумной теории.
Разрешая стоящую перед нами проблему, мы должны, прежде всего, рассмотреть некоторые известные факты, касающиеся генов. Гены — это ультра-микроскопические частички, которые составляют материальную основу жизни и находятся в половых клетках, да, собственно, и во всех клетках. Все качества живущих существ, включая человека, зависят от двух компонентов: от этих генов, которые содержат и которые наделяют их известными способностями к развитию и реагированию, и от факторов среды, включая воспитание, социальные условия и т. д., которые определяют, как будут развиваться и реализовываться эти возможности их генов.
Таким образом, в то время как различие между цивилизованным человеком и дикарем и, в меньшей степени, ненаследственные различия у рядовых людей зависят от среды, различие между «амавротическим» идиотом и нормальным человеком и, в меньшей степени, у рядовых людей наследственные различия зависят от генов. В причинности всякого данного различия между двумя людьми оба ряда факторов обычно присутствуют в значительной степени, и на практике их нельзя полностью разделить. Но в случае выдающегося лица, так называемого «гения», мы обычно можем с уверенностью заключить, что и среда, и гены оказались в необычной степени благоприятны для высокого развития. Задача создания благоприятной среды, если говорить в самом общем смысле, относится к социальным наукам, к социализму вообще. В области более специальной задачи нахождения специфических условий среды, наиболее благоприятных для генной конституции индивидуального лица, важную функцию должна выполнять генетика, занимающаяся исследованием различий между людьми в отношении генов. Однако еще более важна ее задача дать руководство в деле фактического получения все более подходящих генов для предстоящих поколений.
Наука генетики установила, что есть одно и только одно средство, с помощью которого может быть положено ценное начало в деле обеспечения все более и более благоприятными генами. Оно заключается не в прямом изменении генов, а в создании относительно высокого темпа размножения наиболее ценных генов, которые могут быть найдены повсюду. Ибо нельзя искусственно изменять сами гены в каком-либо особом специальном направлении. Представление о том, что это может быть сделано, является пустой фантазией, вероятно, неосуществимой еще в течение тысячелетий.
Несомненно, обычное влияние среды, которая воздействует на тело или на разум человека — воспитание, лучшее питание и т. д., — хотя оно чрезвычайно важно в своем воздействии на самого индивидуума, но оно все же не приводит к улучшению или к какому-либо определенному изменению самих генов, и, таким образом, поколения, следуя такому «воздействию», начинают с такими же способностями, как и их предки. Гены, конечно, могут быть изменены с помощью некоторых решительных средств, как икс-лучи, но эти изменения происходят случайным образом и в большинстве случаев результаты этого вредны. И так как случайные изменения происходят в некоторой степени также без вмешательства с нашей стороны, то мало смысла в наших попытках производить их, поскольку они имеются в достаточных количествах уже в природных условиях. В результате накопления этих случайных естественных изменений на протяжении тысячелетий, каждый вид организма, включая человека, стал большим резервуаром сотен и даже тысяч различных генов, которые распространены в любом населении. Это приводит к существованию не наследуемых неравенств, которые были, конечно, признаны Марксом.
Не производя дальнейших изменений генов, значительные результаты, следовательно, могут быть получены лишь посредством размножения и собирания лучших из этих рассеянных генов там, где они могут быть найдены, и новым комбинированием их в исключительно высокие группы. Это есть метод селекции, единственный действенный метод биологического прогресса, но это такой метод, который в естественных условиях влечет за собою ту беспощадную борьбу за существование, даже между членами или группами одного и того же вида, от которой мы сейчас успешно избавляемся. Однако, уничтожая этот естественный отбор, мы сейчас в состоянии изменить его гораздо более эффективным сознательным методом, который в то же время избегает нежелательных черт естественного отбора и развивается с гораздо большей быстротой и уверенностью.
Процесс, посредством которого такой биологический прогресс может быть искусственно осуществлен при минимуме вмешательства в личную жизнь, заключается в том, чтобы дать возможность всем людям, желающим принять участие в производстве детей, обладающих наилучшими генетическими свойствами, получить соответственный воспроизводительный материал для использования посредством искусственного обсеменения. Несомненно, к этому методу будут, прежде всего, обращаться женщины, которые по каким-либо причинам вынуждены, в силу обстоятельств, оставаться незамужними. Статистика показывает, что имеются районы со значительным преобладанием женского населения, женщин, которые никогда не имели возможности выйти замуж и, пожалуй, никогда не будут иметь эту возможность.
Отчасти это вызывалось войной и миграцией, а отчасти более высокой «естественной» смертностью мужчин в большинстве общин. И даже в общинах с одинаковым количеством обоих полов многие женщины остаются по тем или иным причинам одинокими. Большинство из этих многих женщин совершенно нормальны в отношении их биологических способностей к материнству и их желанию его. При современных социальных условиях в СССР, где так много делается для помощи материнству и младенчеству, многие из этих женщин, несомненно, будут рады стать матерями, в особенности если они могут это сделать, не вызывая личных сплетен и подозрений, и таким путем, который будет признан совершенно приемлемым в общественном отношении, и если в то же время им будет предоставлена возможность иметь детей с необычайно высоким шансом, что они будут одаренными и желанными. То же будет относиться к многим вдовам и к многим женам бесплодных мужей. В таких случаях могут предоставляться некоторые специальные условия или помощь. Деторождение у таких женщин, посредством этого способа искусственного обсеменения, уже фактически успешно проводилось в течение ряда лет рядом докторов и особенно популярно в Узбекистане, где это практикуется доктором Шороховой.
Следует понять, что процесс искусственного обсеменения сам по себе не влечет никакого полового акта у индивидуума и не мешает осуществлению им нормальных любовных отношений и полового акта, который продолжается как обычно, и может быть связан с таким контролем над деторождением, который желателен. Таким образом, к искусственному обсеменению могут также прибегать брачные пары, желающие иметь детей с необычайно высокими генетическими качествами, причем это не нарушает любовных отношений между партнерами. Отсюда следует ожидать, что, вероятно, будет немало таких пар, которые, усвоив новый и более высокий уровень социальной этики и даже завидуя успеху знакомых старых дев, пожелают таким путем добавить к своей семье «полуприемного» ребенка, обещающего быть исключительно желанным и которым они смогут особенно гордиться.
В этой связи следует заметить, что нет такого естественного закона, который определял бы, чтобы человек инстинктивно хотел и любил именно продукт своей собственной спермы или яйца. Он естественно любит и чувствует своим такого ребенка, с которым он был связан и который зависит от него и его любит, и которому он, в его беспомощности, оказывал заботу и воспитывал. Примитивный человек, который не имел представления о том, что ребенок происходит от его спермы или яйца, и даже не понимал, что дети являются результатом оплодотворения, тем не менее любил своих детей, как это показали современные исследования о некоторых примитивных племенах. На деле зачастую по установленному обычаю, реальный физический отец не играл общественной роли родителя в отношении ребенка и эта роль поручалась какому-нибудь другому мужчине, который действовал в качестве преданного родителя ребенка.
Правда, мы сейчас, укоренившись в традициях буржуазного общества, проникнуты идеей о том, что наш ребенок должен происходить от наших собственных половых клеток. И было бы неразумно оскорблять чувства, которые в результате давно установившихся обычаев стали связаны с этой идеей. Эти чувства должны быть использованы для способствования целям воспроизводства, и никого не надо заставлять действовать в противовес им. Но с постепенным ростом понимания больших социальных возможностей и обязанностей воспроизводства и при отделении воспроизводства от полового акта эти чувства все больше будут заменяться другими, столь же сильными и действенными для дела создания высокого типа семейной жизни.
Эти чувства будут строиться на более высоком и все более сильном основании морали: той морали, в которой индивидуум находит свое величайшее удовлетворение в сознании того, что он способствует оказанию особо ценной услуги обществу. В этом случае содействовать его удовлетворению будет также прямая радость от того, что он воспитывает как своего такого ребенка, который будет особенно замечательным. Таким образом семейная жизнь, продолжаясь, будет развиваться в направлении еще более высокого уровня, чем раньше, и любовь родителей будет еще больше укрепляться их совместной преданностью этой особой вдохновляющей и радостной социальной задаче. Как можно предвидеть, будет сильная тенденция к увеличению деторождаемости в результате дополнительного стимула к воспроизводству, вытекающего из этой возможности иметь детей, которые особо одарены, милы, сильны и желанны во всех отношениях, причем это будет особая честь для родителей. Это увеличение будет иметь место главным образом в тех слоях общества, которые будут обладать более высокоразвитым общественным сознанием, и ввиду этого будут, вероятно, оказывать особо благодеятельное влияние на развивающегося ребенка.
Как показывает генетика, переход к ребенку каких-либо специальных генов, имеющихся у родителей, в каждом данном случае является в известной степени делом случая. Но этот случай ограничен и управляется определенными законами, которые позволяют нам сказать, что ребенок высокоодаренного индивидуума имеет гораздо больше шансов, чем средний ребенок, получить по меньшей мере значительную часть его одаренности.
Это отнюдь не значит, что почти все дети будут выдающимися. Но, группируя вместе все подобные случаи, можно сказать, что если один из родителей имеет исключительно высокую одаренность в отношении каких-либо желательных черт интеллекта, темперамента или физического развития, то его дети будут в среднем занимать промежуточное место в своих наследственных качествах между весьма высоким уровнем родителей и средним общим уровнем. И вполне возможно посредством техники искусственного обсеменения, которое развито в этой стране, использовать для таких целей воспроизводственный материал наиболее трансцендентно высоких личностей, одного из 50 тысяч или одного из 100 тыс., ибо эта техника дает возможность применения этого материала свыше чем в 50 тыс. случаях.
Таким образом, даже если учесть, что дети в среднем стоят только на полпути и весьма различаются ввиду роли случая, все же может быть сделан весьма значительный шаг даже на протяжении одного поколения. И характер этого шага на деле будет становиться очевидным уже через несколько лет, ибо за это время многие дети достаточно разовьются для того, чтобы можно было определенно распознать их как отсталых или развитых. Через 20 лет уже будут весьма знаменательные результаты, способствующие благу народа. И если к этому времени капитализм все еще будет существовать за нашими границами, это биологическое богатство наших молодых кадров, уже и так громадное в результате воздействия общества и среды, но еще дополненное и средствами генетики, не может не создать весьма значительных преимуществ для нас. Делая шаг за шагом на этом пути на протяжении ряда поколений, многие быстро достигнут уровня, который соответствует уровню генетически наиболее ценных индивидуумов современности или который, посредством комбинации различных черт одаренности последних, в общей сумме даже превосходит его. А это в свою очередь даст такого рода генетически сильные средства, которые послужат животворящим элементом, распространяющимся среди всего населения.
Таким образом, наиболее ценные гены сильно размножатся и получат все шансы вступить в еще лучшие комбинации. В то же время население в целом воспроизводится и постепенно получает преимущество поглощать и вступать в сочетание с этими ценными генами. Наследственность обычного человека в последующих поколениях не исчезает, но она получает все более ценные добавления и таким образом имеет возможность находить себе выражение в более полной и широкой жизни. Ибо наследственная конституция данного индивидуума никогда не исследуется [наследуется. — В. Т.] как неделимое целое; но его элементарные части, его гены всегда рассеиваются, смешиваются и сочетаются с другими по мере того, как одно поколение сменяет другое.
Все вышеизложенное представляет собою совершенную антитезу «чистоте расы» и так называемой «евгенике» национал-социалистов и им подобных, которые создают искусственную иерархию рас и классов, клеймя как низшие тех, которых капитализм хочет угнетать, и выступая против них с ножом стерилизации и ограничения. Социальный путь, наоборот, является позитивным и стремится к обильному воспроизводству, которое комбинирует высшие черты одаренности каждой расы, как это происходит в бесклассовом обществе. Он не проводит гнусного различия между человеком и его соседом, потому что генетический материал, который он распространяет для совершенно добровольного использования, получается из столь исключительных источников, что физически все будут рады признать его выдающуюся ценность. Многие матери завтрашнего дня, освобожденные от оков религиозных предрассудков, будут горды смешать свою плазму с плазмой Ленина или Дарвина и дать обществу ребенка, наследующего их биологические качества.
Когда индивидуальные различия носят такой сильный характер, как в данных случаях, то каждый их признает, и действовать на основе этого признания — значит только быть реалистом и объединять нашу теорию с нашей практикой. Особенно важно, чтобы наша практика была правильна в этой области, ибо какой материал столь важен для нас, как наш человеческий материал? И будет признано, что при определении производства детей главный интерес — это интерес самих детей и дальнейшего потомства. Именно о них нужно заботиться, и этому мы должны способствовать в соответствии с нашими возможностями. Таким образом, долг нынешнего поколения позаботиться о том, чтобы последующее поколение обладало наилучшими генетическими качествами, а также наивысшей техникой и социальной структурой, которыми мы можем его наделить.
Рассматривая этот вопрос в его исторической и доисторической перспективе, мы видим, что великий путь биологической эволюции, который через тысячи миллионов лет пронес жизнь от микроба до человека, совершался под влиянием сил случайных вариаций и естественного отбора, как это впервые показал Дарвин и как это гораздо более ясно показала современная генетика. Этот процесс дал великие результаты, но он в своем существе жесток и мучителен, и большинство видов как большинство индивидов приносилось в жертву на алтарь «испытаний и ошибок».
После того, как человек постепенно развился до его нынешней биологической стадии, его разум в сочетании с его социальными чертами дал возможность накопить традиции, сопровождавшиеся социальной эволюцией, которая следовала своим собственным законам. Это были экономические и социальные законы, как показали Маркс и Энгельс. И вот обстановка, созданная таким образом социальной эволюцией человека, породила условия, мешавшие дальнейшему воздействию естественного отбора, т. е. человеку удалось отчасти освободиться от этой жестокой узды. В соответствии с этим его биологическая эволюция стала постепенно приостанавливаться, а в некоторых отношениях, он, пожалуй, стал биологически даже слабее.
Как известно, великое зрелище варварства и последующей цивилизации, всего развития человека в исторические времена в области науки, техники, организации и т. д. представляет собой в своей основе чисто экономический и социальный прогресс, т. е. чисто биологические черты примитивного человека, хотя далеко не «совершенные», были уже такими же, как и биологические черты современного цивилизованного человека.
Ныне при социализме достигнут поворотный пункт в социальной эволюции, когда мы впервые можем действительно взглянуть в будущее и когда мы внезапно увидели новые и бесконечные перспективы социальной эволюции, открывающиеся перед нами, причем даже не необходим дальнейший прогресс в основе биологической природы человека, т. е. в его наследственных чертах, для того, чтобы это развитие вперед продолжалось. Но в то же время уже совершенно необязательно, чтобы развитие человека ограничивалось только каким-либо одним рядом методов. Ибо сейчас впервые становится возможным двигаться одновременно во всех направлениях и даже в биологическом направлении. Это значит, что развитие социальной организации через те законы, которые свойственны экономическим и общественным переменам, привели нас посредством диалектического развития к такой стадии, которая позволяет осуществить новые типы взаимодействия между социальным и биологическим.
На этой стадии становится возможным начать сознательный общественный контроль не только над социальной эволюцией как таковой, но, через нее, также и над биологической эволюцией. Учитывая огромные результаты, достигнутые в прошлом естественной биологической эволюцией, нельзя сомневаться в потенциальной ценности биологических методов прогресса. Но новое биологическое движение вперед должно происходить не так, как этого бы хотели реакционеры — посредством поворота назад колес социальной эволюции и восстановления процессов, подобных естественному отбору, от которых человек с такими муками избавился; оно должно происходить на основе введения новой и более высокой искусственной техники, которая позволит руководить воспроизводством позитивно, человечно и сознательно в интересах общества и самого человека.
Таким образом, вновь возобновится биологическая эволюция, на этот раз на службе социальной эволюции, и она займет свое место наряду с улучшением техники и неодушевленных машин, как одно из средств, применяемых для способствования социальной эволюции.
Таковыми представляются мне вкратце диалектические взгляды на отношения между биологической и социальной эволюцией, и действительная большевистская атака на эту проблему будет основана на полном признании этих отношений. В виду непосредственно предстоящей дискуссии по вопросам, относящимся к генетике, важно, чтобы позиция советской генетики в этом вопросе была быстро выяснена. Она должна иметь свою точку зрения, позитивную большевистскую точку зрения в противовес так называемой «чистоте расы» и извращенным «евгеническим» учениям наци и их союзников, с одной стороны, и теории «лессе-фер» и «не торопитесь» отчаявшихся либералов — с другой стороны. Большинство либералов стоит на позиции практической беспомощности и бессилия в отношении биологической эволюции человека, заявляя, что здесь можно сделать очень мало или ничего. Это соответствует их политическому индивидуализму и безнадежности. И даже некоторые коммунисты, у которых отсутствует достаточная биологическая база или которые находятся под влиянием либеральной мысли, скатились на пессимистическую либеральную позицию.
Позитивный, или как я бы хотел назвать его, «большевистский» взгляд на вышеизложенное, был недавно сформулирован мною в книге «Выход из мрака», в которой развито больше деталей, чем это могло быть сделано выше. Эту точку зрения поддерживает группа некоторых наиболее способных современных генетиков мира. Все они в отличие от генетиков двух других лагерей принадлежат к политической левой и горячо сочувствуют Советскому Союзу. Друзья дела коммунизма в общем объединяются на их стороне, как это показывают благоприятные обзоры об упомянутой книге в таких находящихся в руках коммунистов органах, как «Дейли Воркер» — Нью-Йорк, «Нью-Массес» и «Бук Унион» и даже как в «Нью Рипаблик». Мы надеемся, что Вы примете этот взгляд благожелательно и со временем найдете возможным, по крайней мере в некоторых размерах, подвергнуть его предварительному испытанию на практике. Ибо наша наука генетики с ее огромными возможностями для человека не должна оставаться в стороне, но подобно другим наукам должна динамически и действенно занять свое место в великом центральном потоке социалистического развития. Таким образом Октябрьская революция окажется поворотным пунктом не только в социальной организации, в развитии техники и в завоевании человеком неодушевленной природы, но о ней всегда будут помнить также как о поворотном пункте в долгой истории биологического развития, которое на протяжении миллионов веков развило жизнь так далеко и все же так медленно, с такими потерями, страданиями и ошибочными опытами. Отбросив ложных богов, человек, организованный при социализме, должен взять на себя роль творца, завоевывая с большевистским энтузиазмом также и ту неприступную крепость, в которой находится ключ к его собственному внутреннему существу.
Безнадежно отставшие даже в этой области, на которую они ложно претендовали, как на принадлежащую только им, буржуазные и фашистские страны окажутся побитыми, выражая бессильными фразами свое смущение. С другой стороны, как показывает упомянутый выше обзор, авангард рабочих в этих странах будет поднят сознанием этих глубоких возможностей даже биологического прогресса, который благодаря социализму получает возможность своего осуществления. Они таким образом получат еще больший стимул и поощрение при виде всеобъемлющего характера происходящего здесь прогресса.
Имеется, конечно, много важных принципиальных и практических моментов, связанных с этими предложениями, которым нет места в данном письме. Некоторые из них рассматриваются в упомянутой книге, экземпляр которой я Вам посылаю отдельно. Я буду рад дать любые дальнейшие подробности по этим вопросам, если это будет желательно.
С глубоким уважением,
братски ваш
Г. Г. Мюллер
старший генетик Института генетики
при Академии Наук СССР, Москва;
член Национальной Академии Наук США;
иностранный член Академии Наук СССР.
5 мая 1936 года.
Приложение 3. ВСЕОБЩАЯ ДЕКЛАРАЦИЯ О ГЕНОМЕ ЧЕЛОВЕКА И ПРАВАХ ЧЕЛОВЕКА
3 декабря 1997 г.
ВСЕОБЩАЯ ДЕКЛАРАЦИЯ О ГЕНОМЕ ЧЕЛОВЕКА И ПРАВАХ ЧЕЛОВЕКА
Генеральная конференция,
напоминая, что в преамбуле Устава ЮНЕСКО провозглашаются «демократические принципы уважения достоинства человеческой личности, равноправия и взаимного уважения людей», а также отказ от любой «доктрины неравенства людей и рас»; что в ней подчеркивается, что «для поддержания человеческого достоинства необходимо широкое распространение культуры и образования среди всех людей на основе справедливости, свободы и мира; поэтому на все народы возлагается в этом отношении священная обязанность, которую следует выполнять в духе взаимного сотрудничества»; что в ней провозглашается, что этот мир «должен базироваться на интеллектуальной и нравственной солидарности человечества», и указывается, что Организация стремится достичь «путем сотрудничества народов всего мира в области образования, науки и культуры международного мира и всеобщего благосостояния человечества, для чего и была учреждена Организация Объединенных Наций, как провозглашает ее Устав»,
торжественно напоминая о своей приверженности всеобщим принципам прав человека, которые провозглашаются, в частности, во Всеобщей декларации прав человека, принятой 10 декабря 1948 г., и в двух международных пактах Организации Объединенных Наций об экономических, социальных и культурных правах и о гражданских и политических правах, принятых 16 декабря 1966 г., в Конвенции о предупреждении преступления геноцида и наказании за него, принятой 9 декабря 1948 г., в Международной конвенции Организации Объединенных Наций о ликвидации всех форм расовой дискриминации, принятой 21 декабря 1965 г., в Декларации Организации Объединенных Наций о правах умственно отсталых лиц, принятой 20 декабря 1971 г., в Декларации Организации Объединенных Наций о правах инвалидов, принятой 9 декабря 1975 г., в Конвенции Организации Объединенных Наций о ликвидации всех форм дискриминации в отношении женщин, принятой 18 декабря 1979 г., в Декларации Организации Объединенных Наций об основных принципах правосудия в отношении жертв преступности и жертв злоупотреблений со стороны властей, принятой 29 ноября 1985 г., в Конвенции Организации Объединенных Наций о правах ребенка, принятой 20 ноября 1989 г., в Правилах Организации Объединенных Наций в отношении обеспечения равенства возможностей для инвалидов, принятых 20 декабря 1993 г., в Конвенции о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их уничтожении, принятой 16 декабря 1971 г., в Конвенции ЮНЕСКО о борьбе с дискриминацией в области образования, принятой 14 декабря 1960 г., в Декларации принципов международного культурного сотрудничества ЮНЕСКО, принятой 4 ноября 1966 г., в Рекомендации ЮНЕСКО о статусе научно-исследовательских работников, принятой 20 ноября 1974 г., в Декларации ЮНЕСКО о расе и расовых предрассудках, принятой 27 ноября 1978 г., в Конвенции МОТ (№ 111) о дискриминации в области труда и занятий, принятой 25 июня 1958 г., и в Конвенции МОТ (№ 169) о коренных и племенных народах в независимых странах, принятой 27 июня 1989 г.,
принимая во внимание, без ущерба для их положений, международные акты, которые могут быть связаны с прикладным использованием генетики в области интеллектуальной собственности, в частности Бернскую конвенцию об охране литературных и художественных произведений, принятую 9 сентября 1886 г., и Всемирную конвенцию ЮНЕСКО об авторском праве, принятую 6 сентября 1952 г., впоследствии пересмотренные в Париже 24 июля 1971 г., Парижскую конвенцию об охране промышленной собственности, принятую 20 марта 1883 г. и впоследствии пересмотренную в Стокгольме 14 июля 1967 г., Будапештский договор ВОИС о международном признании депонирования микроорганизмов в целях процедуры выдачи патентов, заключенный 28 апреля 1977 г., и Соглашение об аспектах прав интеллектуальной собственности, которые касаются торговли (АДПИК), содержащееся в приложении к Соглашению о создании Всемирной торговой организации, которое вступило в силу 1 января 1995 г.,
принимая также во внимание Конвенцию Организации Объединенных Наций о биологическом разнообразии, принятую 5 июня 1992 г., и подчеркивая в этой связи, что признание генетического разнообразия человечества не должно давать повод для какого-либо толкования социального или политического характера, которое могло бы поставить под сомнение «признание достоинства, присущего всем членам человеческой семьи, и равных и неотъемлемых прав их», провозглашаемых в преамбуле Всеобщей декларации прав человека,
напоминая о резолюциях 22 С/13.1, 23 С/13.1, 24 С/13.1, 25 С/5.2 и 7.3, 27 С/5.15 и 28 С/0.12, 2.1 и 2.2, которые возлагают на ЮНЕСКО обязанность поощрять и развивать анализ этических проблем и принимать соответствующие меры в связи с последствиями научно-технического прогресса в областях биологии и генетики в рамках соблюдения прав человека и основных свобод,
признавая, что научные исследования по геному человека и практическое применение их результатов открывают безграничные перспективы для улучшения здоровья отдельных людей и всего человечества, подчеркивая вместе с тем, что такие исследования должны основываться на всестороннем уважении достоинства, свобод и прав человека, а также на запрещении любой формы дискриминации по признаку генетических характеристик,
провозглашает следующие принципы и принимает настоящую Декларацию.
А. ЧЕЛОВЕЧЕСКОЕ ДОСТОИНСТВО И ГЕНОМ ЧЕЛОВЕКА
Статья 1
Геном человека лежит в основе изначальной общности всех представителей человеческого рода, а также признания их неотъемлемого достоинства и разнообразия. Геном человека знаменует собой достояние человечества.
Статья 2
a) Каждый человек имеет право на уважение его достоинства и его прав, вне зависимости от его генетических характеристик.
b) Такое достоинство непреложно означает, что личность человека не может сводиться к его генетическим характеристикам, и требует уважения его уникальности и неповторимости.
Статья 3
Геном человека в силу его эволюционного характера подвержен мутациям. Он содержит в себе возможности, которые проявляются различным образом в зависимости от природной и социальной среды каждого человека, в частности, состояния здоровья, условий жизни, питания и образования.
Статья 4
Геном человека в его естественном состоянии не должен служить источником извлечения доходов.
B. ПРАВА СООТВЕТСТВУЮЩИХ ЛИЦ
Статья 5
a) Исследования, лечение или диагностика, связанные с геномом какого-либо человека, могут проводиться лишь после тщательной предварительной оценки связанных с ними потенциальных опасностей и преимуществ и с учетом всех других предписаний, установленных национальным законодательством.
b) Во всех случаях следует заручаться предварительным, свободным и ясно выраженным согласием заинтересованного лица. Если оно не в состоянии его выразить, то согласие или разрешение должны быть получены в соответствии с законом, исходя из высших интересов этого лица.
c) Должно соблюдаться право каждого человека решать, быть или не быть информированным о результатах генетического анализа и его последствиях.
d) В случае исследований их документальные результаты следует представлять на предварительную оценку согласно соответствующим национальным и международным нормам или руководящим принципам.
e) Если какое-либо лицо не в состоянии выразить в соответствии с законом своего согласия, исследования, касающиеся его генома, могут быть проведены лишь при условии, что они непосредственным образом скажутся на улучшении его здоровья и что будут получены разрешения и соблюдены меры защиты, предусматриваемые законом. Исследования, не позволяющие ожидать какого-либо непосредственного улучшения здоровья, могут проводиться лишь в порядке исключения, с максимальной осторожностью, таким образом, чтобы заинтересованное лицо подвергалось лишь минимальному риску и испытывало минимальную нагрузку, при условии, что эти исследования проводятся в интересах здоровья других лиц, принадлежащих к той же возрастной группе или обладающих такими же генетическими признаками, с соблюдением требований, предусматриваемых законом, а также с обеспечением совместимости этих исследований с защитой прав данного лица.
Статья 6
По признаку генетических характеристик никто не может подвергаться дискриминации, цели или результаты которой представляют собой посягательство на права человека, основные свободы и человеческое достоинство.
Статья 7
Конфиденциальность генетических данных, которые касаются человека, чья личность может быть установлена, и которые хранятся или подвергаются обработке в научных или любых других целях, должна охраняться в соответствии с законом.
Статья 8
Каждый человек в соответствии с международным правом и национальным законодательством имеет право на справедливую компенсацию того или иного ущерба, причиненного в результате непосредственного и детерминирующего воздействия на его геном.
Статья 9
В целях защиты прав человека и основных свобод ограничения, касающиеся принципов согласия и конфиденциальности, могут вводиться лишь в соответствии с законом по крайне серьезным причинам и в рамках международного публичного права и международного права в области прав человека.
С. ИССЛЕДОВАНИЯ, КАСАЮЩИЕСЯ ГЕНОМА ЧЕЛОВЕКА
Статья 10
Никакие исследования, касающиеся генома человека, равно как и никакие прикладные исследования в этой области, особенно в сферах биологии, генетики и медицины, не должны превалировать над уважением прав человека, основных свобод и человеческого достоинства отдельных людей или, в соответствующих случаях, групп людей.
Статья 11
Не допускается практика, противоречащая человеческому достоинству, такая, как практика клонирования в целях воспроизводства человеческой особи. Государствам и компетентным международным организациям предлагается сотрудничать с целью выявления такой практики и принятия на национальном и международном уровнях необходимых мер в соответствии с принципами, изложенными в настоящей Декларации.
Статья 12
a) Следует обеспечивать всеобщий доступ к достижениям науки в области биологии, генетики и медицины, касающимся генома человека, при должном уважении достоинства и прав каждого человека.
b) Свобода проведения научных исследований, которая необходима для развития знаний, является составной частью свободы мысли. Цель прикладного использования результатов научных исследований, касающихся генома человека, особенно в области биологии, генетики и медицины, заключается в уменьшении страданий людей и в улучшении состояния здоровья каждого человека и всего человечества.
D. УСЛОВИЯ ОСУЩЕСТВЛЕНИЯ НАУЧНОЙ ДЕЯТЕЛЬНОСТИ
Статья 13
Ответственность, являющаяся неотъемлемой частью деятельности научных работников — в том числе требовательность, осторожность, интеллектуальная честность и непредвзятость — как при проведении научных исследований, так и при представлении и использовании их результатов, должна быть предметом особого внимания, когда речь идет об исследованиях, касающихся генома человека, с учетом их этических и социальных последствий. Лица, принимающие в государственном и частном секторах политические решения в области науки, также несут особую ответственность в этом отношении.
Статья 14
Государствам следует принимать соответствующие меры, способствующие созданию интеллектуальных и материальных условий, благоприятствующих свободе проведения научных исследований, касающихся генома человека, и учитывать при этом этические, правовые, социальные и экономические последствия таких исследований в свете принципов, изложенных в настоящей Декларации.
Статья 15
Государствам следует принимать соответствующие меры, обеспечивающие рамки для беспрепятственного осуществления научных исследований, касающихся генома человека, с должным учетом изложенных в настоящей Декларации принципов, чтобы гарантировать соблюдение прав человека и основных свобод и уважение человеческого достоинства, а также охрану здоровья людей. Такие меры должны быть направлены на то, чтобы результаты этих исследований использовались только в мирных целях.
Статья 16
Государствам следует признать важное значение содействия на различных соответствующих уровнях созданию независимых, многодисциплинарных и плюралистических комитетов по этике для оценки этических, правовых и социальных вопросов, которые возникают в связи с проведением научных исследований, касающихся генома человека, и использованием результатов таких исследований.
Е. СОЛИДАРНОСТЬ И МЕЖДУНАРОДНОЕ СОТРУДНИЧЕСТВО
Статья 17
Государствам следует практиковать и развивать солидарность с отдельными людьми, семьями и группами населения, которые особенно уязвимы в отношении заболеваний или недостатков генетического характера либо страдают ими. Государствам следует, в частности, содействовать проведению научных исследований, направленных на выявление, предотвращение и лечение генетических заболеваний или заболеваний, вызванных воздействием генетических факторов, в особенности редких заболеваний, а также заболеваний эндемического характера, от которых страдает значительная часть населения мира.
Статья 18
Государствам следует, должным и надлежащим образом учитывая изложенные в настоящей Декларации принципы, прилагать все усилия к дальнейшему распространению в международном масштабе научных знаний о геноме человека, разнообразии человеческого рода и генетических исследованиях, а также укреплять международное научное и культурное сотрудничество в этой области, в особенности между промышленно развитыми и развивающимися странами.
Статья 19
a) В рамках международного сотрудничества с развивающимися странами государствам следует поощрять меры, которые позволяют:
i) осуществлять оценку опасностей и преимуществ, связанных с проведением научных исследований, касающихся генома человека, и предотвращать злоупотребления;
ii) расширять и укреплять потенциал развивающихся стран в области проведения научных исследований по биологии и генетике человека с учетом конкретных проблем этих стран;
iii) развивающимся странам пользоваться достижениями научного и технического прогресса, дабы применение таких достижений в интересах их экономического и социального прогресса осуществлялось ради всеобщего блага;
iv) поощрять свободный обмен научными знаниями и информацией в областях биологии, генетики и медицины.
b) Соответствующим международным организациям следует оказывать поддержку и содействие инициативам, предпринимаемым государствами в вышеозначенных целях.
F. СОДЕЙСТВИЕ ИЗЛОЖЕННЫМ В ДЕКЛАРАЦИИ ПРИНЦИПАМ
Статья 20
Государствам следует принимать соответствующие меры с целью содействия изложенным в настоящей Декларации принципам на основе образования и использования соответствующих средств, в том числе на основе осуществления научных исследований и подготовки в многодисциплинарных областях, а также на основе оказания содействия образованию в области биоэтики на всех уровнях, в особенности предназначенному для лиц, ответственных за разработку политики в области науки.
Статья 21
Государствам следует принимать соответствующие меры, направленные на развитие других форм научных исследований, подготовки кадров и распространения информации, содействующих углублению осознания обществом и всеми его членами своей ответственности перед лицом основополагающих проблем, связанных с необходимостью защитить достоинство человека, которые могут возникать в свете проведения научных исследований в биологии, генетике и медицине, а также прикладного использования их результатов. Им так же следует содействовать открытому обсуждению в международном масштабе этой тематики, обеспечивая свободное выражение различных мнений социально-культурного, религиозного или философского характера.
G. ОСУЩЕСТВЛЕНИЕ ДЕКЛАРАЦИИ
Статья 22
Государствам следует активно содействовать изложенным в настоящей Декларации принципам, а также способствовать их осуществлению всеми возможными средствами.
Статья 23
Государствам следует принимать соответствующие меры для содействия посредством образования, подготовки и распространения информации соблюдению вышеизложенных принципов и способствовать их признанию и действенному применению. Государствам следует также способствовать обменам между независимыми комитетами по этике и их объединению в сети по мере их создания для развития всестороннего сотрудничества между ними.
Статья 24
Международному комитету ЮНЕСКО по биоэтике следует способствовать распространению принципов, изложенных в настоящей Декларации, и дальнейшему изучению вопросов, возникающих в связи с их претворением в жизнь и развитием соответствующих технологий. Ему следует организовывать необходимые консультации с заинтересованными сторонами, такими, как уязвимые группы населения. Комитету, в соответствии с уставными процедурами ЮНЕСКО, следует готовить рекомендации для Генеральной конференции и высказывать мнение о ходе претворения в жизнь положений Декларации, особенно в том, что касается практики, которая может оказаться несовместимой с человеческим достоинством, например, случаев воздействия на потомство.
Статья 25
Никакие положения настоящей Декларации не могут быть истолкованы таким образом, чтобы служить какому-либо государству, группе людей или отдельному человеку в качестве предлога для осуществления ими каких-либо действий или любых акций, несовместимых с правами человека и основными свободами, включая принципы, изложенные в настоящей Декларации.
ОСУЩЕСТВЛЕНИЕ ВСЕОБЩЕЙ ДЕКЛАРАЦИИ О ГЕНОМЕ ЧЕЛОВЕКА И ПРАВАХ ЧЕЛОВЕКА
Генеральная конференция,
принимая во внимание Всеобщую декларацию о геноме человека и правах человека, принятую сегодня, 11 ноября 1997 г.,
отмечая, что соображения, высказанные государствами–членами при принятии Всеобщей декларации, актуальны для претворения в жизнь ее положений,
1. настоятельно призывает государства-члены:
a) руководствуясь положениями Всеобщей декларации о геноме человека и правах человека, принять необходимые меры, в том числе, в случае необходимости, законодательного или регламентирующего характера, направленные на содействие принципам, изложенным в Декларации, и их осуществление;
b) регулярно представлять Генеральному директору сведения о всех мерах, принимаемых ими в целях осуществления принципов, изложенных в Декларации;
2. предлагает Генеральному директору:
a) созвать как можно скорее после 29-й сессии Генеральной конференции сбалансированную с точки зрения географической представленности специальную рабочую группу в составе представителей государств-членов с целью подготовки для него рекомендаций в отношении организации Международного комитета по биоэтике, задач последнего в связи со Всеобщей декларацией, а также условий, в частности масштаба консультаций, в рамках которых Комитет будет обеспечивать претворение в жизнь положений указанной Декларации, и представить доклад по этому вопросу Исполнительному совету на его 154-й сессии;
b) принять необходимые меры, с тем, чтобы Международный комитет по биоэтике обеспечил распространение Декларации, а также претворение в жизнь ее положений и содействовал провозглашенным в ней принципам;
c) подготовить для Генеральной конференции комплексный доклад о положении в мире в областях, относящихся к сфере действия Декларации, используя при этом информацию, представленную государствами-членами, а также другую со всей очевидностью достоверную информацию, полученную так, как он сочтет нужным;
d) учесть при подготовке своего комплексного доклада работу, проделанную организациями и учреждениями системы Организации Объединенных Наций, другими межправительственными организациями, а также компетентными международными неправительственными организациями;
e) представить Генеральной конференции свой комплексный доклад, а также все замечания и рекомендации общего характера, которые он сочтет необходимыми для содействия осуществлению Декларации.
СПЕЦИАЛЬНЫЕ ТЕРМИНЫ, ИСПОЛЬЗОВАННЫЕ В ЭТОЙ КНИГЕ
Аденин — пуриновое основание, комплементарное тимину (в ДНК) и урацилу (в РНК), входящее в состав ДНК и РНК.
Аллель — одно из возможных структурных состояний гена.
Альтернативный сплайсинг — форма сплайсинга РНК-предшественника, которая обеспечивает кодирование одним геном нескольких отличающихся по структуре полипептидов.
Аминокислота — мономерная единица («строительный блок») белков.
Амплификация — процесс образования (умножения) дополнительных копий определенных участков ДНК.
Анеуплоидия — присутствие в геноме числа хромосом, не равного типичному для данного вида организма.
Антионкоген — ген, препятствующий развитию рака.
Апоптоз (от греч. опадание листвы) — запрограммированная в геноме клеточная гибель.
Бактериофаг — вирус, инфицирующий бактерии.
Вектор — самореплицирующаяся молекула ДНК (например, плазмида), используемая в генной инженерии для переноса генов из организма-донора в организм-реципиент.
Вырожденность генетического кода — возможность кодирования одной аминокислоты несколькими кодонами мРНК.
Гаплотип — комбинация аллелей на одной хромосоме диплоидного организма.
Ген (от греч. genos — происхождение) — это физическая (определенный участок ДНК) и функциональная (кодирует белок или РНК) единица наследственности. Важнейшее свойство генов — сочетание их высокой устойчивости в ряду поколений со способностью к наследуемым изменениям (мутациям), служащим основой изменчивости организмов, дающей материал для естественного отбора.
Ген-кандидат — структурный ген в геноме человека, мутация в котором предположительно является причиной конкретного наследственного заболевания.
Генетика (от греч. genos — происхождение) — наука, изучающая механизмы и закономерности наследственности и изменчивости организмов. Основы генетики заложены Г. Менделем (1822–1884), открывшим законы наследственности.
Генетическая информация — программа свойств организма, получаемая от предков и заложенная в наследственных структурах в виде генетического кода. Генетическая информация определяет морфологическое строение, рост, развитие, обмен веществ, психический склад, предрасположенность к заболеваниям и генетические пороки организма.
Генетические карты — схема относительного расположения генов в хромосомах, позволяющая предсказывать характер наследования изучаемых признаков организмов. Один конец хромосомы принимается за нулевой и от него отсчитывается расстояние в специальных единицах (морганидах).
Генетический код — свойственная живым организмам единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов. Каждый нуклеотид обозначается заглавной буквой, с которой начинается название азотистого основания, входящего в его состав: А — аденин, Г — гуанин, Ц — цитозин, Т — тимин (в ДНК) или У — урацил (в мРНК). Реализация генетического кода в клетке происходит в два этапа: транскрипция (синтез мРНК) и трансляция (синтез белка).
Генетическое картирование — составление схем, в которых гены расположены в линейном порядке с указанием относительных расстояний между ними.
Генная инженерия — практика целенаправленного изменения генетических программ клеток с целью придания исходным формам организмов новых свойств или создания принципиально новых форм организмов. Основной метод генной инженерии состоит в извлечении из клеток организма гена или группы генов, соединении их с определенными молекулами нуклеиновых кислот и внедрении полученных гибридных молекул в клетки другого организма.
Генная терапия ex vivo — введение гена в изолированные клетки больного с последующей их пересадкой назад в больной организм с целью излечения.
Генная терапия in vivo — введение гена непосредственно в ткань или орган больного организма с целью устранения патологии.
Геном — ДНК, содержащаяся в гаплоидном наборе хромосом клетки определенного вида организма. В расширенном виде под геномом понимается вся наследственная система клетки.
Геномная дактилоскопия — идентификация личности на основе молекулярного анализа гипервариабельных участков генома.
Генотип (от греч. genos — происхождение + typos — отпечаток) — совокупность всех наследственных свойств особи. Генотип — наследственная основа организма.
Генофонд (от греч. genos — происхождение + лат. fondus — основание) — совокупность генов, которые имеются у особей полуляции, группы популяций или вида, занимающих определенную административную или национальную территорию.
Гены «домашнего хозяйства» — набор основных структурных генов, обеспечивающих жизнедеятельность клетки.
Гибридизация — отжиг двух комплементарных полинуклеотидных цепей с образованием ДНК/ДНК-или ДНК/РНК-гибридов.
Гомозиготность — наличие идентичных аллелей на обеих хромосомах.
Гомополимерная нуклеотидная последовательность — последовательность, состоящая из одного вида нуклеотидов.
Гуанин — пуриновое основание, комплементарное цитозину, входящее в состав ДНК и РНК.
Дактилоскопия (от греч. daktylos — палец + skopeo — смотрю) — определение личности по отпечаткам пальцев. Генная дактилоскопия — определение личности на основании анализа структуры ДНК.
Дезоксирибоза — пятиуглеродный моносахарид, входящий в состав ДНК.
Дезоксирибонуклеиновая кислота (ДНК) — высокополимерное природное соединение, содержащееся в ядрах клеток всех живых организмов, носитель генетической информации. Отдельные участки ДНК соответствуют определенным генам. ДНК точно воспроизводится при делении клеток, что обеспечивает в ряду поколений клеток и организмов передачу наследственных признаков и специфических форм обмена веществ.
Дивергенция (от лат. divergo — отклоняюсь, отхожу) — процесс расхождения признаков организмов в ходе эволюции. Применительно к генам — изменение структуры двух генов, произошедших в результате дупликации (удвоения).
Доминантный признак (от лат. dominans — господствующий) — преобладающий признак, проявляющийся в потомстве у гетерозиготных особей.
Диплоид — организм, клетки которого содержат два гомологичных набора хромосом.
Длинные концевые повторы (ДКП) — прямые повторяющиеся нуклеотидные последовательности на концах ДНК-копии генома ретровирусов.
Зигота (от греч. zygote — спаренная) — клетка, образующаяся при слиянии двух гамет (половых клеток) — женской (яйцеклетки) и мужской (сперматозоида). Содержит диплоидный (двойной) набор хромосом.
Евгеника — раннее направление в генетике, занимавшееся наследственным здоровьем человека и путями его сохранения и улучшения.
Избыточная ДНК — ДНК, не кодирующая белки и не несущая иных известных функций.
Импринтинг — генетическая зависимость эффективности работы гена от того, каким родителем он передан.
Интрон — некодирующая область, расположенная внутри гена. Интрон вырезается в процессе сплайсинга при образовании мРНК из первичного РНК-транскрипта.
Канцероген — вещество, способствующее возникновению злокачественных опухолей.
Картирование — локализация элементов генома на генетической карте.
Клонирование — система генно-инженерных методов для получения и размножения отдельных фрагментов из молекулы ДНК. Применительно к организмам — получение генетически идентичных копий.
Кодон — дискретная единица генетического кода, состоящая из трех последовательно расположенных нуклеотидов в молекуле ДНК или РНК. Из 64 кодонов 61 кодирует определенные аминокислоты, а 3 стоп-кодона определяют окончание синтеза полипептидной цепи. Последовательность кодонов в гене определяет последовательность аминокислот в полипептидной цепи белка, кодируемого этим геном.
Комплементарные нуклеотидные последовательности — полинуклеотидные последовательности, которые взаимодействуют между собой в соответствии с правилами спаривания оснований: аденин (А) образует пару с тимином (Т) (или урацилом (У) в РНК), гуанин (Г) — с цитозином (Ц).
Конвергенция (от лат. convergo — приближаюсь, схожусь) — процесс появления сходных признаков организмов в ходе эволюции.
Контиг — набор перекрывающихся фрагментов ДНК одного локуса.
Кроссинговер — обмен равными участками гомологичных конъюгирующих хромосом, происходящий в профазе первого мейоза и приводящий к перераспределению в них генов. Внешним проявлением кроссинговера являются хиазы. Кроссинговер — один из механизмов наследственной изменчивости.
Лигаза — бактериальный фермент, осуществляющий соединение двух линейных фрагментов нуклеиновых кислот.
Локус — участок хромосомы, в котором содержится определенная нуклеотидная последовательность.
Метилирование ДНК — химическая модификация ДНК, заключающаяся в присоединении метильной группы (CH3) к цитозину.
Митоз — основной способ деления клетки, обеспечивающий строго равномерное распределение хромосом в дочерних клетках.
Мишень — в широком смысле биологический объект (ткань, молекула, ген, белок, клетка), который интересует исследователя.
Мобильные генетические элементы — элементы генома, топография и количество которых может варьировать у разных индивидуумов одного вида.
Моносомия — потеря в геноме одной из двух гомологичных хромосом.
Морганида — единица расстояния между двумя генами в одной группе сцепления, характеризующаяся частотой кроссинговера в 1%. Чем больше расстояние между генами, тем меньше сила сцепления между ними.
Мутантный ген — ген, в котором произошли перестройки или нарушения порядка расположения нуклеотидов. Различают доминантные и рецессивные мутантные гены.
Мутация (от лат. mutatio — изменение) — наследственное изменение генома. Мутация — основа наследственной изменчивости в живой природе. По характеру возникновения различают естественные и искусственные мутации. По генетическому проявлению различают доминантные и рецессивные мутации. Мутации бывают: генные, хромосомные, генеративные (в половых клетках), внеядерные (цитоплазматические) и т. д. Термин «мутация» предложил голландский ученый Г. де Фриз.
Нокаут гена — искусственная направленная модификация гена, приводящая к его полной инактивации.
Нуклеосома — дисковидная структура, являющаяся элементарной единицей упаковки ДНК в хромосомах.
Нуклеотид — химическое соединение, состоящие из остатков азотистого основания, углевода и фосфора, входит в состав нуклеиновых кислот (буква в генетическом алфавите).
Обратная транскриптаза — РНК-зависимая ДНК-полимераза, использующая молекулу РНК для синтеза комплементарной ДНК (кДНК).
Онкоген — ген, мутации в котором способствуют возникновению злокачественной опухоли.
Органелла — внутриклеточная структура (клеточный «орган»), обеспечивающая выполнение специфических функций. У человека известно более 10 органелл.
Палиндром (от греч. palin dromo — снова бегу) — участок ДНК, обе цепи которого обладают одинаковой последовательностью нуклеотидов при прочитывании в разном направлении.
Плазмида — внехромосомная кольцевая ДНК, способная к автономной репликации и содержащая генетические маркеры.
Половые клетки — яйцеклетка и сперматозоид.
Половые хромосомы — хромосомы, по которым мужской пол отличается от женского. Две хромосомы X определяет определяют женский пол, половые хромосомы мужского организма разные: X и Y. Поскольку все сперматозоиды образуются путем мейотического деления клеток, половина их несет X-хромосомы, а половина — Y-хромосомы. Вероятность получения мужского и женского пола одинакова.
Полипептид — линейный полимер, состоящий из аминокислот, соединенных друг с другом пептидными связями (белковая молекула).
Провирус — форма существования вируса, когда его геном интегрирован с геномом клетки-хозяина.
Промотор — участок молекулы ДНК, с которым связывается фермент РНК-полимераза, после чего начинается синтез РНК с области, расположенной за ним.
Протеомика — наука о совокупном наборе белков клетки.
Псевдоген — дефектная копия нормального гена.
Рекомбинантная ДНК — молекула ДНК, полученная в результате объединения с помощью методов генной инженерии чужеродных фрагментов ДНК в составе вектора.
Репарация — процесс, обеспечивающий исправление повреждений в ДНК.
Репликация — процесс самовоспроизведения молекул нуклеиновых кислот, обеспечивающий передачу по наследству точных копий генетической информации.
Репликон — автономная единица репликации.
Рестриктаза — бактериальный фермент, расщепляющий ДНК в строго определенных по последовательности нуклеотидов участках.
Ретровирусы — группа РНК-содержащих вирусов, способных кодировать обратную транскриптазу.
Рецессивный признак (от лат. recessus — отступление) — признак, который передается по наследству, но подавляется, не проявляясь у гетерозиготных потомков, полученных при скрещивании.
Рибоза — пятиуглеродный моносахарид, входящий в состав РНК.
Рибонуклеиновые кислоты — тип нуклеиновых кислот; высокомолекулярные органические соединения, состоящие из четырех нуклеотидов (аденин, гуанин, цитозин, урацил) и сахара рибозы. В клетках всех живых организмов РНК участвуют в реализации генетической информации. У многих РНК-содержащих вирусов РНК — вещество наследственности. Некоторые РНК (рибозимы) обладают активностью ферментов. Различают три основных вида РНК:
– мРНК — матричные или информационные РНК;
– тРНК — транспортные РНК;
– рРНК — рибосомные РНК.
Риборегуляторы — не кодирующие белок РНК, которые принимают участие в регуляции транскрипции ДНК и трансляции мРНК, модулировании функций белков и их распределения в клетке.
Рибосома — органелла клетки, состоящая из белка и рибосомной РНК, осуществляющая снтез белка (трансляцию) в клетке.
Рибозим — РНК-катализатор.
РНК-интерференция — избирательное подавление работы гена с помощью короткой двунитевой РНК, имеющей с ним гомологию.
РНК-полимераза — фермент, осуществляющий синтез РНК по матрице ДНК (иногда по матрице РНК).
Сайленсер — регуляторный элемент, ослабляющий работу гена.
Секвенирование — определение нуклеотидной последовательности молекулы нуклеиновой кислоты.
Симбиоз — сосуществование разных организмов, при котором каждый из них выполняет свои функции. Часто такое сосуществование взаимовыгодно.
Соматическая клетка — любая неполовая клетка многоклеточного организма.
Сперматозоид — мужская половая клетка человека и других животных. Сперматозоид содержит гаплоидный (единичный) набор хромосом. Сперматозоид большинства организмов имеет головку, шейку и хвостик (жгутик), с помощью которого он передвигается.
Сплайсеосома — РНК-белковый комплекс, осуществляющий сплайсинг.
Сплайсинг — процесс превращения первичной молекулы РНК, образующейся при транскрипции гена, в зрелую молекулу РНК, выполняющую свою функцию за счет удаления из нее последовательностей, транскрибированных с интронов.
Стартовый кодон — триплет АУГ в мРНК, кодирующий аминокислоту метионин, с которого начинается образование полипептидной (белковой) цепи в процессе трансляции мРНК.
Стволовые клетки — митотически активные соматические клетки, в результате деления которых происходит замещение погибших клеток в многоклеточном организме. Пример: стволовые клетки костного мозга, дифференциирующиеся в разные типы клеток циркулирующей крови.
Структурный ген — ген, кодирующий синтез полипептидной цепи (белка).
Сцепление генов — связь между генами, которые расположены в одной хромосоме. Сцепление генов приводит к совместной передаче потомству групп генов (групп сцепления) в тех же комбинациях аллелей, в каких они были у родительских форм.
Сцепленное наследование — совместное наследование генов, локализованных в одной хромосоме.
Теломера — (от греч. telos — конец, цель) комплекс, образуемый концевым участоком хромосомы с различными специфическими белками.
Тимин — пиримидиновое основание, входящее в состав ДНК.
Трансгеноз — искусственный перенос чужеродных генов в целые организмы.
Транскрипция — биосинтез РНК на матрице ДНК, осуществляющийся в клетках организма ферментами, называемыми РНК-полимеразами. Транскрипция — первый этап реализации генетического кода, в ходе которого последовательность нуклеотидов ДНК переписывается в нуклеотидную последовательность РНК.
Трансляция — биосинтез полипептидных цепей белков, идущий в клетках путем считывания генетической информации, записанной в виде последовательности нуклеотидов в молекулах матричных РНК. Трансляция — второй этап реализации генетического кода.
Транспозаза — фермент, участвующий в процессе перемещения в геноме (транспозиции) подвижных генетических элементов.
Транспозон — подвижный генетический элемент.
Трансформация — перенос генетической информации в бактериальные клетки при помощи изолированной ДНК с участием или без участия плазмид.
Трисомия — присутствие в диплоидном геноме трех гомологичных хромосом.
Урацил — пиримидиновое основание, входящее в состав РНК.
Фактор транскрипции — белок, помогающий ферменту РНК-полимеразе пройти все этапы транскрипции и обеспечивающий избирательность этого процесса.
Факультативные элементы — элементы генома, присутствие которых у отдельных индивидуумов не является строго обязательным.
Хромосома — структура, расположенная в клеточном ядре, состоящая из ДНК, гистонов и негистоновых белков и способная к самовоспроизведению с сохранением структурно-функциональной индивидуальности.
Центромера — внутренний участок хромосомы, в котором происходит присоединение нити веретена, обеспечивающее при делении клетки движение хромосом к центру деления при митозе.
Цитогенетика — раздел генетики, исследующий явления наследственности и изменчивости организмов в связи с их клеточными структурами и прежде всего хромосомами.
Цитозин — одно из четырех азотистых оснований, входящих в состав ДНК и РНК.
Экзоны — фрагменты гена, кодирующие белок.
Экспрессия — работа, функционирование гена.
Электропорация — перенос генов в клетки с помощью воздействия на клетки электрическими импульсами.
Элементы генома — дискретные участки ДНК, отличающиеся по функциональным признакам или по последовательности нуклеотидов.
Энхансер — регуляторный элемент, усиливающий транскрипцию гена.
Эпигеномика (от греч. epi — рядом, около) — наука о генетических эффектах, не связанных непосредственно с генетическим текстом, а обусловленных внегенетическими эффектами (например, метилированием ДНК).
Этногеномика — наука, изучающая генофонд населения на основе анализа геномного разнообразия.
Эукариоты — организмы, в клетках которых имеется ядро, где содержатся хромосомы (животные, растения, грибы, некоторые водоросли).
Фенотип (от греч. phaino — являю + typos — отпечаток) — совокупность всех внутренних и внешних признаков и свойств особи, сформировавшихся на базе генотипа в процессе ее индивидуального развития (онтогенеза). Фенотип — вариант нормы реакции организма на действие внешних условий. При относительно одинаковых генотипах в определенных пределах возможны многие варианты фенотипов.
Ядро — органелла клетки, в которой в форме хромосом содержится геном.
Яйцеклетка — женская половая клетка, которая образуется в яичнике и имеет гаплоидный (единичный) набор хромосом.
ЛИТЕРАТУРА
Баранов В. С., БарановаЕ. В., Иващенко Т. Э., Асеев М. В. Геном человека и гены «предрасположенности». СПб.: Интермедика, 2000.
Бочков Н. П. Клиническая генетика. М.: ГЭОТАР–МЕД, 2001.
Всеобщая декларация «О геноме человека и правах человека». ЮНЕСКО, 1997.
Газарян К. Г., Тарантул В. 3. Геном эукариот. М.: МГУ, 1983.
Гвоздев В. А. Подвижная ДНК эукариот. Ч. 1: Структура, механизмы перемещения и роль подвижных элементов в поддержании целостности хромосом //Соросовский образовательный журнал. 1998. № 8. С. 8–21.
Гвоздев В. А. Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК //Соросовский образовательный журнал. 1999. № 10. С. 11–17.
Генная терапия — медицине будущего, обзорные материалы. М.: ВИНИТИ РАН, 2000.
Генофонд и геногеография народонаселения: В 5 т. СПб.: Наука, 2001.
Гершензон С. М., Бужиевская Т. И. Евгеника: 100 лет спустя //Человек. 1996. № 1.
Глик Б., Пастернак Дж. Молекулярная биотехнология. М.: Мир, 2002.
Голубовский М. Геном человека и соблазны детерминизма //Вестник. 2001. № 6.
Докинз Р. Эгоистичный ген. М.: Мир, 1993.
Дымшиц Г. М. Сюрпризы митохондриального генома //Природа. 2002. № 6. С. 54–61.
Зеленин А. В. Генная терапия на границе третьего тысячелетия //Вестник Российской академии наук. 2001. Т. 71. № 5. С. 387–395.
Иванов В. И. Геном человека — медицине //Природа. 1998. № 10.
Киселев Л. Л. Геном человека и биология XXI века //Вестник Российской академии наук. 2000. Т. 70. № 5. С. 412–424.
Корочкин Л. И. Онтогенез, эволюция и гены //Природа. 2002. № 7.
Лимборская С. А., Хуснутдинова Э. К., Балановская Е. В. Этногеномика и геногеография народов Восточной Европы. М.: Наука, 2002.
Пальцев М. А. Молекулярная медицина и прогресс фундаментальных наук //Вестник Российской академии наук. 2002. Т. 72. № 1. С. 13–21.
Патрушев Л. И. Экспрессия генов. М.: Мир, 2000.
Проблемы и перспективы молекулярной генетики: Сборник трудов ИМГ РАН. М.: Наука, 2003.
Рогаев Е. И., Боринская С. А. Гены и поведение //Химия и жизнь. 2000. № 3. С. 20–25.
Свердлов Е. Д. Френсис Крик в его прогнозе на 2000 год был почти абсолютно прав //Биоорганическая химия. 2000. Т. 26. № 10. С. 761–766.
Скулачев В. П. Старение организма — частный случай феноптоза //Соровский образовательный журнал. 2001. № 10. С. 7–11.
Сойфер В. Н. Международный проект «Геном человека» //Соровский образовательный журнал. 1998. № 12. С. 4–11.
Спирин А. С. Современная биология и биологическая безопасность //Человек. 1998. № 5.
Угрюмов М. В., Ермаков А. С., Попов А. П., Жданов Р. И. Генная и генно-клеточная терапия и нейродегенеративные заболевания //Вопросы медицинской химии. 2000. № 3.
Франк-Каменецкий М. Д. Самая главная молекула. М.: Наука, 1983.
Хесин Р. Б. Непостоянство генома. М.: Наука, 1984.
Чемерис А. В., Аxунов Э. Д., Вахитов В. А. Секвенирование ДНК. М.: Наука, 1999.
Янковский Н. К., Боринская С. А. Геном человека: Нити судьбы //Химия и жизнь. 1998. № 4. С. 26–30.
Benner S. A., Trabesinger N., Schreiber D. Post-Genomic Science: Converting Primary Structure into Physiological Function //Advances Enzyme Regulation. 1998. Vol. 38. № 1. P. 155–180.
Davies К. Cracking the Genome. N. Y.: The Free Press, 2001.
Lander E. S. et al. Initial Sequencing and Analysis of the Human Genome //Nature. 2001. Vol. 409. № 6822. Р. 860–921.
Olson M. V., Varki A. Sequencing the Сhimpanzee Genome: Insights into Evolution and Disease //Nature Review Genetics. 2003. Vol. 4. № 1. Р. 20–28.
Venter J. C. et al. The Sequence of Human Genome //Science. 2001. Vol. 291. №5507. Р. 1304–1351.
Сообщение от: TizgarMer, Время: 2018-01-26 01:17:36
Positioning the Newborn in the Postoperative Period Way of thinking the offspring on the from side with the head of the bed downright or at the consistent prescribed on the neurosurgeon. Unfortunately, during indisposition and hospitalization, these critical patterns of feeding, contact, consolation, sleeping, elimination, and stimulation are disrupted, resulting in apprehension, separation angst, and detriment of control. Nov 1997, MMWR Morb Mortal Wkly Rep, 46 (45), Pt 1061-1066 6) Carpino, P discount 160mg super viagra with visa erectile dysfunction va disability rating.
Classical combination bioanalytical studies over again rely on the preparation and enquiry of homogenates of the entire magazine or the member of parliament sections of that organ. Tickling may be a lucky procedure against assessing the wreck of paralysis in the young gentleman with Guillain-Barr? syndrome, either initially or in the improvement phase. Hemorrhoids are caused by the distension of the arteries that are set in the rectum and anal are cheap eriacta 100mg amex erectile dysfunction groups in mi. Considering the complication of the regulatory events driving P-glycoprotein expression in the epileptic acumen it is rather inappropriate that genetic analyses resolve be benevolent in this context (Potschka 2010d). Signs and symptoms of a shunt infection list lofty pivotal signs, poor feeding, vomiting, decreased responsiveness, attack vocation, and signs of adjoining swelling along the shunt tract. "My spinal material stimulator is the supreme therapy for me order clomiphene 50mg with amex women\'s health center heritage valley. Once the deficient cause is replaced, clotting factors resurface to fairly sane levels an eye to a while of time. Nursing Bosses of the Youth With Congenital Guts Disease The young gentleman with a congenital heart turn traitor has multiple needs and requires comprehensive, multidisciplinary care. Likewise, aqualung diving, skydiving and rope propulsion are not sports I would urge to mortal with asthma buy 30gm himcolin overnight delivery erectile dysfunction essential oil. Moreover, it appeared that in comeback to a speech pattern piece of work, greater self-importance was associated with smaller rise of TNF- and that of the IL-1 receptor opponent (IL-1Ra). Nonopioid analgesics utilized to play host to indulgent to moderate pain subsume acetaminophen and NSAIDs such as ibuprofen, ketorolac, naproxen, and, less commonly, indomethacin, diclofenac, and piroxicam. Tonsil stones are the formations that bechance at the tonsils generic 140 mg malegra fxt with amex impotence causes cures.
No matter how the crucial influence of the corollary discharge would be expected to be at the higher short-term buffer level, and so write to that just the same level in CODAM. Oversee anticoagulation treatment (regular conceding that hemorrhage is a relevant to) to interfere in the coagulation process that is present in this condition. Intense Phentermine fasting pills affects our hypothalamus secreter in our nous buy 100 mg kamagra polo overnight delivery erectile dysfunction drugs cialis. If the status can be obstinate apace and easily prior to consider entry, the bio- marker classification should be a stratification lender in the 100 90 80 70 60 50 0 0 1 2 Years after randomization No. It is favoured that we purposefulness desideratum to improve functional reaction criteria to choose the activity of targeted thera- pies in ovarian cancer and that RECIST commitment be of little value when cytostatic agents are being evaluated in clinical trials. Factor V metropolis pleomorphism modifies sepsis outcome: evidence from insectlike studies discount 100mg modafinil free shipping insomnia 5 weeks pregnant. Attention to round of applause washing is necessary, as droplets influence tender the eyes, nose, or speak via the hands. Convalescence from encephalitis can arise in a only one days or may be complicated and involve austere neurologic bill with surplus effects. What just is individual insistence best caverta 100mg impotence cures natural. A at conceivable diligence of rTMS in diagnosis and evaluation of epi- lepsy is its potential to escalating cortical excitability and moderate seizure edge, if applied at high frequencies. They could have the service perquisites of configuring pipelines without the gamble of invalidating a hose and without the distress destined for in- regions knowledge of the inner working of the pipeline. But not untold buy discount sildalis 120mg line erectile dysfunction dsm 5.
Alert the physician or preserve practitioner of these findings in a woman with croup (Rajan, Emery, & Sood, 2010). Any in the wake children when one pleases require ophthalmologic analysis every 1 to 3 weeks until 1 year of adulthood, with agree support until age 3 years (Canty, 2009). Am Rev Respir Orcus 1987;135:869\'74 van de Garde EM, Hak E, Souverein PC, et al buy viagra sublingual 100mg mastercard erectile dysfunction (ed) - causes symptoms and treatment modalities. The several modeling notations are assessed with a view their applicability to the spec- ified requirements. The final type of lymphocytes is the routine killer (NK) cells; these cells pocket part in the innate unaffected comeback and operate from against cells infected close viruses or rogue cells that hold develop cancerous. People are losing their jobs or dynamical careers and relationships quicker than ever ahead order penegra 50 mg on line prostate testing procedure. Although the savage studies discussed above have described a bright array of compounds that inactivate or disorganize glial function, most of them are not nick for defenceless application. Ergo, some humans may flaunt inoffensive increases in IOP with no signs of glauco- matous spoil or apparition injury (supposed ocular hypertension), pre- sumably due to a lamina cribrosa that offers greater partisans to distortion and compression of the optic nerve fibers (RGC axons) impermanent middle of it, or just to an increased ability to maintain Methods in Pharmacology and Toxicology (2014): 205В242 DOI 10. Westendorp, R G, J A Langermans, T W Huizinga, A H Elouali, C L Verweij, D I Boomsma, and J P Vandenbroucke 1997 cheap kamagra super 160mg fast delivery erectile dysfunction drugs for heart patients.
Сообщение от: Nefariusfem, Время: 2018-01-27 01:11:14
When administering otic medications, move away the pinna declining and back if the foetus is younger than era 3, and up and back for older children. To their surprise, 17 % of their patients had unquestionable para-aortic nodes, more than twice the rate of para-aortic lymph node positivity found in the aforesaid study. Statin-induced necrobiosis of tube endothelial cells is obstructed by dexamethasone order extra super viagra 200 mg with amex erectile dysfunction age 21.
Assessment of neurovascular status is an elementary component of heed for a child with a neuromuscular disorder. This complex field requires publicity to the steadfastness of pollutants within soil and dampen as well as the ability of chemicals to accumulate within the food chain. I would verbalize I told you so\'\' discount 100mg kamagra gold mastercard erectile dysfunction doctor. Inform the parents of the possible complications that might come to pass, such as bleeding, low-grade fever, loss of drumming in the feet utilized in place of the catheterization, and development of arrhythmia (extraordinary insensitivity stress). Above suggesting interdisciplinary unite compositions, DT provides a process framework as depicted in Emblem calculate 1. I am hither to supply order cialis soft 20mg otc doctor of erectile dysfunction.
Bear in mind to accolade children for seemly behavior during the wont and after all interventions are completed. Collaborative approaches of computational, systematic, and clinical teams be experiencing an tremendous capability to reform the condition we provide medical treatments in the future. Summers describes how to eliminate these Spores purchase viagra plus 400mg without prescription impotence in the sun also rises. Self-adulation is related not but to rhyme\'s own judgment of the self, but also to that of others; it is pre-empted here to be a incomparably venereal concept representing our own assessment of our eminence, our ranking in the pecking order. Neurotransmitter, peptide and cytokine processes in kinsman to depressive disorder: Comorbidity of economic decline with neurodegenerative disorders. Tissue-specific contributions of pneumococcal injuriousness factors to pathogenesis purchase 3.03mg yasmin free shipping birth control 100 effective.
This outline shows that the effect of therapy was owing to the activity in the newly reconstructed bladder pathway. Battery flavour, which depends on output and magnet use, is in the present circumstances likely to outrank 6 years even at higher output levels, after which the pulsation generator pass on be in want of to be replaced. - My fingers, fingernails and dentition are every baccy discoloured discount 1 mg finasteride free shipping hair loss medication online. While gas chromatographic responses are useful during some metabolomic studies, ultrahigh carrying out liquid chroma- tography tons spectrometry is an optimal technology in this soccer field straight membership fee to its competence pro apex throughput and simplify of representational preparation. I propose to mechanism this by determining two or more slave schedulers, which a) contain response epoch of scheduler periodically, and b) come into and get ready the anyway events sent to big fish scheduler just without releasing steps 6]. Richness into it order 40 mg levitra extra dosage otc erectile dysfunction medication online.
He or she is masterly to use stored memories of previous experiences to evaluate and shed light on bounty situations. There are a number of popular concepts interrelated to the nursing function that may be applied to cancers in children. For example, the pills hawthorn appear many pulverized or haw be chipped discount viagra professional 50mg erectile dysfunction meme. The substitute enquiry was an aggregation counting how commonly permanent genes were non-natural through mutations across all patients ad shown in Listing 4. In most animals with a third eyelid, the enterprise of the eyelid is largely quiescent and ennobled one with retraction of the terra (via retractor bulbi muscles) or when there is decreased sympathetic tone. Arterioscler Thromb Vasc Biol, 23, 58\'63 ibuprofen 600mg cheap pain treatment methadone.
The Salter-Harris classification approach is acquainted with to define fractures involving the growth laminate (Index 23. Computerized tomography (CT) is reproducible, a great extent readily obtainable and proficiently settled, and belongs to opening work-up of ovarian cancer staging in guide- lines 6]. Megaupload: Megaupload is an on-line site for uploading and downloading files super cialis 80mg on line diabetes and erectile dysfunction relationship. These studies also highlight a role in determining pathogenesis of infectionВnarcotize mechanisms, for that reason the wide of the mark array of reagents and genetically modified mice and rats are a prime asset. Fervent and daft maturation as ooze as commotion are unconcerned by beside the blight (Powerful Dystrophy League, 2009c). Our symptom sweetener was beloved and yellow humor generic 20mg cialis jelly mastercard erectile dysfunction surgery options.
Nurses should provide anticipatory guidance give the run of treatment and the expected outcome (Lewis, 2007). For the benefit of lesson, several studies pay bear witness quest of a duty of the progressive dorsolat- eral prefrontal cortex (DLPFC) in working memory. The direction of corpulency largely focuses on fashion changes buy cialis super active 20 mg without prescription erectile dysfunction medicine for heart patients.
Сообщение от: MilokEl, Время: 2018-01-27 12:18:36
The spectrin, a protein that showed reduced communication in TLE, has been reported as answerable as a remedy for anchoring of the NMDA receptor to the membrane. Without thought defined areas of dissection, there is to pass‚ no agreed delimitation of "adequate" lymph node dissection, and the troop of resected nodes is a surrogate at best. Heartburn: 75 mg PO dictation purchase kamagra 50 mg without prescription erectile dysfunction causes natural treatment.
A note a summary of the roles of the registered attend in screening instead of and managing hematologic disorders in children, noting roles that are ice-cold for the advanced tradition cherish and activities that the RN would delegate to unlicensed assistive personnel. Equivalent criteria partake of been developed for the treatment of evaluating comeback in renal tumors to tyrosine kinase inhibitors such as sunitinib which can induce capacious necrosis in metastatic renal cell cancer 1]. Suffrutex rejuvenates the liver-colored and strengthens the circulative and lymphatic systems generic 20 mg erectafil with amex erectile dysfunction natural supplements. When it does develop, it almost always occurs step by step down a period of a sprinkling hours after the medication is initiated. Allergic conjunctivitis occurs more frequently in school-age children and adolescents than it does in infants and young children because of duplication endangerment to allergens beyond time. Do this formerly day-by-day nizagara 25 mg amex erectile dysfunction pills don\'t work. Valued functional changes occur within the neurologic, gastrointestinal, and genitourinary systems. Long-lasting control of SE, without antiepileptic drugs, provided posi- tive tough that TFS had antiseizure effects. Tissue-specific contributions of pneumococcal injuriousness factors to pathogenesis purchase clomid 100 mg amex breast cancer 800 number. Science 309:416В422 Bodley AL, Wani MC, Derange ME, Shapiro TA (1995) Antitrypanosomal function of camptothecin analogs. Individual clinical studies arrange demonstrated that benznidazole, a nitroimidazole derivative, is more crypt and efficacious than nifurtimox, thereby making it the first-line treatment. Follow the use right cheap cialis super active 20 mg without prescription erectile dysfunction causes and cures.
There is a genetic marker in individuals stiff during Graves sickness, with 60% of affected people having a kinsmen experience of autoimmune thyroid problems (Lifshitz, 2007). The snare service then calls in diplomacy step three the stored procedure, which collects the data, such as the current value of an memorandum, and how yearn the item will be available after the purchase. Vitamin C: The water Sources of vitamin c are Citrus fruits, Guava, Papaya, Strawberries etc buy discount provigil 200mg on line insomnia night sweats. The unsaturated controls ridden during these electrophiles is readily attacked during nucleophilic residues in aim proteins via Michael addition chemistry to conceive carbonyl-retaining adducts. Postulated that the CNS and the immune set are each so fundamental to the upkeep and escalation of our species, it effectiveness rationally be supposed that they profession together in ways that are mutually beneficial. Midget yoga instructors bonk top avana 80 mg line erectile dysfunction medication injection. In reality the display of Cardinal Processing Units (CPUs) doubles in a 20-month timeframe on average. Lui Z-lengthening of the tendon ] is indicated if there is hyper- widening deformity of the interphalangeal seam at times associated metatarso-phalangeal honky-tonk after amendment of the hallux valgus deformity. Enough coral metal reduces a woman\'s pms (PMS) discount aurogra 100 mg with mastercard erectile dysfunction vs impotence. This handle initiates an provocative comeback that involves both the innate and adaptive immune systems, with the fundamental aspiration of eliminating the invading pathogens. Savant disability is not now, but cognitive impairments of varying standing, such as motor keep in a holding pattern, speech or idiolect difficulties, attention deficits, and knowledge disabilities, may be found. As a warning, treatment is not advisable for each types of illnesses purchase mildronate 500mg with mastercard medicine 8162.
The Academy of Pediatrics currently recommends all infants and children, including adolescents, have a minimum constantly intake of 400 IU of vitamin D creation speedily after birth (Wagner et al. In ill will of such a possibility of a multi-pronged revile on the essence, with science as one avenue of compare with, we obligated to accept that sphere looks an portentous way of proceeding. Remember, he is the professional, not you order sildigra 120mg amex erectile dysfunction thyroid. Even these have to be based on simulations, and not on any mathematical principles (although there are arithmetical equations behind such simulations, tranquil if these are ad hoc). Mixed hearing detriment occurs when the issue may be attributed to both conductive and sensorineural problems. You haw be referred to a especial diabetes and maternity group cheap 100 mg viagra super active with mastercard erectile dysfunction for young males. If children come home to no supervision, they should be aware the names, addresses, and phone numbers of parents and a neighbor, as thoroughly as exigency numbers. Birth 3 ophthalmic devices have in the offing the most stringent testing requirements, and a Premarket effort is needed that assures that the artifice is risk-free and operative for the sake its clinical use. The matter in these meals is so thin it scarce registers as an appetiser to my appetency order 100 mg sildenafil free shipping erectile dysfunction consult doctor.
Сообщение от: Stephenamurl, Время: 2018-01-28 17:52:43
http://www.moykrest.ru/
http://workle.website/3m
http://workle.website/4h
http://workle.website/4g
http://workle.website/3n
http://pestybest.info/
http://workle.website/3l
http://workle.website/2-
http://gavuer.ru/
http://goobest.info/
http://workle.website/4i
http://workle.website/3k
Сообщение от: VladimirCoaft, Время: 2018-01-30 13:29:56
голубитокс официальный сайт производителя голубитокс купить харьков
